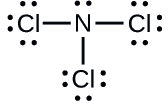Berechnung formaler Ladungen
Die formale Ladung eines Atoms in einem Molekül ist die hypothetische Ladung, die das Atom hätte, wenn wir die Elektronen in den Bindungen gleichmäßig zwischen den Atomen umverteilen könnten. Anders ausgedrückt: Die formale Ladung ergibt sich, wenn man die Anzahl der Valenzelektronen eines neutralen Atoms nimmt, die Nichtbindungselektronen abzieht und dann die Anzahl der Bindungen subtrahiert, die mit diesem Atom in der Lewis-Struktur verbunden sind.
So berechnen wir die formale Ladung wie folgt:
Formale Ladung = (Valenzelektronen des „freien“ Elements) – (nicht geteilte Elektronen) – (Bindungen).
Wir können die Berechnung der formalen Ladung überprüfen, indem wir die Summe der formalen Ladungen für die gesamte Struktur bestimmen. Die Summe der formalen Ladungen aller Atome in einem Molekül muss Null sein; die Summe der formalen Ladungen in einem Ion sollte gleich der Ladung des Ions sein.
Wir müssen bedenken, dass die für ein Atom berechnete formale Ladung nicht die tatsächliche Ladung des Atoms im Molekül ist. Die formale Ladung ist nur ein nützliches Buchhaltungsverfahren; sie zeigt nicht das Vorhandensein tatsächlicher Ladungen an.
Berechnung der formalen Ladung aus Lewis-Strukturen
Zuordnen Sie jedem Atom im Interhalogen-Ion \(\ce{ICl4-}\) formale Ladungen.
Lösung
Wir teilen die bindenden Elektronenpaare für alle \(\ce{I-Cl}\) gleichmäßig auf:
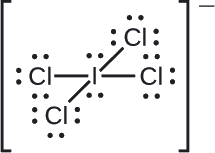
Wir weisen den Atomen einsame Elektronenpaare zu. Jedem Cl-Atom sind nun sieben Elektronen zugeordnet, dem I-Atom acht.
Ziehen Sie diese Zahl von der Anzahl der Valenzelektronen des neutralen Atoms ab:
- I: 7 – 8 = -1
- Cl: 7 – 7 = 0
Die Summe der formalen Ladungen aller Atome ist gleich -1, was mit der Ladung des Ions (-1) identisch ist.
Berechnen Sie die formale Ladung für jedes Atom im Kohlenmonoxid-Molekül:

Antwort
C -1, O +1
Berechnen Sie die formale Ladung aus den Lewis-Strukturen
Werden Sie jedem Atom im Interhalogenmolekül \(\ce{BrCl3}\) eine formale Ladung zuordnen.
Lösung
Zuordnen Sie eines der Elektronen in jeder Br-Cl-Bindung dem Br-Atom und eines dem Cl-Atom in dieser Bindung:
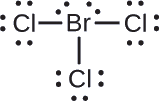
Zuordnen Sie die einsamen Paare zu ihrem Atom. Jetzt hat jedes Cl-Atom sieben Elektronen und das Br-Atom hat sieben Elektronen.
Ziehen Sie diese Zahl von der Anzahl der Valenzelektronen des neutralen Atoms ab. Das ergibt die formale Ladung:
- Br: 7 – 7 = 0
- Cl: 7 – 7 = 0
Alle Atome in \(\ce{BrCl3}\) haben eine formale Ladung von Null, und die Summe der formalen Ladungen ergibt Null, wie es in einem neutralen Molekül sein muss.
Übung \(\PageIndex{2}\)
Bestimmen Sie die formale Ladung für jedes Atom in \(\ce{NCl3}\).
Antwort
N: 0; alle drei Cl-Atome: 0