Magnesiumnitrat dargestellt durch die chemische Formel Mg(NO3)2 oder MgN2O6, die den IUPAC-Namen Magnesiumdinitrat trägt, ist ein weißes kristallines hygroskopisches Pulver, das in Wasser und Alkohol löslich ist. Es ist ein Magnesiumsalz und enthält chemische Bindungen, die von Natur aus ionisch sind .

Magnesiumnitrat
Magnesiumnitrat Kennzeichnung |
|
| CAS-Nummer | 10377-60-3 |
| PubChem CID | 25212 |
| ChemSpider ID | 23415 |
| EC-Nummer | 233-826-7 |
Zusammensetzung und Synthese
Magnesiumnitrat kann durch Kombination von Magnesiumsulfat mit Calciumnitrat hergestellt werden.
MgSO4 + Ca(NO3)2 = Mg(NO3)2 + CaSO4
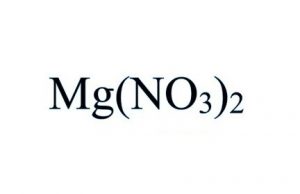
Magnesiumnitrat Formel
Eigenschaften und Merkmale von Magnesium Nitrat
Allgemeine Eigenschaften |
||
| Molare Masse/Molekulargewicht | 148.313 g/mol | |
Physikalische Eigenschaften |
||
| Farbe/Erscheinungsbild | Weiße Kristalle | |
| Schmelzpunkt/Gefrierpunkt | 89°C, 192.2°F | |
| Siedepunkt | 330°C, 626°F | |
| Dichte | 1.46 g cm-3 | |
| Zustand der Materie bei Raumtemperatur (Normalphase) | Festkörper | |
Chemische Eigenschaften |
||
| Löslichkeit in Wasser | 42 g/100 ml (bei 20oC) | |
| pH | 5-7 (sauer) | |
Atomische Eigenschaften |
||
| Kristall Struktur | Kubisch | |
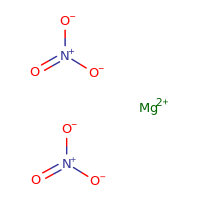
Magnesiumnitrat-Struktur
Einschlägige Reaktionen von Mg(NO3)2
Bei einer chemischen Reaktion zwischen Magnesiumnitrat und Natriumcarbonat entsteht Magnesiumcarbonat und Natriumnitrat .
Mg(NO3)2 + Na2CO3 = MgCO3 + 2NaNO3
Magnesiumnitrat zersetzt sich in Wasser zu Magnesiumhydroxid, Ammoniak und Sauerstoff .
Mg(NO3)2 + 4H2O = Mg(OH)2 + 2NH3 + 4O2
Beim Erhitzen zerfällt Mg(NO3)2 in Magnesiumoxid, Stickstoffdioxid und Sauerstoff.
2Mg(NO3)2 = 2MgO + 4NO2 + O2
Es reagiert mit Natriumhydroxid zu Magnesiumhydroxid und Natriumnitrat.
Mg(NO3)2 + 2NaOH = Mg(OH)2 + 2NaNO3
Magnesiumnitrat Verwendung
- Als sichere Quelle für Nitrat-Ionen
- Bei der Herstellung von stickstoffhaltigen Düngemitteln
- Bei der Pyrotechnik und der Herstellung von konzentrierter Salpetersäure.
- Hilft beim Prillen und Beschichten für die Ammoniumnitratproduktion und ist ein Bestandteil von Kosmetika und Shampoos .
Ist es gefährlich
Als starkes Oxidationsmittel kann es eine Brandgefahr verursachen. Es kann auch eine Explosionsgefahr verursachen, wenn es mit organischen Substanzen in Kontakt gebracht wird. Der Kontakt mit Augen, Haut und das Einatmen sollte vermieden werden, da es zu Reizungen, Husten und Kurzatmigkeit führt. Verschlucken in großen Mengen führt zu Bauchschmerzen, Schwindel, blutigem Durchfall, Erbrechen, Krämpfen, Schwäche und Kollaps.
- Magnesium Nitrate – Pubchem.ncbi.nlm.nih.gov
- Magnesium Nitrate – Chemspider.com
- Magnesium Nitrate – Americanelements.com
- Magnesium Nitrate – Sciencemadness.org
- Magnesium Nitrate Hexahydrate – Sigmaaldrich.com
- Magnesium Nitrate – Chemicalbook.com
- Frage: Magnesiumnitrat und Natriumcarbonat Mg(NO_3)_2 + Na_2 – Chegg.com
- Wie wird die Bilanzgleichung von Magnesiumnitrat plus Wasser bestimmt? – Quora.com
- Die thermische Zersetzung von Magnesiumnitrat – Chemiday.com
- Frage: Natriumhydroxid reagiert mit Magnesiumnitrat zu Magnesiumhydroxid – Chegg.com