.jpg) Die Herstellung von Ammoniak ist für die weltweite Landwirtschaft von entscheidender Bedeutung, denn daraus werden alle stickstoffhaltigen Düngemittel hergestellt.
Die Herstellung von Ammoniak ist für die weltweite Landwirtschaft von entscheidender Bedeutung, denn daraus werden alle stickstoffhaltigen Düngemittel hergestellt.
Verwendungen von Ammoniak
Die Herstellung von Düngemitteln ist die mit Abstand wichtigste Verwendung von Ammoniak. Dazu gehören Harnstoff, Ammoniumsalze (Ammoniumphosphate, Ammoniumnitrat, Calciumammoniumnitrat) und Ammoniaklösungen.
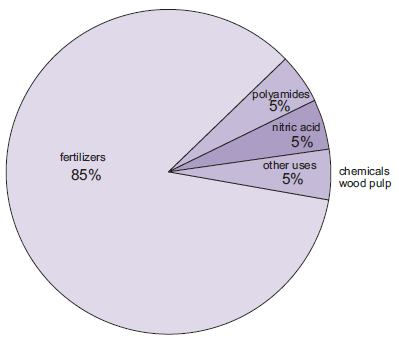
Abbildung 1 Die Anwendungen von Ammoniak.
Eine zunehmende Menge Ammoniak, obwohl noch klein im Vergleich zu anderen Verwendungen, wird als konzentrierte Lösung zur Bekämpfung des Ausstoßes von Stickoxiden aus Kraftwerken verwendet.
Jährliche Produktion von Ammoniak
Ammoniak ist nach Schwefelsäure die Chemikalie mit der größten Tonnage. Es wird zunehmend in Ländern hergestellt, die über kostengünstige Erdgas- und Kohlequellen verfügen (China und Russland haben einen Anteil von ca. 40 %). Die größten Anlagen produzieren etwa 3000 Tonnen pro Tag, und es gibt Pläne für den Bau von Anlagen, die 4000-5000 Tonnen pro Tag produzieren, was bedeuten würde, dass die gesamte Weltproduktion mit 100 solcher Einheiten bewältigt werden könnte. Die aktuelle Produktion ist:
| Welt | 146 Millionen Tonnen |
| China | 48 Millionen Tonnen |
| Russland | 12 Millionen Tonnen |
| Indien | 11 Millionen Tonnen |
| U.S. | 9 Mio. Tonnen |
| Indonesien | 5 Mio. Tonnen |
| Trinidad und Tobago | 5 Millionen Tonnen |
| Ukraine | 4 Millionen Tonnen |
Daten von:
U.S. Geological Survey, Mineral Commodity Summaries, 2016.
Der Anstieg der hergestellten Tonnage von Ammoniak hält gerade mit der zunehmenden Weltbevölkerung und ihrem steigenden Lebensstandard Schritt. Es wird erwartet, dass die Nachfrage nach Ammoniak bis 2018 auf fast 200 Millionen Tonnen ansteigen wird.
1. International Fertilizer Association, 2014.
Herstellung von Ammoniak
Die Herstellung von Ammoniak aus Stickstoff und Wasserstoff erfolgt in zwei Hauptschritten:
a) die Herstellung von Wasserstoff
b) die Synthese von Ammoniak (das Haber-Verfahren)
Die Herstellung von Wasserstoff umfasst mehrere verschiedene Prozesse. Abbildung 2 zeigt deren Abfolge und den Ort innerhalb einer Ammoniakanlage (Schritte1-5). Auch der Konverter, mit dem aus dem Wasserstoff Ammoniak hergestellt wird, ist dargestellt (Schritt 6). Was in jedem dieser Schritte geschieht, ist unterhalb der Abbildung beschrieben.
|
Abbildung 2 Eine Ammoniakanlage in Westaustralien: 1 Entschwefelungsanlagen |
.jpg) |
(a) Die Herstellung von Wasserstoff
Wasserstoff wird aus einer Vielzahl von Rohstoffen hergestellt, meist aus Erdgas, Kohle oder Naphtha. Die Art und Weise, wie Wasserstoff aus diesen Rohstoffen gewonnen wird, wird gesondert behandelt.
Wasserstoff aus Erdgas (Methan)
Dazu gehören zwei Schritte:
i) die Herstellung von Synthesegas (ein Gemisch aus Kohlenmonoxid und Wasserstoff (Dampfreformierung))
ii) die Entfernung des Kohlenmonoxids und die Herstellung eines Gemischs aus Wasserstoff und Stickstoff (die Shift-Reaktion)
(i) Die Herstellung von Synthesegas
Wie auch immer das Methan gewonnen wird, es enthält einige organische Schwefelverbindungen und Schwefelwasserstoff, die beide entfernt werden müssen. Andernfalls vergiften sie den Katalysator, der für die Herstellung von Synthesegas benötigt wird. In der Entschwefelungsanlage werden die organischen Schwefelverbindungen oft zuerst in Schwefelwasserstoff umgewandelt, bevor sie mit Zinkoxid reagieren. Der Einsatzstoff wird mit Wasserstoff gemischt und bei ca. 700 K über einen Katalysator aus Mischoxiden von Kobalt und Molybdän auf einem inerten Träger (einer speziell behandelten Tonerde) geleitet.
.jpg)
Dann werden die Gase bei ca. 700 K über Zinkoxid geleitet und der Schwefelwasserstoff wird entfernt:
.jpg)
Die primäre Dampfreformierung wandelt Methan und Wasserdampf in Synthesegas um, ein Gemisch aus Kohlenmonoxid und Wasserstoff:
.jpg)
Hohe Temperaturen und niedrige Drücke begünstigen die Bildung der Produkte (Prinzip von Le Chatelier). In der Praxis werden die Reaktanten über einen Katalysator aus Nickel geleitet, der fein verteilt auf der Oberfläche eines Kalziumoxid/Aluminiumoxid-Trägers in vertikalen Rohren aus einer Nickellegierung angeordnet ist. Die Rohre, bis zu 350 Stück parallel, werden in einem Ofen über 1000 K und unter einem Druck von ca. 30 atm erhitzt. Dies ist ein Beispiel für einen Rohrreaktor.
Bei der sekundären Dampfreformierung reagiert Sauerstoff aus der Luft mit einem Teil des vorhandenen Wasserstoffs, und das entstehende Gemisch wird über einen Nickelkatalysator geleitet. Der Dampf und die Wärme, die bei der Verbrennung entstehen, reformieren den größten Teil des restlichen Methans. Zu den wichtigsten Reaktionen gehören:
small.jpg)
Das aus dieser netto exothermen Stufe entstehende Gas hat eine Temperatur von ca. 1200 K und wird in Wärmetauschern abgekühlt. Der Dampf, der sich aus dem zur Kühlung der Gase verwendeten Wasser bildet, wird zum Betrieb von Turbinen und damit von Kompressoren sowie zur Vorwärmung von Reaktanten verwendet.
Einige neuere Konstruktionen nutzen die Abwärme des Sekundärreformers direkt zur Wärmeversorgung des Primärreformers.
In dieser Stufe enthält das Gas Wasserstoff, Stickstoff, Kohlenmonoxid und Kohlendioxid sowie etwa 0,25 % Methan. Da Luft 1 % Argon enthält, reichert sich dieses auch im Synthesegas an.
(ii) Die Shift-Reaktion
Dieser Prozess wandelt Kohlenmonoxid in Kohlendioxid um und erzeugt dabei mehr Wasserstoff.
Er findet in zwei Stufen statt. In der ersten, der Hochtemperatur-Shift-Reaktion, wird das Gas mit Wasserdampf vermischt und in einem Festbettreaktor bei ca. 700 K über einen Eisen/Chrom(III)-Oxid-Katalysator geleitet. Dadurch sinkt die Kohlenmonoxid-Konzentration von 11%:
.jpg)
In der zweiten Stufe, der Niedrigtemperatur-Shift-Reaktion, wird das Gasgemisch bei ca. 500 K über einen Kupfer-Zink-Katalysator geleitet. Die Kohlenmonoxid-Konzentration wird weiter auf 0,2% reduziert.
Die Reaktion wird aus mehreren Gründen in zwei Stufen durchgeführt. Die Reaktion ist exotherm. Bei hoher Temperatur ist die Ausgangskonzentration des Kohlenmonoxids aufgrund der Gleichgewichtsregelung jedoch noch recht hoch. Der in der Niedertemperaturstufe verwendete Kupferkatalysator ist sehr empfindlich gegenüber hohen Temperaturen und könnte in der Hochtemperaturstufe nicht effektiv arbeiten. Daher wird der Großteil der Reaktion bei hoher Temperatur durchgeführt, um den größten Teil der Wärme zurückzugewinnen. Das Gas wird dann bei niedriger Temperatur, wo das Gleichgewicht viel günstiger ist, an dem sehr aktiven, aber instabilen Kupferkatalysator entfernt.
Das Gasgemisch enthält jetzt etwa 18 % Kohlendioxid, das durch Waschen des Gases mit einer Lösung einer Base entfernt wird, wobei eine von mehreren verfügbaren Methoden verwendet wird. Bevorzugt wird eine organische Base (im Kohlendioxid-Absorber), eine Lösung eines Ethanolamins, oft 2,2′-(Methylimino)bis-ethanol (N-Methyl-Diethanolamin).
Das Kohlendioxid wird beim Erhitzen der Lösung im Kohlendioxid-Stripper freigesetzt.) Ein Großteil davon wird verflüssigt und zum Beispiel für kohlensäurehaltige Getränke, als Kühlmittel für Kernkraftwerke und zur Wachstumsförderung von Pflanzen in Gewächshäusern verkauft.
Die letzten Spuren von Kohlenstoffoxiden werden entfernt, indem die Gase bei 600 K über einen Nickelkatalysator geleitet werden:
.jpg)
Dieses Verfahren wird als Methanisierung bezeichnet. Es wird ein Gas mit einer typischen Zusammensetzung gewonnen: 74 % Wasserstoff, 25 % Stickstoff, 1 % Methan, dazu etwas Argon.
Wasserstoff aus Naphtha
Wenn Naphtha als Ausgangsstoff verwendet wird, ist eine zusätzliche Reformierungsstufe erforderlich. Das Naphtha wird zu einem Dampf erhitzt, mit Wasserdampf vermischt und durch Rohre geleitet, die auf 750 K erhitzt und mit einem Katalysator, Nickel auf einer Mischung aus Aluminium- und Magnesiumoxiden, gefüllt sind. Das Hauptprodukt ist Methan zusammen mit Kohlenstoffoxiden und wird dann durch Dampfreformierung verarbeitet, als wäre es Erdgas, gefolgt von der Shift-Reaktion.
Wasserstoff aus Kohle
Wenn Kohle verwendet wird, wird sie zunächst fein gemahlen und in einer Atmosphäre aus Sauerstoff und Dampf erhitzt. Ein Teil der Kohle verbrennt sehr schnell im Sauerstoff (in weniger als 0,1 s), wodurch die Temperatur im Ofen ansteigt und der Rest der Kohle mit dem Dampf reagiert:
.jpg)
Das entstehende Gas enthält ca. 55 % Kohlenmonoxid, 30 % Wasserstoff, 10 % Kohlendioxid und geringe Mengen an Methan und anderen Kohlenwasserstoffen. Dieses Gemisch wird durch die Shift-Reaktion aufbereitet.
Zu den Hauptproblemen bei der Verwendung von Kohle gehören die großen Mengen an Schwefeldioxid und Trioxid, die bei der Verbrennung von Kohle entstehen, sowie die erheblichen Mengen an anderen Verunreinigungen wie Arsen und Brom, die allesamt sehr schädlich für die Atmosphäre sind und schwere Gifte für die Katalysatoren im Prozess darstellen. Außerdem gibt es ein massives Problem mit der Entsorgung der Asche.
Wasserstoff aus Biomasse
Aus Biomasse kann Synthesegas hergestellt werden. Der Prozess wird in der Einheit Bioraffinerien beschrieben.
(b) Die Herstellung von Ammoniak (Der Haber-Prozess)
.jpg)
Das Herzstück des Prozesses ist die Reaktion zwischen Wasserstoff und Stickstoff in einem Festbettreaktor. Die Gase werden in stöchiometrischen Verhältnissen erhitzt und unter Druck über einen Katalysator geleitet (Abbildung 3).
.jpg)
Abbildung 3 Schema eines konventionellen Synthesereaktors (Konverter).
Der Anteil des Ammoniaks im Gleichgewichtsgemisch steigt mit zunehmendem Druck und sinkender Temperatur (Le Chatelier’s Prinzip). Die quantitativen Daten sind in Tabelle 1 angegeben. Um eine angemessene Ausbeute und eine günstige Geschwindigkeit zu erhalten, werden hohe Drücke, moderate Temperaturen und ein Katalysator verwendet.
| Druck/atm | Prozentualer Anteil des Ammoniaks im Gleichgewicht bei verschiedenen Temperaturen | |||||
|---|---|---|---|---|---|---|
| 373 K | 473 K | 573 K | 673 K | 773 K | 973 K | |
| 10 | – | 50.7 | 14.7 | 3.9 | 1.2 | 0.2 |
| 25 | 91.7 | 63.6 | 27.4 | 8.7 | 2.9 | – |
| 50 | 94.5 | 74.0 | 39.5 | 15.3 | 5.6 | 1.1 |
| 100 | 96.7 | 81.7 | 52.5 | 25.2 | 10.6 | 2.2 |
| 200 | 98.4 | 89.0 | 66.7 | 38.8 | 18.3 | – |
| 400 | 99.4 | 94.6 | 79.7 | 55.4 | 31.9 | – |
| 1000 | – | 98.3 | 92.6 | 79.8 | 57.5 | 12.9 |
Tabelle 1 Volumenprozent des Ammoniaks im Gleichgewichtsgemisch für die Reaktion
zwischen Stickstoff und Wasserstoff bei verschiedenen Temperaturen und Drücken.
Abhängig von der Konstruktion des Reaktors wird eine große Bandbreite an Bedingungen verwendet. Die verwendeten Temperaturen variieren zwischen 600 und 700 K, die Drücke zwischen 100 und 200 Atmosphären. Es wird viel daran gearbeitet, die Effektivität des Katalysators zu verbessern, so dass Drücke von nur 50 Atmosphären verwendet werden können.
Da die Reaktion exotherm ist, werden kühle Reaktanten (Stickstoff und Wasserstoff) hinzugefügt, um die Temperatur der Reaktoren zu reduzieren (Abbildung 3).
Das Ammoniak wird normalerweise vor Ort gelagert (Schritt 7) und zu einem anderen Teil der Anlage gepumpt, wo es in einen Dünger (Harnstoff oder ein Ammoniumsalz) umgewandelt wird. Manchmal wird es jedoch auch auf dem Seeweg (Abbildung 4) oder auf der Straße transportiert, um in einer anderen Anlage verwendet zu werden.
.jpg) |
Abbildung 4 In einer Anlage in Westaustralien wird das Ammoniak per Pipeline zu einem nahegelegenen Hafen gebracht (Abbildung 2, Schritt 8) und per Schiff transportiert. Dieses transportiert etwa 40 000 Tonnen verflüssigtes Ammoniak. Mit freundlicher Genehmigung von Yara International ASA. |
Der ursprüngliche Katalysator, den Haber verwendete, war Fe3O4, das durch den Reaktanten, Wasserstoff, zu Eisen reduziert wurde. Es wurde viel Arbeit geleistet, um den Katalysator zu verbessern, und es wurde festgestellt, dass eine kleine Menge Kaliumhydroxid als Promotor wirksam war.
In jüngster Zeit konzentrierte sich die Forschung darauf, noch effektivere Katalysatoren zu finden, um den Prozess bei niedrigeren Drücken und Temperaturen ablaufen zu lassen. Ruthenium auf einer Graphitoberfläche ist ein vielversprechender.
.jpg)
Abbildung 5 Die Herstellung von Ammoniak.
Postskript
Das Haber-Verfahren ist für unser Leben von so großer Bedeutung, dass es in einem Zeitraum von fast 90 Jahren mit drei Nobelpreisen für Chemie ausgezeichnet wurde, die alle an deutsche Wissenschaftler gingen – ein bemerkenswerter Rekord.
Der erste wurde 1918 an Fritz Haber verliehen, den Chemiker, der das Verfahren im Labor entwickelte. Der zweite ging an Carl Bosch, dessen brillante Ingenieurskunst das Verfahren im großen Stil realisierbar machte, der aber bis 1931 auf seine Auszeichnung wartete.
Im Jahr 2007 erhielt Gerhard Ertl den Preis für seine Arbeiten zur Katalyse von gasförmigen Reaktionen an Festkörpern. Unter den vielen Reaktionen, die er untersuchte, gelang ihm der Nachweis, dass Stickstoffmoleküle und Wasserstoffmoleküle an der Oberfläche von Eisen adsorbiert werden und dass diese adsorbierten Moleküle in Atome dissoziieren. Diese Atome verbinden sich dann stufenweise zu dem Ammoniakmolekül. Es muss bedacht werden, dass die in diesen Studien verwendeten Bedingungen (bei weniger als 10-10 atm) sich stark von den in der Industrie verwendeten Bedingungen, ca. 150 atm, unterscheiden.
Zusammenfassung
Der gesamte Prozess der Ammoniakherstellung aus Methan ist in Abbildung 5 zusammengefasst. Wenn Kohle oder Naphtha das Ausgangsmaterial ist, werden zusätzliche Prozesse benötigt. Naphtha wird in Methan und Kohlenstoffoxide umgewandelt, bevor es in den Primärreformer und von dort in die Shift-Reaktion gelangt. Kohle wird ebenfalls in Wasserstoff und Kohlenstoffoxide umgewandelt und diese Mischung durchläuft dann die Shift-Reaktion.