- Nennen Sie die moderne Atomtheorie.
- Lernen Sie, wie Atome aufgebaut sind.
Das kleinste Stück eines Elements, das die Identität dieses Elements beibehält, wird Atom genannt. Einzelne Atome sind extrem klein. Man bräuchte etwa fünfzig Millionen Atome in einer Reihe, um eine Linie zu bilden, die 1 cm lang ist. Der Punkt am Ende eines gedruckten Satzes hat mehrere Millionen Atome in sich. Atome sind so klein, dass es schwer zu glauben ist, dass alle Materie aus Atomen besteht – aber das tut sie.
Das Konzept, dass Atome eine fundamentale Rolle in der Chemie spielen, wird durch die moderne Atomtheorie formalisiert, die erstmals 1808 von John Dalton, einem englischen Wissenschaftler, aufgestellt wurde. Sie besteht aus drei Teilen:
- Alle Materie ist aus Atomen aufgebaut.
- Atome desselben Elements sind gleich; Atome verschiedener Elemente sind verschieden.
- Atome verbinden sich in ganzzahligen Verhältnissen zu Verbindungen.
Diese Konzepte bilden die Grundlage der Chemie.
Obwohl das Wort Atom von einem griechischen Wort stammt, das „unteilbar“ bedeutet, verstehen wir heute, dass Atome selbst aus kleineren Teilen zusammengesetzt sind, die man subatomare Partikel nennt. Das erste Teil, das entdeckt wurde, war das Elektron, ein winziges subatomares Teilchen mit einer negativen Ladung. Es wird oft als e- dargestellt, wobei der rechte hochgestellte Buchstabe die negative Ladung anzeigt. Später wurden zwei größere Teilchen entdeckt. Das Proton ist ein massereicheres (aber immer noch winziges) subatomares Teilchen mit einer positiven Ladung, dargestellt als p+. Das Neutron ist ein subatomares Teilchen mit etwa der gleichen Masse wie ein Proton, aber ohne Ladung. Es wird entweder als n oder n0 dargestellt. Wir wissen nun, dass alle Atome aller Elemente aus Elektronen, Protonen und (mit einer Ausnahme) Neutronen aufgebaut sind. In Tabelle 3.1 „Eigenschaften der drei subatomaren Teilchen“ sind die Eigenschaften dieser drei subatomaren Teilchen zusammengefasst.
Tabelle 3.1 Eigenschaften der drei subatomaren Teilchen
| Name | Symbol | Masse (ca.; kg) | Ladung | |
|---|---|---|---|---|
| Proton | p+ | 1.6 × 10-27 | 1+ | Neutron | n, n0 | 1,6 × 10-27 | keine |
| Elektron | e- | 9.1 × 10-31 | 1- |
Wie sind diese Teilchen im Atom angeordnet? Sie sind nicht zufällig angeordnet. Experimente von Ernest Rutherford in England in den 1910er Jahren wiesen auf ein Kernmodell des Atoms hin. Die relativ massereichen Protonen und Neutronen sammeln sich im Zentrum eines Atoms, in einem Bereich, der als Atomkern (Plural: Nuclei) bezeichnet wird. Die Elektronen befinden sich außerhalb des Kerns und verbringen ihre Zeit auf einer Umlaufbahn im Raum um den Kern. (Siehe Abbildung 3.1 „Der Aufbau des Atoms“.)
Abbildung 3.1 Der Aufbau des Atoms
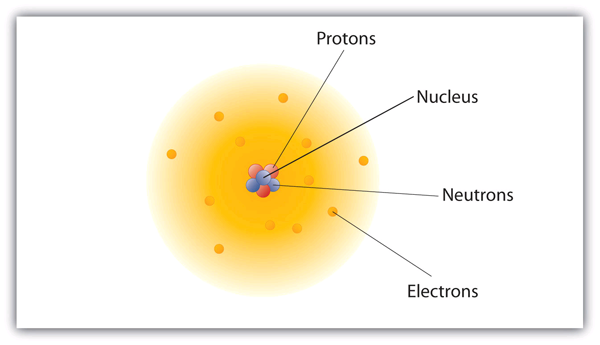
Atome haben Protonen und Neutronen im Zentrum, die den Kern bilden, während die Elektronen den Kern umkreisen.
Die moderne Atomtheorie besagt, dass die Atome eines Elements gleich sind, während die Atome verschiedener Elemente unterschiedlich sind. Was macht Atome verschiedener Elemente unterschiedlich? Die grundlegende Eigenschaft, die alle Atome desselben Elements gemeinsam haben, ist die Anzahl der Protonen. Alle Atome von Wasserstoff haben ein und nur ein Proton im Kern; alle Atome von Eisen haben 26 Protonen im Kern. Diese Anzahl der Protonen ist so wichtig für die Identität eines Atoms, dass sie als Ordnungszahl des Elements bezeichnet wird. So hat Wasserstoff eine Ordnungszahl von 1, während Eisen eine Ordnungszahl von 26 hat. Jedes Element hat seine eigene charakteristische Ordnungszahl.
Atome desselben Elements können jedoch eine unterschiedliche Anzahl von Neutronen haben. Atome desselben Elements (d.h. Atome mit der gleichen Anzahl von Protonen) mit unterschiedlicher Anzahl von Neutronen werden als Isotope bezeichnet. Die meisten natürlich vorkommenden Elemente existieren als Isotope. Zum Beispiel haben die meisten Wasserstoffatome ein einziges Proton in ihrem Kern. Eine kleine Anzahl (etwa eines von einer Million) von Wasserstoffatomen hat jedoch ein Proton und ein Neutron in ihrem Kern. Dieses besondere Isotop des Wasserstoffs wird Deuterium genannt. Eine sehr seltene Form des Wasserstoffs hat ein Proton und zwei Neutronen im Kern; dieses Isotop des Wasserstoffs wird Tritium genannt. Die Summe der Anzahl der Protonen und Neutronen im Kern wird als Massenzahl des Isotops bezeichnet.
Neutrale Atome haben die gleiche Anzahl von Elektronen wie Protonen, ihre Gesamtladung ist also Null. Wie wir später sehen werden, ist dies jedoch nicht immer der Fall.
Beispiel 1
- Die häufigsten Kohlenstoffatome haben sechs Protonen und sechs Neutronen in ihren Kernen. Wie lauten die Ordnungszahl und die Massenzahl dieser Kohlenstoffatome?
- Ein Isotop des Urans hat die Ordnungszahl 92 und die Massenzahl 235. Wie groß ist die Anzahl der Protonen und Neutronen im Kern dieses Atoms?
Lösung
- Wenn ein Kohlenstoffatom sechs Protonen im Kern hat, dann ist seine Ordnungszahl 6. Wenn es auch sechs Neutronen im Kern hat, dann ist die Massenzahl 6 + 6, also 12.
- Wenn die Ordnungszahl des Urans 92 ist, dann ist das die Anzahl der Protonen im Kern. Da die Massenzahl 235 ist, ist die Anzahl der Neutronen im Kern 235 – 92, also 143.
Test Yourself
Die Anzahl der Protonen im Kern eines Zinnatoms ist 50, die Anzahl der Neutronen im Kern ist 68. Wie lauten die Ordnungszahl und die Massenzahl dieses Isotops?
Antwort
Atomzahl = 50, Massenzahl = 118
Wenn wir von einem Atom sprechen, verwenden wir einfach den Namen des Elements: Der Begriff Natrium bezeichnet sowohl das Element als auch ein Atom des Natriums. Aber es kann unhandlich sein, ständig den Namen von Elementen zu verwenden. Stattdessen definiert die Chemie für jedes Element ein Symbol. Das Atomsymbol ist eine ein- oder zweibuchstabige Abkürzung für den Namen des Elements. Konventionell wird der erste Buchstabe eines Elementsymbols immer großgeschrieben, während der zweite Buchstabe (falls vorhanden) klein geschrieben wird. Das Symbol für Wasserstoff ist also H, das Symbol für Natrium ist Na und das Symbol für Nickel ist Ni. Die meisten Symbole leiten sich vom englischen Namen des Elements ab, obwohl einige Symbole vom lateinischen Namen eines Elements abgeleitet sind. (Das Symbol für Natrium, Na, stammt von seinem lateinischen Namen, Natrium.) In Tabelle 3.2 „Namen und Symbole der gebräuchlichen Elemente“ sind einige gebräuchliche Elemente und ihre Symbole aufgeführt. Sie sollten sich die Symbole in Tabelle 3.2 „Namen und Symbole der gebräuchlichen Elemente“ einprägen, da wir die Elemente in der gesamten Chemie so darstellen werden.
Tabelle 3.2 Namen und Symbole der gängigen Elemente
Element NameSymbol
| Element Name | Symbol | |||
|---|---|---|---|---|
| Aluminium | Al | Quecksilber | Hg | |
| Argon | Ar | Molybdän | Mo | |
| Arsen | As | Neon | Ne | Barium | Ba | Nickel | Ni |
| Beryllium | Be | Stickstoff | N | |
| Bismut | Bi | Sauerstoff | O | |
| Bor | B | Palladium | Pd | |
| Brom | Br | Phosphor | P | |
| Calcium | Ca | Platin | Pt | |
| Kohlenstoff | C | Kalium | K | Chlor | Cl | Radium | Ra |
| Chrom | Cr | Radon | Rn | Cobalt | Co | Rubidium | Rb |
| Kupfer | Cu | Scandium | Sc | |
| Fluor | F | Selenium | Se | |
| Gallium | Ga | Silizium | Si | |
| Germanium | Ge | Silber | Ag | |
| Gold | Au | Natrium | Na | Helium | He | Strontium | Sr |
| Wasserstoff | H | Schwefel | S | |
| Iod | I | Tantal | Ta | |
| Iridium | Ir | Zinn | Sn | |
| Eisen | Fe | Titan | Ti | |
| Krypton | Kr | Wolfram | W | |
| Blei | Pb | Uran | U | |
| Lithium | Li | Xenon | Xe | |
| Magnesium | Mg | Zink | Zn | Mangan | Mn | Zirkonium | Zr |
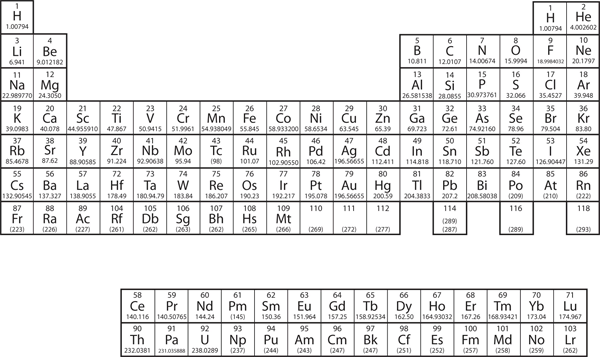
Die Elemente sind in einer speziellen Tabelle, dem Periodensystem, gruppiert. Ein einfaches Periodensystem ist in Abbildung 3.2 „Ein einfaches Periodensystem“ dargestellt, während ein umfangreicheres in Kapitel 17 „Anhang: Periodensystem der Elemente“. Die Elemente im Periodensystem sind in der Reihenfolge der aufsteigenden Ordnungszahl aufgeführt. Das Periodensystem hat eine besondere Form, die für uns wichtig werden wird, wenn wir die Organisation der Elektronen in den Atomen betrachten (siehe Kapitel 8 „Elektronische Struktur“). Eine unmittelbare Verwendung des Periodensystems hilft uns, Metalle und Nichtmetalle zu identifizieren. Nichtmetalle befinden sich in der oberen rechten Ecke des Periodensystems, auf einer Seite der dicken Linie, die den rechten Teil des Diagramms teilt. Alle anderen Elemente sind Metalle.
Abbildung 3.2 Ein einfaches Periodensystem
Es gibt eine einfache Möglichkeit, Isotope mit Hilfe der Atomsymbole darzustellen. Wir verwenden die Konstruktion
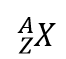
wobei X das Symbol des Elements, A die Massenzahl und Z die Ordnungszahl ist. Für das Isotop von Kohlenstoff, das 6 Protonen und 6 Neutronen hat, lautet das Symbol also
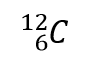
wobei C das Symbol für das Element ist, 6 die Ordnungszahl und 12 die Massenzahl darstellt.
Beispiel 2
- Wie lautet das Symbol für ein Isotop des Urans, das eine Ordnungszahl von 92 und eine Massenzahl von 235 hat?
- Wie viele Protonen und Neutronen sind in 26Fe?
Lösung
- Das Symbol für dieses Isotop ist
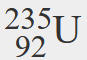
- Dieses Eisenatom hat 26 Protonen und 56 – 26 = 30 Neutronen.
Test Yourself
Wie viele Protonen sind in 11N?
Antwort
11 Protonen
Es ist auch üblich, die Massenzahl hinter dem Namen eines Elements anzugeben, um ein bestimmtes Isotop zu kennzeichnen. Kohlenstoff-12 steht für ein Isotop von Kohlenstoff mit 6 Protonen und 6 Neutronen, während Uran-238 ein Isotop von Uran ist, das 146 Neutronen hat.
Key Takeaways
- Die Chemie basiert auf der modernen Atomtheorie, die besagt, dass alle Materie aus Atomen besteht.
- Atome selbst bestehen aus Protonen, Neutronen und Elektronen.
- Jedes Element hat seine eigene Ordnungszahl, die gleich der Anzahl der Protonen in seinem Kern ist.
- Isotope eines Elements enthalten eine unterschiedliche Anzahl von Neutronen.
- Elemente werden durch ein Atomsymbol dargestellt.
- Das Periodensystem ist eine Tabelle, die alle Elemente organisiert.
Übungen
Zählen Sie die drei Aussagen auf, aus denen die moderne Atomtheorie besteht.
Erläutern Sie, wie Atome aufgebaut sind.
Welches ist größer, ein Proton oder ein Elektron?
Welches ist größer, ein Neutron oder ein Elektron?
Welche Ladungen haben die drei subatomaren Teilchen jeweils?
Wo befindet sich die meiste Masse eines Atoms?
Zeichnen Sie ein Diagramm eines Bor-Atoms, das fünf Protonen und sechs Neutronen in seinem Kern hat.
Zeichnen Sie ein Diagramm eines Heliumatoms, das zwei Protonen und zwei Neutronen in seinem Kern hat.
Bestimmen Sie die Ordnungszahl. Wie lautet die Ordnungszahl für ein Boratom?
Wie lautet die Ordnungszahl von Helium?
Bestimmen Sie Isotope und geben Sie ein Beispiel.
Was ist der Unterschied zwischen Deuterium und Tritium?
Welches Paar stellt Isotope dar?
a) ![]()
b) 26F und 25M
c) 14S und 15P
14. Welches Paar stellt Isotope dar?
a) 20C und 19K
b) 26F und 26F
c) 92U und 92U
15. Gib die vollständigen Symbole jedes Atoms an, einschließlich der Ordnungszahl und der Massenzahl.
a) ein Sauerstoffatom mit 8 Protonen und 8 Neutronen
b) ein Kaliumatom mit 19 Protonen und 20 Neutronen
c) ein Lithiumatom mit 3 Protonen und 4 Neutronen
16. Gib die vollständigen Symbole der einzelnen Atome an, einschließlich der Ordnungszahl und der Massenzahl.
a) ein Magnesiumatom mit 12 Protonen und 12 Neutronen
b) ein Magnesiumatom mit 12 Protonen und 13 Neutronen
c) ein Xenonatom mit 54 Protonen und 77 Neutronen
17. Americium-241 ist ein Isotop, das in Rauchmeldern verwendet wird. Wie lautet das vollständige Symbol für dieses Isotop?
18. Kohlenstoff-14 ist ein Isotop, das verwendet wird, um radioaktive Datierungstests an früher lebendem Material durchzuführen. Wie lautet das vollständige Symbol für dieses Isotop?
19. Gib die Atomsymbole für jedes Element an.
a) Natrium
b) Argon
c) Stickstoff
d) Radon
20. Gib die Atomsymbole für jedes Element an.
a) Silber
b) Gold
c) Quecksilber
d) Jod
21. Nenne den Namen des Elements.
a) Si
b) Mn
c) Fe
d) Cr
22. Nennen Sie den Namen des Elements.
a) F
b) Cl
c) Br
d) I
Antworten
Alle Materie besteht aus Atomen; Atome desselben Elements sind gleich, und Atome verschiedener Elemente sind verschieden; Atome verbinden sich in ganzzahligen Verhältnissen zu Verbindungen.
Ein Proton ist größer als ein Elektron.
Proton: 1+; Elektron: 1-; Neutron: 0

Die Ordnungszahl gibt die Anzahl der Protonen in einem Kern an. Bor hat die Ordnungszahl fünf.
Isotope sind Atome desselben Elements, aber mit unterschiedlicher Anzahl von Neutronen.  sind Beispiele.
sind Beispiele.
a) Isotope
b) nicht Isotope
c) nicht Isotope
a) ![]()
b) 19K
c) ![]()
95A
a) Na
b) Ar
c) N
d) Rn
a) Silizium
b) Mangan
c) Eisen
d) Chrom