
Ein weiblicher Nordpazifischer Riesenkrake (Enteroctopus dofleini) lebt drei bis vier Jahre; es legt Tausende von Eiern in einem einzigen Kampf und stirbt dann. Im Gegensatz dazu lebt ein ausgewachsener Küstenmammutbaum (Sequoia sempervirens) viele hundert Jahre und produziert jedes Jahr Millionen von Samen (Abbildung 1). Wie diese beiden Beispiele zeigen, unterscheiden sich Organismen dramatisch darin, wie sie sich entwickeln, wie lange sie zum Wachsen brauchen, wann sie reif werden, wie viele Nachkommen einer bestimmten Größe sie produzieren und wie lange sie leben. Zusammen definieren die alters-, größen- oder stadienspezifischen Muster von Entwicklung, Wachstum, Reifung, Fortpflanzung, Überleben und Lebensspanne den Lebenszyklus eines Organismus, seine Lebensgeschichte.

Das Hauptziel der Lebensgeschichtstheorie, einem Zweig der Evolutionsökologie, ist es, die bemerkenswerte Vielfalt der Lebensgeschichten der Arten zu erklären. Aber es gibt noch einen weiteren, zwingenderen Grund, warum die Evolution der Lebensgeschichte wichtig ist: Die Anpassung durch natürliche Selektion basiert auf der Variation der darwinistischen Fitness zwischen den Individuen, und da die Merkmale der Lebensgeschichte das Überleben und die Fortpflanzung bestimmen, sind sie die Hauptkomponenten der Fitness. Bei der Erforschung der lebensgeschichtlichen Evolution geht es also um das Verständnis der Anpassung, dem grundlegendsten Thema der Evolutionsbiologie.
Hier führen wir in die Grundlagen der Lebensgeschichtstheorie ein und geben einen Überblick darüber, was Biologen über die lebensgeschichtliche Evolution gelernt haben. Für eine ausführlichere Darstellung verweisen wir auf Stearns (1992), Roff (1992, 2002), Charlesworth (1994) und Flatt und Heyland (2011). Siehe auch die Artikel von Shefferson (2010), Young (2010) und Fabian und Flatt (2011).
Die Grundlagen der Lebensgeschichtstheorie
Die Lebensgeschichtstheorie versucht zu erklären, wie die natürliche Selektion und andere evolutionäre Kräfte Organismen formen, um ihr Überleben und ihre Fortpflanzung angesichts ökologischer Herausforderungen durch die Umwelt zu optimieren (Stearns 1992, Roff 1992, Stearns 2000), oder wie David Reznick es kürzlich formuliert hat: „Die Theorie der Lebensgeschichte sagt voraus, wie die natürliche Selektion die Art und Weise prägen sollte, wie Organismen ihre Ressourcen für die Erzeugung von Babys einsetzen“ (Reznick 2010, S. 124). Die Theorie tut dies, indem sie die Evolution von Fitnesskomponenten, sogenannten Life History Traits, und deren Zusammenspiel analysiert: Größe bei der Geburt; Wachstumsmuster; Alter und Größe bei der Reife; Anzahl, Größe und Geschlecht der Nachkommen; alters-, stadien- oder größenspezifische Reproduktionsanstrengungen; alters-, stadien- oder größenspezifische Überlebensraten; und Lebensspanne.
Die klassische Theorie behandelt die Evolution der Lebensgeschichte als ein Optimierungsproblem: Wenn bestimmte ökologische Faktoren (z. B. Fressfeinde, Nahrung) die Überlebens- und Fortpflanzungswahrscheinlichkeit eines Organismus beeinflussen und wenn es begrenzende Einschränkungen und Kompromisse gibt, die dem Organismus eigen sind, was sind dann die optimalen Werte und Kombinationen von Merkmalen der Lebensgeschichte, die den Fortpflanzungserfolg maximieren? Um die Lösung dieses Problems zu finden, müssen wir seine „Randbedingungen“ verstehen (Stearns 2000): (1) wie extrinsische, umweltbedingte Faktoren das Überleben und die Fortpflanzung beeinflussen; und (2) wie intrinsische Verbindungen zwischen den Lebensgeschichtsmerkmalen (trade-offs) und andere Beschränkungen begrenzen, ob und wie sich Lebensgeschichtsmerkmale entwickeln können. Sobald diese Bedingungen verstanden und definiert sind, können Lebensverlaufsmodelle verwendet werden, um Fragen zu beantworten wie: Wie klein oder groß sollte ein Organismus werden? In welchem Alter und in welcher Größe sollte er reifen? Wie oft sollte er sich fortpflanzen? Wie viele Nachkommen sollte er produzieren und welche Größe sollten sie haben? Wie lange soll es sich fortpflanzen und wie lange soll es leben?
Lebensdaueroptimierungsprobleme werden typischerweise mit Hilfe der Euler-Lotka-Gleichung modelliert, die die Populationswachstumsrate (d.h., Fitness) eines klonalen Genotyps (oder einer Allelsubstitution) in kontinuierlicher Generationszeit als eine Funktion seines Alters bei der Reife, des Alters bei der letzten Reproduktion, der altersspezifischen Überlebenswahrscheinlichkeit und der erwarteten altersspezifischen Anzahl von Nachkommen beschreibt (Stearns 1992, Roff, 1992, Brommer 2000):
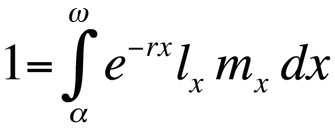
Dabei ist α das Alter bei der ersten Reproduktion, ω das Alter bei der letzten Reproduktion, lx die Wahrscheinlichkeit, von der Geburt bis zur Altersklasse x zu überleben, mx die erwartete Anzahl der Nachkommen in der Altersklasse x und r die Populationswachstumsrate oder der malthusianische Parameter. Die Gleichung summiert die Überlebens- und Reproduktionswahrscheinlichkeiten über die gesamte Lebenszeit der Individuen in der Population und kann dann für r gelöst werden. Beachten Sie, dass r im Kontext der Lebensgeschichtstheorie die Wachstumsrate oder Fitness eines Klons misst oder, bei sexuell reproduzierenden Organismen, die Ausbreitungsrate eines Allels, das die Lebensgeschichte beeinflusst. Die implizite Annahme ist also, dass die modellierte Population aus phänotypisch und genetisch identischen Individuen besteht. Wenn die durch die Euler-Lotka-Gleichung beschriebene Population stationär (nicht wachsend) ist, ist r Null und die Gleichung wird
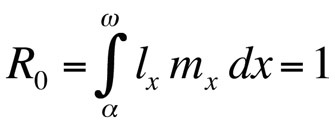
oder, wenn die Generationszeit diskret ist,
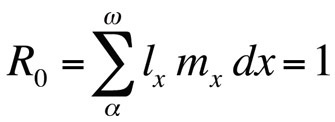
Wobei R0 die erwartete Anzahl von Töchtern pro Weibchen pro Leben ist (Netto-Reproduktionsrate). Diese Gleichung ist einfacher als die zeitkontinuierliche Version und kann immer dann verwendet werden, wenn r Null oder nahe Null ist; für stabile Populationen, die sich in ihrer Größe nicht ändern, ist R0 das geeignete Fitnessmaß (Stearns 1992, Roff 1992, Brommer 2000). Unter Verwendung dieses Rahmens kann man fragen, welche bestimmte Kombination von Lebensgeschichtsmerkmalen die Fitness maximiert, oder wie stark die Fitness beeinflusst wird, wenn eines der Merkmale verändert wird. Dieser Ansatz wurde mit großem Erfolg zur Vorhersage der Evolution von Lebensgeschichtsmerkmalen verwendet.
Genetische Variation für lebensgeschichtliche Merkmale
Die Evolution von lebensgeschichtlichen Merkmalen durch natürliche Selektion hängt von genetischer Variation ab, auf die die Selektion einwirken kann, um Anpassungen als Reaktion auf die Umwelt zu erzeugen. Die oben erwähnten Modelle gehen implizit davon aus, dass die Evolution der Lebensgeschichte nicht durch einen Mangel an genetischer Variation begrenzt ist. Interessanterweise ist jedoch die Heritabilität (h2 = VA/VP = additive genetische Varianz geteilt durch phänotypische Varianz), d.h. der Anteil der phänotypischen Unterschiede zwischen Individuen in einer Population, der durch additive genetische Unterschiede zwischen ihnen erklärt wird, für lebensgeschichtliche Merkmale in der Regel gering. Diese niedrige Heritabilität könnte durch geringe Mengen an additiver genetischer Varianz verursacht werden; dennoch gibt es reichlich genetische Variation für lebensgeschichtliche Merkmale in natürlichen und Laborpopulationen. In Übereinstimmung mit der Vorstellung, dass Fitness-Komponenten viel genetische Variation beherbergen, haben viele künstliche Selektionsexperimente im Labor erfolgreich evolutionäre Veränderungen in lebensgeschichtlichen Merkmalen in der vorhergesagten Richtung bewirkt (Stearns 1992, Roff 1992, Houle 2001). Ein Grund für die große VA von Lebensgeschichtsmerkmalen könnte sein, dass es sich um hochkomplexe, quantitative, polygene Merkmale handelt, die von vielen Loci beeinflusst werden (Houle 1992).
Aber wie lässt sich die Tatsache vereinbaren, dass der VA groß ist, während gleichzeitig h2 klein ist? Ein wahrscheinlicher Grund für die niedrige Heritabilität von lebensgeschichtlichen Merkmalen ist, dass, obwohl VA (der Zähler) groß ist, VP (der Nenner) viel größer als VA ist. Beachten Sie, dass die phänotypische Varianz VP aus VA, der additiven genetischen Varianz, plus einem Rest, VR, besteht, der wiederum aus allen nicht-additiven genetischen Variationsquellen (d.h. aufgrund von Dominanz, Epistase usw.) und der phänotypischen Variation, die durch die Umwelt hervorgerufen wird (d.h. phänotypische Plastizität, Genotyp-Umwelt-Interaktionen; siehe unten). So haben lebensgeschichtliche Merkmale wahrscheinlich eine niedrige Heritabilität, weil sie von vielen Loci beeinflusst werden (was sowohl VA als auch VP aufbläht), während sie gleichzeitig beträchtliche Mengen an Restvariation VR beherbergen, z. B. Variation aufgrund von Veränderungen in der Umwelt (was VP, aber nicht VA aufbläht) (Houle 1992, Houle 2001).
Darüber hinaus können, obwohl lebensgeschichtliche Merkmale einer starken Selektion unterliegen, die die genetische Varianz ausschöpfen sollte, mehrere Faktoren die genetische Variation für diese Merkmale aufrechterhalten, einschließlich der Mutations-Selektion-Balance, Umweltheterogenität und Genotyp-Umwelt-Interaktionen sowie negative genetische Korrelationen (Stearns 1992, Roff 1992, Houle 2001). Trotz der typischerweise großen Variation in der Lebensgeschichte unterliegt die Evolution der Lebensgeschichte jedoch auch Beschränkungen.
Life History Trade-Offs and Other Constraints
Fitness wäre offensichtlich maximal, wenn Überleben und Reproduktion in allen Altersstufen, Stadien oder Größen eines Organismus maximal wären. Im Prinzip ist also das Grundproblem der Evolution der Lebensgeschichte trivial: Alle Merkmale der Lebensgeschichte sollten sich immer so entwickeln, dass Überleben und Fortpflanzung und damit die Fitness maximiert werden (Houle 2001). Dies würde sehr schnell zur Evolution von „darwinistischen Dämonen“ (Law 1979) führen, die die Welt übernehmen würden, d.h. Organismen, die sich sofort nach ihrer Geburt fortpflanzen, eine unendliche Anzahl von Nachkommen produzieren und ewig leben. Solche Organismen existieren jedoch nicht in der realen Welt: Die Ressourcen sind endlich, und die lebensgeschichtlichen Merkmale unterliegen intrinsischen Kompromissen und anderen Arten von Beschränkungen, so dass die natürliche Selektion die lebensgeschichtlichen Merkmale – und damit die Fitness – nicht über bestimmte Grenzen hinaus maximieren kann. Wir nennen solche Grenzen evolutionäre Beschränkungen (Stearns 1992, Houle 2001); wie oben erwähnt, stellen sie die intrinsische „Randbedingung“ dar, die wir verstehen müssen, um die Evolution der Lebensgeschichte vorherzusagen.
Eine der wichtigsten Arten von Beschränkungen sind lebensgeschichtliche Trade-offs (Stearns 1992, Roff 1992, Flatt und Heyland 2011). Ein Trade-off liegt vor, wenn eine Zunahme eines lebensgeschichtlichen Merkmals (Verbesserung der Fitness) mit einer Abnahme eines anderen lebensgeschichtlichen Merkmals (Verringerung der Fitness) gekoppelt ist, so dass der Fitnessvorteil durch Zunahme von Merkmal 1 gegen die Fitnesskosten durch Abnahme von Merkmal 2 ausgeglichen wird (Abbildung 2A). Auf genetischer Ebene wird angenommen, dass solche Trade-offs durch Allele mit antagonistischen pleiotropen Effekten oder durch Kopplungsungleichgewicht zwischen Loci verursacht werden.
Trade-offs werden typischerweise durch negative phänotypische oder genetische Korrelationen zwischen Fitnesskomponenten zwischen Individuen in einer Population beschrieben (Abbildung 2A). Wenn die Beziehung genetisch ist, wird vorhergesagt, dass eine negative genetische Korrelation die Evolution der beteiligten Merkmale einschränkt (d. h. verlangsamt oder verhindert). Es besteht also ein genetischer Trade-off in einer Population, wenn eine evolutionäre Veränderung in einem Merkmal, das die Fitness erhöht, mit einer evolutionären Veränderung in einem anderen Merkmal, das die Fitness verringert, verbunden ist. Die Existenz genetischer Korrelationen kann durch quantitativ-genetische Züchtungsdesigns oder durch korrelierte phänotypische Reaktionen auf die Selektion nachgewiesen werden. Zum Beispiel bewirkt die direkte künstliche Selektion auf eine verlängerte Lebensspanne in genetisch variablen Laborpopulationen von Fruchtfliegen (Drosophila melanogaster) die Evolution einer erhöhten Lebensspanne von Erwachsenen (manchmal in 10 oder weniger Generationen), aber diese evolutionäre Erhöhung der Langlebigkeit ist an eine verringerte frühe Reproduktion gekoppelt (z. B. Zwaan et al. 1995). Dies deutet darauf hin, dass Lebensspanne und frühe Reproduktion genetisch negativ gekoppelt sind, z. B. durch antagonistische pleiotrope Allele (z. B. Flatt 2011, Fabian und Flatt 2011).
Auf der physiologischen Ebene werden Trade-offs durch die kompetitive Allokation begrenzter Ressourcen auf ein lebensgeschichtliches Merkmal gegenüber dem anderen innerhalb eines einzelnen Individuums verursacht, z. B. wenn Individuen mit höherem Reproduktionsaufwand eine kürzere Lebensspanne haben oder umgekehrt (Abbildung 2B). Eine hilfreiche Art, sich Kompromisse bei der Ressourcenzuteilung vorzustellen, ist es, sich die Lebensgeschichte als einen endlichen Kuchen vorzustellen, wobei die verschiedenen Scheiben repräsentieren, wie ein Organismus seine Ressourcen zwischen Wachstum, Speicherung, Erhaltung, Überleben und Reproduktion aufteilt (Reznick 2010; Abbildung 2C). Das wesentliche Problem ist folgendes: Angesichts der ökologischen Umstände und der Tatsache, dass eine Vergrößerung eines Stücks bedeutet, dass ein anderes Stück kleiner wird, was ist der beste Weg, den Kuchen aufzuteilen? Beachten Sie, dass, da Kompromisse bei der Ressourcenallokation eine genetische Grundlage haben könnten und da sich verschiedene Genotypen in Aspekten der Ressourcenallokation unterscheiden können, die genetische und physiologische Sichtweise von Kompromissen nicht unbedingt unvereinbar sind. Allerdings lassen sich physiologische Kompromisse auf individueller Ebene nicht immer in genetische (evolutionäre) Kompromisse auf Populationsebene umsetzen. Wenn beispielsweise der physiologische Kompromiss (innerhalb eines Individuums) bei allen Individuen innerhalb der Population genetisch fixiert („fest verdrahtet“) ist, werden alle Individuen die gleiche negative physiologische Beziehung zwischen zwei lebensgeschichtlichen Merkmalen aufweisen, aber die genetische Korrelation zwischen den Individuen wäre gleich Null (Stearns 1989, Stearns 1992).
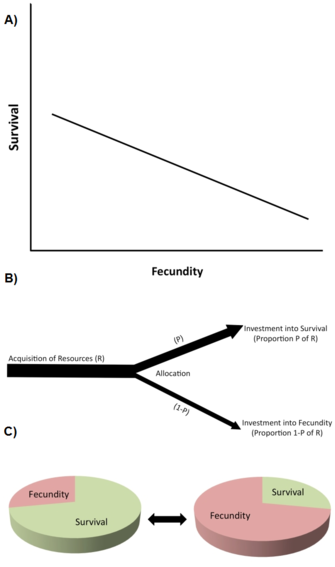
Das Buch von Stearns (1992) listet 45 mögliche Trade-offs zwischen 10 Hauptmerkmalen der Lebensgeschichte auf, und man kann sich viele weitere vorstellen. Zu den am meisten beachteten Trade-offs gehören (1) aktuelle Reproduktion versus Überleben; (2) aktuelle versus zukünftige Reproduktion; (3) aktuelle Reproduktion versus elterliches Wachstum; (4) aktuelle Reproduktion versus elterlicher Zustand; und (5) Anzahl versus Größe der Nachkommen.
Einige der besten Belege für genetisch begründete lebensgeschichtliche Trade-offs stammen aus künstlicher Selektion und experimentellen Evolutionsexperimenten, die in Drosophila durchgeführt wurden (siehe Übersichtsarbeiten in Stearns und Partridge 2001, Flatt und Schmidt 2009, Flatt 2011). Zusammenfassend lässt sich sagen, dass in vielen Experimenten eine negative Korrelation zwischen früher Fekundität und adulter Lebensspanne, eine positive Korrelation zwischen Entwicklungszeit und Körpergröße, eine positive Korrelation zwischen entweder Entwicklungszeit oder Körpergröße mit früher Fekundität und eine negative Korrelation zwischen früher und später Fekundität gefunden wurde.
Andere Beschränkungen der Lebensgeschichte, die die natürliche Selektion daran hindern, ein bestimmtes Fitnessoptimum zu erreichen, können biophysikalische, biochemische und strukturelle Faktoren, Entwicklungseigenschaften des Organismus, phylogenetische und historische Gegebenheiten oder einfach ein Mangel an genetischer Variation sein (Stearns 1992, Houle 2001).
Phänotypische Plastizität in lebensgeschichtlichen Merkmalen
Genetische Variation und Beschränkungen sind nicht die einzigen Faktoren, die die Ausprägung und Evolution lebensgeschichtlicher Merkmale beeinflussen. Ein weiterer wichtiger Punkt ist, dass die Variation in der Lebensgeschichte oft stark von der Umwelt beeinflusst wird (z.B. Temperatur, Nahrung, Fressfeinde), ein Phänomen, das als phänotypische Plastizität bezeichnet wird, d.h. die Fähigkeit eines einzelnen Genotyps (oder Klons), unterschiedliche Phänotypen in verschiedenen Umgebungen hervorzubringen (Stearns 1992, Roff 1997, Pigliucci 2001, DeWitt und Scheiner 2004). Die Plastizität eines bestimmten Genotyps kann konzeptionell durch eine mathematische Funktion beschrieben werden, die als Reaktionsnorm bezeichnet wird, d. h. eine Linie oder Kurve, die die von diesem Genotyp produzierten Phänotypen mit Veränderungen in der Umgebung, die er erfährt, in Beziehung setzt (Abbildung 3A).
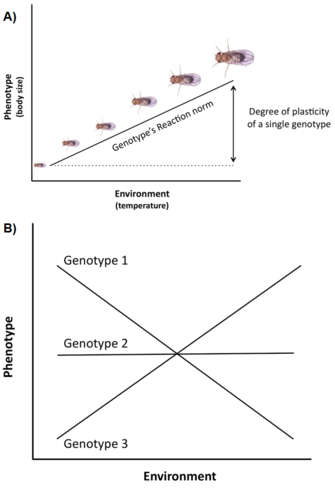
Die Bedeutung einer solchen Plastizität in der Evolution der Lebensgeschichte ist mindestens dreifach (Stearns und Koella 1986, Stearns et al. 1991, Stearns 1992, Nylin und Gotthard 1998, DeWitt und Scheiner 2004, Flatt 2005): (1) da die Plastizität die phänotypische Ausprägung der genetischen Variation für einzelne lebensgeschichtliche Merkmale und der genetischen Korrelationen für Merkmalspaare moduliert, beeinflusst sie die genetische Reaktion auf die Selektion in verschiedenen Umwelten; (2) wenn es eine adaptive Variation zwischen den Genotypen für die plastische Reaktion gibt, kann die Selektion eine optimale Reaktionsnorm hervorbringen, die die Fitness in verschiedenen Umwelten maximiert; und (3) die Plastizität eines spezifischen Merkmals kann den Organismus homöostatisch gegen umweltbedingte Veränderungen in anderen Merkmalen abpuffern, so dass die Leistung des Organismus und damit die Fitness optimiert wird.
Viele lebensgeschichtliche Merkmale (z.B., Alter bei der Geschlechtsreife, Fruchtbarkeit) weisen einen hohen Grad an Plastizität auf, und es gibt oft eine signifikante genetische Variation für die Plastizität in natürlichen Populationen, d. h. die Genotypen haben unterschiedliche Reaktionsnormen, ein Phänomen, das als Genotyp-Umwelt-Interaktion (GxE) bezeichnet wird (Abbildung 3B). Darüber hinaus können nicht nur einzelne Merkmale, sondern auch Korrelationen zwischen Merkmalen plastisch sein, und unterschiedliche Umgebungen können die Steigung und/oder das Vorzeichen der Merkmalskorrelation verändern (Stearns et al. 1991, Stearns 1992). Bei Spatenfußkröten (Scaphiophus couchii) zum Beispiel haben Individuen, die sich in Teichen mit kurzer Dauer entwickeln, eine kürzere Larvenzeit und eine kleinere Körpergröße bei der Metamorphose (wobei die Merkmale negativ korreliert sind) als Individuen, die sich in Teichen mit langer Dauer entwickeln (wobei die Merkmale positiv korreliert sind) (Newman 1988, Stearns et al. 1991).
Nachdem wir den Ansatz der Optimalitätsmodellierung und die Faktoren, die die Ausprägung von lebensgeschichtlichen Merkmalen beeinflussen, diskutiert haben, wenden wir uns nun einigen wichtigen Vorhersagen für die Evolution von Lebensgeschichten zu (für Details siehe Stearns 1992, Roff 1992, Charlesworth 1994, Stearns 2000, Roff 2002).
Vorhersagen für die Evolution von lebensgeschichtlichen Merkmalen
In welchem Alter und in welcher Größe sollte ein Organismus reifen? Der Fortpflanzungserfolg eines Genotyps hängt stark von seiner Wachstumsrate und – als Folge des Wachstums – von seinem Alter und seiner Größe bei der Reife ab. Um das optimale Alter und die optimale Größe bei der Reife vorherzusagen, müssen wir die relativen Kosten und Vorteile (in Bezug auf Sterblichkeit und Reproduktion) der frühen oder späten Reifung und des Großwerdens oder Kleinbleibens verstehen. Die Vorteile der einen „Strategie“ sind die Kosten der anderen, und umgekehrt. Die Vorteile einer früheren Reifung und einer geringeren Größe (d. h. die Kosten einer späteren Reifung und einer größeren Größe) umfassen: (1) eine höhere Überlebenswahrscheinlichkeit bis zur Geschlechtsreife aufgrund einer kürzeren Dauer der risikoreichen Entwicklungs- und Juvenilperiode und (2) eine kürzere Generationszeit, die es den Eltern ermöglicht, Nachkommen zu produzieren, die früher geboren werden und früher mit der Fortpflanzung beginnen. So sollte z. B. eine hohe Jugendsterblichkeit die Entwicklung einer früheren Reife begünstigen. Umgekehrt gehören zu den Vorteilen einer späteren Reifung und einer größeren Größe (d. h. zu den Kosten einer früheren Reifung und einer kleineren Größe): (1) ein längeres Wachstum, das zu einer größeren Größe bei der Reife und damit zu einer höheren Fruchtbarkeit führt (da die Fruchtbarkeit oft mit der Größe zunimmt), (2) eine geringere Sterblichkeit im Erwachsenenalter (und damit eine potenziell höhere Lebenszeitfruchtbarkeit) aufgrund einer größeren Größe (die Sterblichkeit durch Raubtiere ist bei größeren Individuen oft geringer) und (3) eine höhere Qualität der Nachkommenschaft (z. B. höhere Investitionen pro Nachkommen, bessere elterliche Fürsorge), die das Überleben der produzierten Nachkommen verbessert.
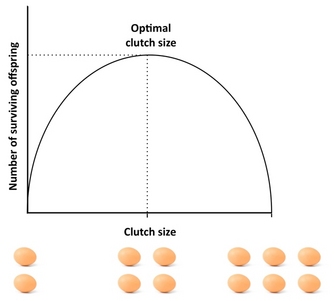
Wie viele Nachkommen sollte ein Organismus produzieren? Ein guter Ausgangspunkt, um diese Frage anzugehen, ist das „Lack-Gelege“, ein Konzept, das auf den Ornithologen David Lack (1947) zurückgeht. Lacks grundlegende Erkenntnis war, dass Vögel ihre Gelegegröße optimieren sollten, indem sie die Anzahl der flüggen (überlebenden) Nachkommen maximieren. Abweichungen von dieser optimalen Gelegegröße würden den Fortpflanzungserfolg verringern: Wenn die Eltern ein zu großes Gelege produzieren, sind sie möglicherweise nicht in der Lage, alle ihre Nachkommen zu ernähren und aufzuziehen, so dass einige oder alle von ihnen sterben, während bei einem zu kleinen Gelege die Anzahl der flüggen Nachkommen geringer ist als die der Eltern (Abbildung 4). Obwohl Lack mit seiner Behauptung richtig lag, dass die Fitness oft bei mittleren Investitionen maximiert wird, sind die Gelegegrößen typischerweise kleiner als das, was das Lack-Gelege vorhersagt. Das liegt daran, dass das Konzept mehrere Faktoren ignoriert, die die Gelegegröße reduzieren können, einschließlich der elterlichen Sterblichkeit, der zukünftigen Reproduktion, der Rate der Enkelproduktion und des Konflikts zwischen Eltern und Nachkommen. Zum Beispiel kann das Vorhandensein von Kompromissen zwischen aktueller Reproduktion und elterlichem Überleben, aktueller und zukünftiger Reproduktion oder der Anzahl und Größe der Nachkommen Abweichungen vom Lack-Gelege verursachen, und Modelle, die solche Faktoren berücksichtigen, ergeben normalerweise eine bessere Übereinstimmung mit der beobachteten Gelegegröße als das Lack-Gelege. Eine exzellente empirische Studie zur optimalen Gelegegröße findet sich in der Studie von Daan et al. (1990) über europäische Turmfalken.
Wie oft sollte sich ein Organismus fortpflanzen? Sollte er semelparous (d.h. nur einmal reproduzieren) oder iteroparous (d.h. mehrmals reproduzieren) sein (Abbildung 5; siehe auch Young 2010)? Die Theorie legt nahe, dass Iteroparität und die Evolution einer erhöhten reproduktiven Lebensspanne begünstigt werden, wenn die Überlebensrate der Erwachsenen hoch und die Fekundität der Erwachsenen oder die Überlebensrate der Jungtiere niedrig ist: Eine hohe (oder nicht variable) Überlebensrate der Erwachsenen erhöht die Anzahl der Reproduktionsereignisse pro Leben, und eine niedrige (oder variable) Fekundität oder die Überlebensrate der Jungtiere verursachen Fitnessverluste, die für eine erhöhte kompensatorische Reproduktionsanstrengung selektieren. Umgekehrt werden Semelparität und die Evolution einer verringerten reproduktiven Lebensspanne begünstigt, wenn das Überleben der Erwachsenen niedrig und das Überleben der Jungtiere hoch ist. Somit begünstigt eine hohe (oder nicht variable) adulte Überlebensrate im Verhältnis zur juvenilen Überlebensrate Iteroparität und verlängert die reproduktive Lebensspanne, während eine hohe (oder variable) adulte Sterblichkeit im Verhältnis zur juvenilen Sterblichkeit Semelparität begünstigt und die reproduktive Lebensspanne verkürzt. Semelparate Organismen haben typischerweise einen höheren Reproduktionsaufwand als iteroparate Organismen.

Die obigen Überlegungen sind Aspekte eines allgemeineren Problems, das als „allgemeines Lebensgeschichtsproblem“ oder „Modell des Reproduktionsaufwands“ bezeichnet wird (Schaffer 1983, Stearns 1992, Roff 1992, Charlesworth 1994): Angesichts der Tatsache, dass die Reproduktion sowohl Nutzen (d.h., Nachkommenproduktion) und Kosten (z. B. verringerte zukünftige Reproduktion, erhöhte elterliche oder Nachkommensterblichkeit) hat, was ist die optimale reproduktive Investition, die die Fitness maximiert? Viele theoretische und empirische Studien haben sich mit diesem Problem beschäftigt; einige der wichtigsten Schlussfolgerungen aus dieser Arbeit sind (siehe Stearns 1992, Roff 1992, Charlesworth 1994): (1) der Reproduktionsaufwand nimmt oft, aber nicht immer, mit dem Alter zu, weil die Kosten der gegenwärtigen Reproduktion im Hinblick auf die zukünftige Reproduktion mit dem Alter abnehmen sollten (da die Anzahl der zukünftigen Reproduktionsereignisse, bei denen sich die Kosten manifestieren können, mit dem Alter abnimmt); (2) wenn der Reproduktionsaufwand abnehmende Erträge liefert oder wenn die Sterblichkeit mit zunehmendem Aufwand zunimmt, werden intermediäre Reproduktionsinvestitionen und Iteroparität bevorzugt; Andernfalls werden maximaler Reproduktionsaufwand und Semelparität bevorzugt; (3) wenn die Sterblichkeit in allen Altersklassen zunimmt, steigt der Reproduktionsaufwand früh im Leben und das Alter bei der Reife nimmt ab; ähnlich sollte das Alter bei der Reife abnehmen, wenn die Sterblichkeit im Erwachsenenalter zunimmt; und (4) wenn die Sterblichkeit nach einem bestimmten Alter (oder in einer bestimmten Altersklasse) zunimmt, steigt der Reproduktionsaufwand vor diesem Alter und nimmt nach diesem Alter ab. Als besonders schöne Tests solcher Reproduktionsaufwand-Modelle verweisen wir auf die Feld- und Laborexperimente von David Reznick und Kollegen an Trinidad-Guppys (z. B. Reznick et al. 1990).
Wie lange sollte ein Organismus leben (siehe auch Fabian und Flatt 2011)? Die Evolution der Lebensspanne kann als ein Gleichgewicht zwischen der Selektion auf eine längere reproduktive Lebensspanne (und damit potenziell auf einen höheren Reproduktionserfolg) und der Alterung (d. h. der intrinsischen altersabhängigen Zunahme der Mortalität) betrachtet werden. Die Vorteile der Entwicklung einer längeren reproduktiven Lebensspanne sind (siehe auch oben): (1) eine höhere Anzahl von Fortpflanzungsereignissen (und damit Nachkommen) pro Leben, wenn die extrinsische Erwachsenensterblichkeit niedrig ist, (2) genügend Zeit, um die durch hohe Jugendsterblichkeit verlorenen Nachkommen reproduktiv zu kompensieren, und (3) eine geringere reproduktive Unsicherheit aufgrund hoher Schwankungen der Jugendsterblichkeit von einer Fortpflanzungsrunde zur nächsten, wiederum durch die Möglichkeit, verlorene Nachkommen zu kompensieren. Diesen Effekten wird durch solche entgegengewirkt, die die adulte Sterblichkeit (z. B. Überlebenskosten der Reproduktion; Alterung) relativ zur juvenilen Sterblichkeit erhöhen. So begünstigt ein Anstieg des Mittelwerts (und/oder der Varianz) der adulten Sterblichkeit im Verhältnis zur juvenilen Sterblichkeit tendenziell eine kürzere reproduktive Lebensspanne und Semelparität, während ein Rückgang des Mittelwerts (und/oder der Varianz) der adulten Sterblichkeit im Verhältnis zur juvenilen Sterblichkeit tendenziell eine längere reproduktive Lebensspanne und Iteroparität begünstigt.
Heute werden viele dieser Vorhersagen der Lebensgeschichtstheorie durch Beweise gut unterstützt; wir werden diesen Artikel mit einem Beispiel eines besonders eleganten Experiments beenden, das die Hauptvorhersagen des „allgemeinen Lebensgeschichtsproblems“ bestätigt hat.
Ein Beispiel für einen empirischen Test der Theorie
Um die Grundaussagen der Lebensgeschichtstheorie zu testen, verwendeten Stearns et al. (2000) eine Auszuchtpopulation von Fruchtfliegen (D. melanogaster), um zwei Sätze von Replikatlinien für die „experimentelle Evolution“ zu etablieren: drei Linien wurden einer Behandlung mit hoher Erwachsenensterblichkeit (HAM; durch zufälliges Töten von 90 % der Fliegen zweimal pro Woche) und drei Linien einer Behandlung mit niedriger Erwachsenensterblichkeit (LAM; durch Töten von 10 % der Fliegen zweimal pro Woche) ausgesetzt. Nach vier Jahren experimenteller Evolution unter diesen Bedingungen im Labor maßen Stearns und seine Mitarbeiter die lebensgeschichtlichen Phänotypen aller Linien in beiden Behandlungen, um die evolutionären Reaktionen der Fliegen auf hohe bzw. niedrige extrinsische Mortalität zu untersuchen. Die Ergebnisse dieses Langzeitexperiments waren sowohl eindeutig als auch faszinierend und bestätigten die theoretischen Vorhersagen: Fruchtfliegen, die sich unter HAM-Bedingungen entwickelt hatten, entwickelten sich schneller als Larven, schlüpften früher und in geringerer Größe als Erwachsene, hatten eine höhere frühe Spitzenfruchtbarkeit und zeigten eine kürzere Lebensspanne als die LAM-Fliegen, die die entgegengesetzte Folge von Anpassungen entwickelt hatten. Mit anderen Worten: Fliegen, die sich in einer hochgefährlichen Umgebung entwickelten, reagierten evolutionär, indem sie ihre Entwicklung beschleunigten, ihr Alter und ihre Größe bei der Reife verringerten, früher mehr Eier legten und kürzer lebten: Sie passten sich an ein hohes Maß an zufälliger Sterblichkeit an, indem sie ihre Reproduktionsanstrengungen auf ein früheres Alter verlagerten und ihre gesamte Lebensgeschichte auf eine kürzere Lebensspanne komprimierten. Ähnlich wie die Ergebnisse von Reznick et al. (1990) bei Guppys bestätigen diese Ergebnisse die wichtigsten Vorhersagen der Lebensgeschichtstheorie, insbesondere die wichtige Rolle der extrinsischen Erwachsenensterblichkeit bei der Gestaltung der Evolution von Wachstum, Reifung, Reproduktion und Alterung.
Zusammenfassung
Hier haben wir die Grundlagen der Lebensgeschichtstheorie vorgestellt. Die Lebensgeschichtstheorie versucht zu verstehen, wie die natürliche Selektion Organismen so gestaltet, dass sie reproduktiven Erfolg erzielen, wenn man weiß, wie selektive Faktoren in der Umwelt (d.h. extrinsische Mortalität) und organismuseigene Faktoren (d.h. Kompromisse, Einschränkungen) das Überleben und die Reproduktion beeinflussen. Durch die Anwendung einer Vielzahl von theoretischen und empirischen Methoden und insbesondere durch die Anwendung des Optimalitätsdenkens haben Lebensgeschichtstheoretiker wichtige Vorhersagen über die Entwicklung der wichtigsten lebensgeschichtlichen Merkmale abgeleitet, einschließlich des Alters und der Größe bei der Reife, der Anzahl und Größe der Nachkommen, des alters- oder größenspezifischen Reproduktionsaufwands, der reproduktiven Lebensspanne und des Alterns. Basierend auf diesen Vorhersagen und durch das Testen in Feld- und Laborexperimenten, z. B. bei Fliegen, Fischen oder Vögeln, haben Lebensgeschichtsbiologen uns einige überzeugende Antworten auf grundlegende Fragen gegeben, wie z. B.: Wie schnell sollte sich ein Organismus entwickeln? In welchem Alter und in welcher Größe sollte er heranwachsen? Wie viele Nachkommen sollte er haben und wie groß sollten sie sein? Sollte es sich einmal oder mehrmals fortpflanzen? Und wie lange sollte es leben? Durch die Auseinandersetzung mit diesen Problemen hat die Lebensgeschichtstheorie einen großen Einfluss auf unser Verständnis von Anpassung durch natürliche Selektion, dem grundlegendsten Thema der gesamten Evolutionsbiologie, gehabt.