Tumorwachstum und -proliferation
Unter normalen Umständen ist mTOR ein wichtiger Regulator für Zellwachstum und -teilung. In Tumorzellen sendet abnormal aktiviertes mTOR jedoch Signale, die Tumorzellen zum Wachstum, zur Metastasierung und zum Eindringen in neues, gesundes Gewebe anregen. Unter ihnen ist der PI3K/Phosphat und Pilz Homologie gelöscht auf Chromosom 10 (PTEN)/AKT/TSC-Weg der Hauptaktivator von mTORC1, und Genmutationen in diesem Weg können zu bösartigen Tumoren führen . Darüber hinaus wird die Expression von PTEN oft durch epigenetische, genetische und posttranskriptionelle Modifikation eliminiert, um den PI3K/Akt/mTOR-Weg in den meisten malignen Tumoren hochzuregulieren.
Hou et al. fanden heraus, dass Mutationen im PTEN-Gen zu einer abnormalen Aktivierung des PI3K/PTEN-Wegs in Leberzellkarzinomen (HCC) führten. Außerdem induziert die Deletion des PTEN-Gens die Expression von B7-H1, was zu einer Immunsuppression führt und die Tumorprogression und -invasion erhöht . Bei Leberkrebs ist der aktivierte PI3K/PTEN/Akt/mTOR-Signalweg an der Tumorinvasion und Metastasierung beteiligt, indem er die Matrix-Metallopeptidase 9 (MMP-9) hochreguliert . In ähnlicher Weise wurde festgestellt, dass der PI3K/Akt/mTOR-Signalweg die Proliferation und das Überleben von Dickdarmkrebs-Stammzellen (CCSC) kontrolliert. Bei sporadischem Kolonkarzinom können CCSC zu Rezidiv und Metastasierung führen. Xie et al. fanden heraus, dass eine Genmutation der Leberkinase B1 (LKB1) oder ein extrazelluläres Wachstumssignal mTORC1 aktivieren kann. MTORC1 hemmt die Aktivität des Ringfingerproteins 168 (RNF168) und fördert seine Degradation durch Phosphorylierung des 60. Serins von RNF168. Dadurch wird die Ubiquitinierungsmodifikation von Histon H2A und H2A Histon-Familienmitglied X (H2AX) nach einer DNA-Schädigung signifikant reduziert, was die Reaktion auf DNA-Schäden hemmt und die Stabilität des Genoms reduziert, was zur Förderung von maligner Zelltransformation und Krebs führt. Darüber hinaus zeigt die bisherige Forschung, dass Rheb eine GTPase ist, die mTORC1 bindet und aktiviert, wenn GTP geladen wird. Deng et al. berichteten, dass die Ubiquitinierung von Rheb durch Wachstumsfaktorsignale reguliert wird. Ubiquitiniertes Rheb hemmt die Rheb-Aktivität, indem es die Rheb-Bindung an TSC2 fördert, was zur Hemmung der mTORC1-Expression führt. Neben dem mTORC1-Signalweg ist auch der mTORC2-Signalweg an der Regulation des Auftretens und der Entwicklung von Tumorzellen beteiligt. Wang et al. zeigten, dass die OTU-Deubiquitinase 7B (OTUD7B) das Ubiquitinierungsniveau von GβL reduziert, um zu verhindern, dass GβL mit SIN1 interagiert, was zur Aktivierung des mTORC2/AKT-Signalwegs und zur Herunterregulierung der mTORC1-Expression führt. Dies aktiviert teilweise den onkogenen AKT-Signalweg und fördert die Tumorigenese. Die Ubiquitin-Ligase TNF Receptor Associated Factor 2 (TRAF2) hat jedoch den gegenteiligen Effekt, indem sie das Niveau der GβL-Ubiquitinierung erhöht. In ähnlicher Weise wiesen Kovalski et al. nach, dass Ras-Mutationen an die mTOR-Kinase mTORC2 und das Mitogen-activated protein kinase-associated protein 1 (MAPKAP1) binden können, um die Aktivität der mTORC2-Kinase zu fördern und damit nachgeschaltete proliferative Zellzyklus-Transkriptionsprogramme zu initiieren.
Zusammenfassend lässt sich sagen, dass mTOR in Tumoren stets stimuliert wird, um das Wachstum, das Überleben und die Proliferation von Tumorzellen aufrechtzuerhalten, und eine Schlüsselrolle in der Biologie von Tumorzellen spielt (Abb. 1).
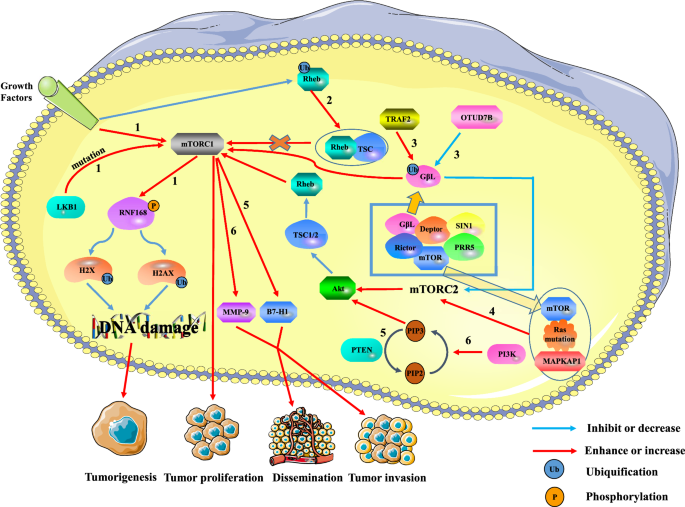
Die Beziehung zwischen mTOR und Tumoren. Eine Überaktivierung von mTORC1 kann die Tumorbildung, Proliferation und Metastasierung fördern, während mTORC2 die Expression von mTORC1 über den mTORC2/AKT/TSC/Rehb-Weg regulieren kann. Weg 1: Die extrazellulären Wachstumssignale und intrazelluläre LKB1-Mutationen aktivieren mTORC1, das die Ubiquitinierung von Histon H2A und H2A nach DNA-Schäden durch Phosphorylierung von RNF168 reduziert. Dies kann zu einer Schädigung der DNA-Reparatur führen und die Bildung von Tumoren fördern. Pathway 2: Die Ubiquitinierung von Rheb reduziert die Rheb-Aktivität, indem sie die Bindung von Rheb an TSC2 fördert. Die Down-Regulation von Rehb reduziert die Aktivierung von mTORC1, was zu einer Hemmung des Tumorwachstums führt. Pathway 3: TRAF2 und Otud7B regulieren jeweils die mTORC1/2-Aktivität, indem sie den Ubiquitinierungsgrad von G beta L von mTORC2 hoch- bzw. herunterregulieren. TRAF2 verstärkte die Aktivität von mTORC1 und hemmte die Aktivität von mTORC2. Obwohl die Herunterregulierung der mTORC2-Expression den AKT/TSC/Rehb/mTORC1-Weg inaktiviert, wird die mTORC1-Aktivität insgesamt verstärkt. Otud7B hat jedoch den gegenteiligen Effekt auf TRAF2. Weg 4: Mutiertes Ras bindet mTOR und MAPKAP1 von mTORC2 und fördert so die mTORC2-Expression. Die Hochregulierung von mTORC2 fördert die Tumorproliferation über den AKT/TSC/Rehb/mTORC1-Weg. Weg 5: Die Deletion des PTEN-Gens induziert die Expression von B7-H1, um die Tumorprogression und -invasion zu erhöhen. Weg 6: Der PI3K/PTEN/AKT/mTOR-Weg ist an der Invasion und Metastasierung von Leberkrebs beteiligt, indem er MMP-9 hochreguliert
Tumor-Stoffwechsel
mTOR wird aktiviert, wenn ausreichend Nährstoffe vorhanden sind, was Anabolismus und Energiespeicherung und -verwertung fördert. Wenn Nährstoffe relativ knapp sind, muss der Körper die Aktivierung von mTOR hemmen, um Zellmaterial und Energie stabil zu halten. Tumorzellen benötigen große Mengen an Proteinen, Lipiden und Nukleotiden, um ihren Bedarf an Wachstum und Teilung zu decken . Daher tritt eine abnorme Aktivität des mTOR-Wegs häufig in Tumoren auf, da mTOR eine zentrale Rolle bei der Regulierung des Stoffwechsels spielt.
In Brustkrebszellen ist der PI3K/AKT/mTORC1/sterol regulatory element-binding protein (SREBP) Weg der Hauptmechanismus, um neue Lipidsynthese zu induzieren und die Tumorproliferation zu fördern . Die Pyruvatkinase (PK) ist am Zuckerstoffwechsel beteiligt, während die Fettsäuresynthase (FASN) an der Synthese von Fettsäure (FA) beteiligt ist. Tao et al. fanden heraus, dass die Herunterregulierung der Expression von Pyruvatkinase M2 (PKM2) den AKT/mTOR-Signalweg deaktiviert und dadurch die Expression von SREBP-1c reduziert. Das reduzierte Expressionsniveau von SREBP-1c hemmt die Bildung von FA durch Hemmung der Transkription des FASN-Gens, was zu einem gehemmten Wachstum der Tumorzellen führt. Darüber hinaus berichteten Di Malta et al., dass das hochregulierte Transkriptionsfaktor-Enhancer (TFE)-Gen den Rag GTPase/mTORC1-Signalweg aktivieren kann. In normalen Zellen wird dieser Weg aktiviert, damit die Zellen Nährstoffe besser aufnehmen können, um physiologische Funktionen aufrechtzuerhalten. In Tumorzellen ist dieser Signalweg oft überaktiviert, um den Nährstoffbedarf der schnell wachsenden Tumorzellen zu decken. Guri et al. untersuchten jedoch, dass mTORC2 die Produktion von Sphingomyelin und Cardiolipin im HCC fördert. Einerseits sind Sphingomyelin und kardiale Phospholipide beide strukturelle Bestandteile von Zell-Biofilmen. Andererseits tragen der Stoffwechsel und der Transport von kardialen Phospholipiden zur ordnungsgemäßen Funktion der Mitochondrien bei, so dass sie in schnell proliferierenden Tumorzellen in großen Mengen zugeführt werden müssen . Diese Ergebnisse deuten darauf hin, dass der mTORC2-Signalweg die Proliferation des HCC und die energiebezogene Lipidproduktion fördert.
Wie oben erwähnt, kann der Stoffwechsel von Tumorzellen durch den mTOR-Signalweg reguliert werden, um ihre proliferativen und ernährungsbedingten Bedürfnisse zu erfüllen. Umgekehrt kann der Stoffwechsel von Tumorzellen über den mTOR-Stoffwechselweg auch das Tumorwachstum fördern. Ericksen et al. zeigten, dass die Verringerung des Abbaus verzweigtkettiger Aminosäuren (BCAA) das Auftreten und die Entwicklung von Tumoren fördern kann, indem die Aktivität von mTORC1 erhöht wird. Sie kamen auch zu dem Schluss, dass die Aktivität des Schlüsselenzyms im BCAA-Abbauprozess hoch mit der Tumorinvasion korreliert war. Daher kann die Akkumulation von BCAAs, die durch die Hemmung des BCAA-Katabolismus in Lebertumorgeweben verursacht wird, der primäre Mechanismus der chronischen Aktivierung von mTORC1 im Tumor sein. In ähnlicher Weise zeigten Shi et al., dass die Expression des Adenosin-A2a-Rezeptors (A2aR) in Magenkrebsgewebe (GC) erhöht war, und die Expression von A2aR war positiv mit dem GC-Stadium korreliert. Die Ergebnisse deuten darauf hin, dass Adenosin den PI3K/AKT/mTOR-Signalweg durch Bindung an A2aR aktiviert, was letztlich das Fortschreiten von GC fördert. Madak-Erdogan et al. fanden heraus, dass freie Fettsäuren (FFAs) den Östrogenrezeptor α (ERα) und den mTOR-Signalweg aktivieren, was mit einer höheren Proliferation und Invasivität von ER (+) Brustkrebszellen korreliert.
Diese Studien deuten darauf hin, dass der mTOR-Signalweg eng mit dem Tumorstoffwechsel verbunden ist, und liefern theoretische Unterstützung für die kombinierte Anwendung von mTOR-Inhibitoren und einigen Medikamenten, die in den Tumorstoffwechsel eingreifen (Abb. 2).
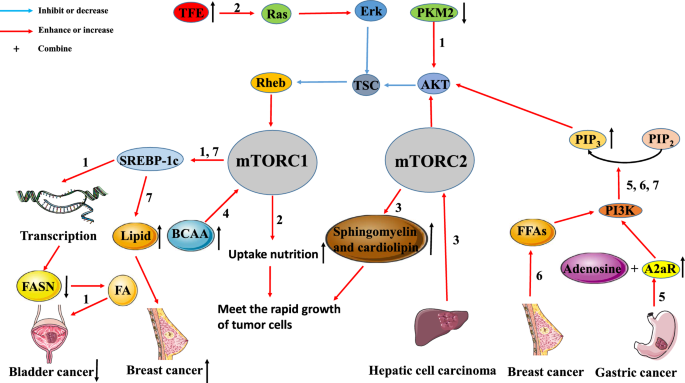
Interaktion zwischen Tumorstoffwechsel und dem mTOR-Signalweg. Der mTOR-Signalweg ist eng mit dem Tumorstoffwechsel verbunden. Pathway 1: Bei Blasenkrebs reduziert die Herunterregulierung der PKM2-Expression die SREBP-1-Expression durch den inaktivierten AKT/TSC/Rehb/mTORC1-Signalweg. Die Herunterregulierung von SREBP-1c hemmt die FA-Bildung durch Hemmung der FASN-Transkription, was zur Hemmung des Tumorwachstums führt). Pathway 2: Die Hochregulierung von TEF in Tumoren aktiviert den Ras/Erk/TSC/Rehb/mTORC1-Signalweg. Die Aktivierung dieses Weges fördert die Aufnahme von Nährstoffen durch die Tumorzellen, um den Bedarf für das schnelle Wachstum der Tumoren zu decken. Weg 3: HCC kann die Sphingomyelin- und Cardiolipin-Produktion durch Aktivierung von mTORC2 erhöhen. Große Mengen von Sphingomyelin und Cardiolipin werden zum Aufbau von Zellmembranen verwendet, die ebenfalls die Bedürfnisse der schnellen Tumorproliferation erfüllen. Weg 4: Die Anhäufung von BCAA kann das Auftreten und die Entwicklung von Tumoren durch die Aktivierung von mTORC1 fördern. Weg 5: A2aR, das bei Magenkrebs hoch exprimiert wird, bindet Adenosin, um den PI3K/AKT/mTORC1-Weg zu aktivieren. Weg 6: Bei Brustkrebs fördern FFAs die Tumorproliferation und Metastasierung durch Aktivierung des PI3K/AKT/mTORC1-Wegs. Weg 7: Der PI3K/AKT/mTORC1/SREBP-Weg fördert die Proliferation von Brustkrebs, indem er die Neusynthese von Lipiden induziert
Immunzellen
Tumore können eine Immuntoleranz entwickeln, indem sie die Fähigkeit des Immunsystems unterdrücken, Tumorzellen zu erkennen und zu töten. Tumor-Immuntherapie ist ein heißes Forschungsthema in den letzten Jahren , und eine Vielzahl von Beweisen zeigt, dass der mTOR-Signalweg, der in Tumoren oft abnormal aktiviert ist, die Differenzierung und Funktion von Immunzellen regulieren kann.
T-Zellen
T-Vorläuferzellen aus dem Knochenmark gelangen in den Thymus, wo sie sich in zwei Arten von Zellen differenzieren: αβ-T-Zellen und γδ-T-Zellen. Durch das Gen-Knockout-Experiment wiesen Yang et al. nach, dass die Deletion von RAPTOR in mTORC1 den Umbauprozess des oxidativen Stoffwechsels und des Glukosestoffwechsels während der T-Zell-Differenzierung unterbrechen würde. Dadurch wird die Produktion von reaktiven Sauerstoffspezies (ROS) ausgelöst, die die Differenzierung von αβ-T-Zellen stört und die Differenzierung von γδ-T-Zellen erhöht. Darüber hinaus zeigten Essig et al., dass Rochin die Expression des PI3K/mTOR-Signalwegs herunterregulieren kann. Die Herunterregulierung des PI3K/mTOR-Signalwegs hemmt nicht nur die Differenzierung und Aktivierung traditioneller T-Zellen, sondern begrenzt auch die Spezialisierung von Treg-Zellen. Pollizzi et al. fanden in Mausmodellen heraus, dass die Aktivierung von mTORC1 die Produktion eines Clusters von Differenzierungs- (CD) 8+ Effektor-T-Zellen mit hoher Glykolyse fördert. Diese T-Zellen behalten den Effektor-Phänotyp, konvertieren aber nicht in einen Memory-Phänotyp. Im Gegensatz dazu haben T-Zellen mit reduzierter Aktivität von mTORC1 die Eigenschaften von Gedächtniszellen, können sich aber nicht in Effektorzellen differenzieren, und sie können aufgrund der defekten Stoffwechselfunktion keine immunologische Gedächtnisantwort produzieren. Weitere Studien zeigten, dass mTORC1 die Effektor-Funktion von CD8+ T-Zellen beeinflussen kann, während die mTORC2-Aktivität die Gedächtnisfähigkeit von CD8+ T-Zellen reguliert.
Im Allgemeinen kann der mTOR-Signalweg die Differenzierung und Funktion von T-Zellen beeinflussen. Diese Studien erweitern unser derzeitiges Verständnis der T-Zell-Biologie.
Natürliche Killerzellen und dendritische Zellen
Der mTOR-Signalweg reguliert nicht nur T-Zellen, sondern ist eng mit der Differenzierung und Funktion von dendritischen Zellen (DCs) und natürlichen Killerzellen (NK) verbunden. DCs haben eine starke Antigenpräsentationsfähigkeit, und NK-Zellen sind wichtige Immunzellen im Körper. Wang et al. wiesen nach, dass mTORC1 und mTORC2 die Wirkung von NK-Zellen auf eine einzigartige Weise regulieren. Sie fanden heraus, dass mTORC2 die NK-Zellfunktion vor allem durch die Hemmung der Signal Transducer and Activator of Transcription 5 (STAT5)/solute Carrier Family 7 Member 5 (SLC7A5) Achse negativ reguliert. Während mTORC1 die Aktivität von mTORC2 positiv reguliert, indem es den CD122-vermittelten Interleukin (IL)-15-Signalweg aufrechterhält. Neben den NK-Zellen wird in den letzten Jahren auch bei DC ein Zusammenhang mit dem mTOR-Signalweg vermutet. Chen et al. stellten fest, dass die Apoptose von DC, die aus mononukleären Zellen des Knochenmarks (BMM) stammen, nach Behandlung mit mTOR-Inhibitoren reduziert war. Sie fanden auch heraus, dass aus BMM-Zellen abgeleitete DCs bessere Antigenpräsentationsfähigkeiten hatten und dass e7-spezifische zytotoxische CD8+ T-Lymphozyten, die von diesen DCs aktiviert wurden, eine größere Anti-Tumor-Aktivität hatten. Daher können mTOR-Inhibitoren die Wirksamkeit der Tumor-Immuntherapie erhöhen, indem sie die Lebensdauer der DCs verlängern und die Fähigkeit zur Antigenpräsentation und Antigenverarbeitung verbessern. Diese Studien liefern Ideen für das Targeting von NK- und DC-Zellen für die Anti-Tumor-Therapie.
Makrophagen
M1-Typ-Makrophagen können Tumorzellen auf vielfältige Weise abtöten, während M2-Typ-Makrophagen das Auftreten, die Invasion und die Metastasierung der Tumoren fördern. Zhihua et al. berichteten, dass die Expression von microRNA (miRNA)-30c bei GC signifikant reduziert war. Weitere Studien zeigten, dass der Hypoxie-induzierbare Faktor-1α (HIF-1α) die miRNA-30c-Expression hemmt. Die Herunterregulierung von miRNA-30c reduziert die mTOR-Aktivität und die Glykolyse in tumorbezogenen Makrophagen. Dies wird schließlich das GC-Wachstum und die Metastasierung fördern, indem es die Differenzierung und Funktion von M1-Typ-Makrophagen hemmt.
Im Allgemeinen fördert der mTOR-Signalweg, der häufig in Tumoren aktiviert wird, das Tumorwachstum, indem er die Differenzierung und Funktion von Immunzellen reguliert. Dies wird eine positive Rolle bei der Erforschung neuer Immuntherapien und der Verbesserung der Tumorbehandlung spielen.
Tumor-Medikamentenresistenz
Die molekularen Signalwege von Tumorzellen anzugehen ist die Art und Weise, wie wir verschiedene Krebsarten behandeln, aber Tumore entwickeln unweigerlich Medikamentenresistenz . Sobald der Tumor resistent wird, nehmen die Nebenwirkungen der Behandlung zu, während die Wirksamkeit des Medikaments deutlich abnimmt.
Die Tumore des Verdauungssystems
Studien haben gezeigt, dass das mitochondriale Entkopplungsprotein 2 (UCP2) zur Tumorresistenz gegen mehrere Krebsmedikamente führt, indem es die vom mitochondrialen Stoffwechsel erzeugten ROS reduziert. Dando et al. wiesen nach, dass die Kombination von Genipin und Everolimus synergistisch das Wachstum von Pankreas-Adenokarzinom-Zellen (PAAD) hemmen und die Autophagie der Tumorzellen induzieren kann. Dies ist darauf zurückzuführen, dass die Hemmung von UCP2 in PADD-Zellen den Akt/mTOR-Signalweg über einen ROS-abhängigen Mechanismus aktiviert, was den Anti-Proliferations-Effekt des UCP2-Inhibitors Genipin reduziert. Der Hedgehog-Signalweg, der durch das Zinkfingerprotein GLI1 vermittelt wird, spielt eine wichtige Rolle bei GC. Yao et al. zeigten jedoch, dass der AKT/mTOR-Weg GLI1 aktivieren kann. Darüber hinaus korrelierten die GLI1- und p-AKT-Expressionen mit der Metastasierung von Tumorzellen und der Medikamentenresistenz, und das Expressionsniveau war negativ mit der Prognose von Patienten mit GC korreliert.
Respiratorische Tumoren
Der Wee1-Inhibitor AZD1775, der auf DNA-Reparatur und Zellzyklus-Checkpoints abzielt, hat sich bei einigen Lungenkrebspatienten als wirksam erwiesen, aber die Medikamentenresistenz ist ebenfalls häufig. In diesem Zusammenhang fanden Sen et al. heraus, dass die Expression der AXL-Rezeptortyrosinkinase (ARK) bei AZD1775-resistentem kleinzelligem Lungenkrebs (SCLC) hochreguliert war. ARK kann direkt oder über mTOR den Weg der extrazellulär regulierten Proteinkinasen (ERK) aktivieren, um die Checkpoint-Kinase 1 (CHK1) zu rekrutieren und zu aktivieren. Diese Ergebnisse deuten darauf hin, dass ARK die DNA-Schadensreparatur durch die Aktivierung von CHK1 verbessern kann, was letztlich den Wee1-Inhibitor außer Kraft setzt. In ähnlicher Weise zeigten Ye et al., dass bei nicht-kleinzelligem Lungenkrebs (NSCLC) Transmembrane-4 L-six family member-1 (TM4SF1) die Tumorsensitivität gegenüber Chemotherapeutika reguliert, indem es die Expression des Discoid-Domain-Rezeptors 1 (DDR1)/Akt/ERK/mTOR-Wegs reguliert.
Nierenkrebs und Hautkrebs
Tyrosinkinase-Inhibitoren (TKI) können zur Behandlung des Nierenzellkarzinoms (RCC) eingesetzt werden, aber einige RCC-Patienten entwickeln eine Medikamentenresistenz . Ishibashi et al. berichteten, dass die kombinierte Behandlung mit einem Interleukin-6-Rezeptor (IL-6R)-Inhibitor und einem niedrig dosierten TKI-Inhibitor das Wachstum und die Angiogenese von Nierenzellkarzinomen in vivo effektiver hemmt als der Einsatz eines TKI-Inhibitors allein. Dies liegt daran, dass niedrig dosierte TKI-Inhibitoren hohe IL-6-Spiegel induzieren, die den AKT/mTOR-Signalweg aktivieren. Diese Ergebnisse deuten darauf hin, dass der Mechanismus des Versagens von TKI-Inhibitoren bei einigen RCC-Patienten mit der erhöhten IL-6-Aktivierung des mTOR-Signalwegs zusammenhängt.
B-Raf-Proto-Onkogen (BRAF)-Mutationen treten bei Nicht-Melanom-Hautkrebs (NMSC) auf, aber BRAF-Inhibitoren wurden bei solchen Tumoren bisher nicht eingesetzt. Der Hauptgrund ist, dass BRAF-mutierte NMSC eine primäre oder sekundäre Resistenz gegen BRAF-Inhibitoren aufweisen. Sen et al. fanden eine starke Korrelation zwischen PI3K/mTOR-Signalweg und BRAF-Inhibitor-Resistenz. Dies deutet darauf hin, dass die Aktivierung des mTOR-Signalwegs zur Resistenz BRAF-mutierter NMSC gegenüber BRAF-Inhibitoren führen kann. Darüber hinaus fanden Obenauf et al. heraus, dass BRAF-, anaplastische Rezeptortyrosinkinase (ALK)- und epidermale Wachstumsfaktor-Rezeptor (EGFR)-Inhibitoren einige Sekretionssignale in Krebszellen induzieren, die zur Proliferation und Metastasierung von arzneimittelresistenten Tumorzellen führen. Weitere Studien haben gezeigt, dass in Melanomzellen, die mit BRAF-Inhibitor behandelt wurden, die Herunterregulierung des Transkriptionsfaktors FOS related antigen-1 (FRA1) mehrere Signalwege aktiviert, unter denen der PI3K/AKT/mTOR-Weg eine wichtige Rolle spielt. Wenn der BRAF- und der PI3K/AKT/mTOR-Signalweg gleichzeitig gehemmt werden, kann das Wachstum von arzneimittelresistenten BRAF-mutierten humanen Melanomzellen gehemmt werden.
Die oben genannten Studien legen nahe, dass Tumorzellen dem medikamenteninduzierten Zelltod durch Aktivierung des intrazellulären mTOR-Signalwegs entgehen können, so dass die Aktivierung des mTOR-Signalwegs einer der Mechanismen der Arzneimittelresistenz in Tumoren sein könnte. Medikamentenkombinationen, die auf den mTOR-Signalweg abzielen, können zur Behandlung von Tumoren eingesetzt werden, die eine Resistenz entwickelt haben.
Autophagie und Apoptose bei Krebs
Einerseits kann die Autophagie das Genom stabil halten, indem sie beschädigte Organellen und fehlgefaltete Proteine entfernt und so das Wachstum von Krebszellen hemmen kann. Andererseits versorgt die Autophagie den Tumor mit mehr Nährstoffen, was die Fähigkeit des Tumors stärkt, mit extremen Umweltbedingungen zurechtzukommen . Darüber hinaus ist die unbegrenzte Proliferation von Tumoren teilweise auf die Hemmung der Tumorzell-Apoptose zurückzuführen.
Sun et al. stellten fest, dass mTOR die Expression von Glykogensynthase-Kinase-3 (GSK-3) in Prostatakrebszellen hemmt. Die Herunterregulierung von GSK-3 hemmt den Caspase-3-Signalweg, was zu einer Verringerung der ROS-Produktion führt. Verringertes ROS hemmt die Apoptose von Tumorzellen, um Prostatakrebszellen zu schützen. Zou et al. berichteten jedoch, dass mTORC2 den Krebsinhibitor der Proteinphosphatase 2A (CIP2A) daran hindert, an die Proteinphosphatase 2A (PP2A) zu binden, um die PP2A-Aktivität wiederherzustellen. PP2A reduziert die Transkription von miR-9-3p und regelt die Expression des E2F-Transkriptionsfaktors 1 (E2F1) hoch, indem es den Abbau von c-Myc fördert und so die Apoptose von Tumorzellen hemmt. Darüber hinaus berichteten Yang et al., dass die Expression von p-AKT, p-mTOR, P62 und B-Zell-Lymphom-2 (BCL-2) in Zellen des oralen Plattenepithelkarzinoms (OSCC) mit Knockdown der langen nicht-kodierenden RNA (lncRNA) CASC9 signifikant verringert war, während die Expression von BCL2 associated X (BAX) erhöht war. Diese Ergebnisse deuten darauf hin, dass die lncRNA CASC9 die durch Autophagie vermittelte Apoptose über den AKT/mTOR-Signalweg hemmt, was die Proliferation von OSCC-Zellen fördert.
Zusammenfassend zeigen die obigen Studien, dass der mTOR-Signalweg das Auftreten und die Progression von Tumoren fördern kann, indem er die Autophagie und Apoptose von Tumorzellen reguliert. Darüber hinaus liefert die obige Forschung auch theoretische Unterstützung für die klinische Forschung zu gezielten Krebsmedikamenten, was von großer Bedeutung ist.