Einleitung
| Salinitätsklasse | S |
| Hyperhalin | > 65 |
| Metahalin | 45-65 |
| Euhalin | 30-35 |
| Polyhalin | 18-30 |
| Mesohalin | 5-18 |
| Oligohalin | 0.5-5 |
Die Salinität von Meerwasser ist definiert als die Gesamtmenge an gelösten Salzen in einem Kilogramm Meerwasser nach Gewicht. Die Salinität wird in der Einheit g / kg ausgedrückt, die oft als ppt (part per thousand) oder ‰ (permil) geschrieben wird. Im Meerwasser gelöste Salze sind in ihre Ionen dissoziiert; die vorherrschenden Ionen sind Chlorid und Natrium; andere bedeutende Ionen sind Magnesium, Sulfat, Calcium und Kalium. Im Laufe der Jahre wurden verschiedene Methoden zur Bestimmung des Salzgehalts entwickelt. Die praktischste Methode, die derzeit verwendet wird, ist die elektrische Leitfähigkeit. Da es sich hierbei um eine indirekte Methode handelt, wurde eine genaue Beziehung zwischen Leitfähigkeit und Salzgehalt hergestellt. Der auf diese Weise ermittelte Salzgehalt ist eine dimensionslose Größe, die als praktische Salinität bezeichnet wird. Nach der praktischen Salinitätsskala hat typisches „Standard“-Seewasser eine Salinität von 35. Um eine bessere Übereinstimmung mit der Thermodynamik des Meerwassers zu erreichen, wurde im Jahr 2010 eine neue Salinitätsskala eingeführt, die sogenannte absolute Salinitätsskala. Die damit verbundene kleine numerische Korrektur der praktischen Salinitätsskala ist für Küstengewässer nicht von großer praktischer Bedeutung, da sie durch die starke Variabilität des Salzgehaltes in Raum und Zeit in den Hintergrund tritt. Für den Ozean ist jedoch eine hohe Präzision erforderlich, da kleine Salzgehaltsunterschiede für die großskalige Ozeanzirkulation und die Charakterisierung von Wassermassen sehr relevant sein können.
Meerwasser ist aufgrund des zusätzlichen Gewichts der gelösten Salze dichter als Süßwasser; der Zusammenhang zwischen Salzgehalt und Dichte wird im Artikel Meerwasserdichte behandelt). Dieser Artikel gibt einen Überblick über die verschiedenen Salinitätsskalen. Sensoren, die für Leitfähigkeitsmessungen verwendet werden, werden im Artikel Salinitätssensoren behandelt.
Salzgehaltsmessungen und Definitionen im Laufe der Geschichte
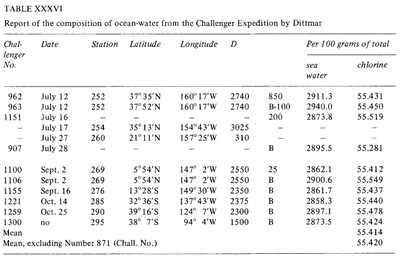
Konstante Zusammensetzung des Meerwassers (Dittmar, 1884)
Bis in die Zeit des antiken Griechenlands hinein wurden Versuche unternommen, den „Salzgehalt“ des Meerwassers zu messen. Diese frühen Methoden waren jedoch nicht sehr effizient und ihre Empfindlichkeit und Wiederholbarkeit waren sehr begrenzt. Im Laufe der Neuzeit wurden präzisere Methoden entwickelt: Wägung nach Verdunstung (Boyle, 1693; Birch, 1965), Lösungsmittelextraktion (Lavoisier, 1772) und Fällung (Bergman, 1784). 1865 führte Forchhammer den Begriff Salinität ein und widmete sich der Messung einzelner Komponenten des Meersalzes anstelle der Gesamtsalinität. Er fand heraus, dass das Verhältnis der Hauptsalze in Proben von Meerwasser von verschiedenen Orten konstant war. Dieses konstante Verhältnis ist als Forchhammersches Prinzip oder als Prinzip der konstanten Proportionen bekannt. Jahrhunderts testete William Dittmar in Anlehnung an die Arbeit von Forchhammer mehrere Methoden zur Analyse des Salzgehalts und der chemischen Zusammensetzung von Meerwasser. Die Dittmar-Methoden zur chemischen Analyse des Meerwassers waren äußerst präzise. Dittmar analysierte den Chlorgehalt im Meerwasser mittels Silbernitratausfällung des Chlorids und verglich ihn mit synthetisch hergestellten Meerwasserproben, um die Genauigkeit der Methode zu beurteilen. Später analysierte er 77 Proben aus aller Welt, die während der Challenger-Expedition entnommen wurden, und stellte die gleiche Konstanz der Zusammensetzung fest, die Forchhammer beobachtet hatte: „obwohl die Konzentration der Wässer sehr unterschiedlich ist, ist die prozentuale Zusammensetzung des gelösten Materials in allen Fällen fast gleich“. .
Salzgehaltsdefinition 1902
Mit genaueren Techniken zur Messung des Salzgehalts entstand der Bedarf nach einer einheitlichen Definition des Salzgehalts und Messmethoden in der gesamten wissenschaftlichen Gemeinschaft. Im Jahr 1889 wurde Martin Knudsen vom ICES zum Vorsitzenden einer Kommission ernannt, die sich mit dem Thema Salzgehalt befassen sollte. Er formulierte die folgende Definition:
„Der Salzgehalt ist die Gesamtmenge an festen Stoffen in Gramm, die in einem Kilogramm Meerwasser gelöst ist, wenn das gesamte Karbonat in Oxid umgewandelt, das Brom und Jod durch Chlor ersetzt und alle organischen Stoffe vollständig oxidiert sind.“
Obwohl diese Definition korrekt ist und den Ozeanographen für die nächsten 65 Jahre diente, ist die Methodik unpraktisch und schwierig mit Präzision durchzuführen. Mit dem Wissen, dass die Hauptionen in einem konstanten Verhältnis zueinander stehen und Chlor durch eine volumetrische Titration mit Silber genau gemessen werden kann, definierte die Kommission die „Chlorinität“ als Maß für den Salzgehalt. Ursprünglich wurde die Salinität aus dem Cl- Gehalt (Chlorinität) berechnet. Die Chlorinität wird gemessen als die Masse in g an Halogeniden, die aus 1.000 g Meerwasser durch Ag+ unter Verwendung einer AgNO3-Standardlösung ausgefällt werden kann. Die Reaktion ist:
AgNO3 (aq) + NaCl (aq) → AgCl(s) + NaNO3 (aq)
Nach der Analyse einer großen Anzahl von Proben von neun Standorten entwickelten Knudsen und seine Kollegen eine Gleichung zur Berechnung der Salinität basierend auf dem Chlorgehalt:
S = 1,805 \, Cl^- + 0,03 \; g / kg , \qquad (1)
wobei der Chlorgehalt Cl- als die Masse an Silber definiert ist, die benötigt wird, um die Halogene in 0,3285234 kg der Meerwasserprobe vollständig auszufällen:
Cl- = 328.5234 Ag+
Salzgehaltsmessungen werden manchmal in der Chlorinitätsskala (g Cl- / kg) oder in der Chlorositätsskala (g Cl- / l) ausgedrückt.
Revidierte Salzgehaltsdefinition 1966
Wie aus Formel (1) ersichtlich, hat diese Methode ihre Grenzen und ist nicht ganz korrekt: Wenn der Chlorinitätswert 0 ist, ist der Salzgehalt 0,03. Darüber hinaus haben Carritt und Carpenter (1959) geschätzt, dass die Unsicherheit eines berechneten Wertes der Salinität aus einem gemessenen Wert der Chlorinität unter Verwendung dieser Beziehung bis zu 0,04 g / kg betragen kann. Dies ist auf Schwankungen in der chemischen Zusammensetzung in einigen Meerwasserproben (Ostsee) und die Tatsache zurückzuführen, dass nur 9 verschiedene Standorte beprobt wurden, um die Chlorinität zu bestimmen.Anfang der 60er Jahre, mit der Entwicklung von Leitfähigkeitsbrücken, wurde es möglich, die Salinität mit großer Genauigkeit (± 0,003 g / kg) zu messen. Die Brücken lieferten Leitfähigkeitsverhältnisse zwischen der Probe und dem Standard-Meerwasser, das zur Kalibrierung der Brücken verwendet wurde. Allerdings war das Standard-Meerwasser für Chlorinitätsmessungen und nicht für die Leitfähigkeit entwickelt worden, so dass ein neuer Leitfähigkeitsstandard beim Joint Panel for Oceanographic Tables and Standards (JPOTS) in Auftrag gegeben wurde. Basierend auf neuen Messungen von Salzgehalt, Temperatur und Leitfähigkeit aus Proben auf der ganzen Welt wurde die stehende Formel der Chlorinität überarbeitet zu:
S = 1,80655 \, Cl^- . \qquad (2)
Praktische Salinitätsskala-1978 / EOS-80
WAS IST PSU? von Frank J. Millero im Oceanography Magazine, 1993
Nachdem ich die neueste Ausgabe der Oceanography erhalten hatte, war ich irritiert von der Sea-Bird-Werbung auf dem Innendeckel. Sie zeigt ein TS-Diagramm, das mit dem Begriff PSU beschriftet ist. Obwohl es mir nicht gelungen ist, die Firma dazu zu bringen, die Verwendung dieses Begriffs einzustellen, dachte ich, ich sollte diesen Brief schreiben, um meine Bedenken über die Verwendung dieses Begriffs durch meine Ozeanographen in veröffentlichten Artikeln auszudrücken. Als Mitglied des Joint Panel on Oceanographic Tables and Standards, das maßgeblich an der Entwicklung der internationalen Gleichung für den Zustand des Meerwassers und der praktischen Salinitätsskala beteiligt war, bin ich erstaunt über die Praxis, die von Ozeanographen bei der Verwendung von PSU übernommen worden zu sein scheint. Die praktische Salinitätsskala wurde als Leitfähigkeitsverhältnis ohne Einheiten definiert. Eine Meerwasserprobe mit einem Leitfähigkeitsverhältnis von 1,0 bei 15 ºC mit einer KCl-Lösung, die eine Masse von 32,4356 g in einer Gesamtmasse von 1 kg Lösung enthält, hat einen Salzgehalt von 35,000 (es werden keine Einheiten oder ‰ benötigt). Die Salinitäts- und Temperaturabhängigkeit dieses Verhältnisses für das Gewicht von verdunstetem oder mit Wasser verdünntem Meerwasser führte zur vollständigen Definition der praktischen Salinitätsskala. Diese Definition wurde von allen nationalen und internationalen ozeanographischen Organisationen übernommen. Irgendwann begannen Ozeanographen, den Begriff PSU (practical salinity unit) zu verwenden, um anzuzeigen, dass die praktische Salinitätsskala zur Bestimmung des Leitfähigkeitssalzgehalts verwendet wurde. Dies resultierte offenbar aus der früheren Verwendung von ‰, um Teile pro Tausend darzustellen, was einige Ozeanographen als Einheit empfanden. Die Quintessenz ist, dass die Salinität schon immer ein Verhältnis war und keine physikalischen Einheiten hat. Die Verwendung des Begriffs PSU sollte im Feld nicht erlaubt sein und schon gar nicht in veröffentlichten Papieren verwendet werden. Wann immer die praktische Salinitätsskala zur Bestimmung der Salinität verwendet wird, sollte dies irgendwo in der Arbeit angegeben werden. Die Verwendung des Begriffs PSS kann verwendet werden, um anzuzeigen, dass die praktische Salinitätsskala verwendet wird. Man muss sicherlich nicht bei allen Abbildungen, die TS-Daten zeigen, den Begriff PSU verwenden. Ich sollte auch darauf hinweisen, dass die UNESCO (1985) einen SUN-Bericht veröffentlicht hat, der die Verwendung von Einheiten auf dem Gebiet der Ozeanographie genau beschreibt. Dieser Bericht wurde auch von allen internationalen ozeanographischen Gesellschaften angenommen, wird aber von den Ozeanographen und den Zeitschriften, die ozeanographische Daten veröffentlichen, nicht allgemein verwendet. Wenn die Ozeanographie eine anerkannte Wissenschaft werden soll, muss sie die Einheiten übernehmen, die in den Bereichen Chemie und Physik grundlegend sind. Sie sollte auch keine neuen Einheiten für Variablen einführen, die einheitenlos sind.
Das Gewichtsverhältnis der verschiedenen gelösten Salze im Meerwasser ist fast überall in den Weltmeeren gleich. Dies gilt auch für die Küstengewässer, obwohl Abweichungen von der Standardzusammensetzung bei niedrigem Salzgehalt in der Salz-Salz-Übergangszone wichtiger werden. Aufgrund der annähernd universellen Zusammensetzung der gelösten Salze im Meerwasser kann der Salzgehalt des Meerwassers aus dem Grad der Verdünnung des Meerwassers mit Süßwasser abgeleitet werden. Dies geschieht am einfachsten durch die Messung der Leitfähigkeit C. Die Praktische Salinitätsskala (PSS) wurde eingeführt, um eine eindeutige Beziehung zwischen Salinität und Leitfähigkeit herzustellen. Diese Beziehung basiert auf dem Verhältnis R der Leitfähigkeit des Meerwassers und der Leitfähigkeit C(35,15) einer Standardlösung von 1 kg, die 32,4356 g KCl bei 15oC enthält und die Salinität S=35 hat.
Die Beziehung zwischen der Salinität S(T) und dem Leitfähigkeitsverhältnis R=R(S,T) basierte auf präzisen Bestimmungen der Chlorinität und des Leitfähigkeitsverhältnisses für verschiedene Temperaturen T an 135 natürlichen Meerwasserproben, die alle innerhalb von 100 m unter der Oberfläche gesammelt wurden und Proben aus allen Ozeanen und dem Baltischen, Schwarzen, Mittelmeer und Roten Meer enthalten. Nachdem die Chlorinität in die Salinität umgerechnet wurde, wurde unter Verwendung der Beziehung (2) das folgende Polynom durch kleinste Quadrate berechnet:
S(T) = S(15) + \Delta S(T) , \qquad R=\Large\frac{C(S,T)}{C(35,15)}\normalsize , \qquad (3)
S(15)=0.008-0.1692\,R^{1/2}+25.3851\,R+14.0941\,R{3/2}-7.0261\,R^2+2.7081\,R^{5/2} , \qquad (4)
\Delta S(T)= \Large\frac{T-15}{1+0.0162(T-15)}\normalsize (0.0005-0.0056\,R^{1/2} \\ -0.0066\,R-0.0375\,R^{3/2}+0.0636\,R^2-0.0144\,R^{5/2}) , \qquad (5)
für 2 \, \le S \le \, 42 und für Atmosphärendruck,
S(15) \ca. 0,586 \, C^{1,0876} , wobei C in mS/cm ausgedrückt wird.
Da jedoch die absolute Leitfähigkeit nicht so genau gemessen werden kann, wie es für präzise Salzgehaltsmessungen erforderlich ist, ist es ratsam, die gemessene Leitfähigkeit relativ zu der von Standard-Meerwasser zu verwenden und die Salzgehalt-Leitfähigkeits-Beziehungen (3-5) anzuwenden.
Die Praktische Salzgehaltsskala wurde 1980 vom UNESCO/SCOR/ICES/IAPSO Joint Panel on Oceanographic Tables and Standards und der SCOR Working Group 51 (JPOTS) als internationaler Standard für die Ozeanographie angenommen. Die entsprechende Equation Of State of Seawater (EOS-80), die auf der Temperaturskala IPTS-68 und der Practical Salinity Scale 1978, PSS-78 (Lewis und Perkin, 1981) basiert, wurde von Millero et al. (1980) veröffentlicht.
TEOS-10
Das IOC der UNESCO führte 2010 eine neue Definition des Salzgehalts ein, den sogenannten Absoluten Salzgehalt S_A. Die Thermodynamische Zustandsgleichung (TEOS) wurde aus mehreren Gründen aktualisiert:
- Einige der polynomischen Ausdrücke der International Equation of State of Seawater (EOS-80) sind nicht vollständig miteinander konsistent, da sie nicht genau den thermodynamischen Maxwell-Kreuzdifferenzierungsbeziehungen gehorchen. Der neue Ansatz beseitigt dieses Problem.
- Seit Ende der 1970er Jahre ist eine genauere thermodynamische Beschreibung von reinem Wasser erschienen (IAPWS-95). Auch wurden mehr und ziemlich genaue Messungen der Eigenschaften von Meerwasser (wie z.B. für (i) die Wärmekapazität, (ii) die Schallgeschwindigkeit und (iii) die Temperatur des Dichtemaximums) durchgeführt und können in eine neue thermodynamische Beschreibung des Meerwassers einfließen.
- Der Einfluss der Variation der Zusammensetzung des Meerwassers in den verschiedenen Ozeanbecken auf die Dichte des Meerwassers ist besser verstanden worden.
- Die zunehmende Betonung des Ozeans als integraler Bestandteil des globalen Wärmemotors weist auf die Notwendigkeit genauer Ausdrücke für die Enthalpie und die innere Energie des Meerwassers hin, so dass die Wärmeströme im Ozean genauer bestimmt werden können (Enthalpie und innere Energie waren bei EOS-80 nicht verfügbar).
- Die Temperaturskala wurde von ITS-68 auf ITS-90 überarbeitet und die Atomgewichte der Elemente wurden überarbeitet.
Die Absolute Salinität S_A ist definiert als der Massenanteil an gelöstem Nicht-H2O-Material in einer Meerwasserprobe bei deren Temperatur und Druck und wird in der Einheit g / kg ausgedrückt. Daher wird sie auch als Dichte-Salinität bezeichnet. Der Massenanteil von H2O in einer Meerwasserprobe ist also gegeben durch 1-0,001 S_A. Mit dieser Definition wird die Frage „was ist Wasser und was ist gelöstes Material“ korrekt beantwortet (z. B. wird bei der Auflösung einer gegebenen Masse CO2 in reinem Wasser im Wesentlichen ein Teil des Wassers in gelöstes Material umgewandelt, da ein Gemisch aus CO2, H2CO3, HCO3-, CO32-, H+, OH- und H2O entsteht, wobei die relativen Anteile von Dissoziationskonstanten abhängen, die von Temperatur, Druck und pH-Wert abhängen.).
Die Werte der Absoluten Salinität S_A unterscheiden sich nur geringfügig von den entsprechenden Werten der Praktischen Salinität S. Für Meerwasser der Standardreferenzzusammensetzung
S_A = \Large\frac{35.16504}{35}\normalize S \; g / kg \qquad (6).
In anderen Worten, für eine Referenz-Meerwasserprobe mit der praktischen Salinität 35 beträgt die absolute Salinität 35,16504 g / kg. Für nicht standardisiertes Meerwasser, das an beliebigen Stellen im Ozean gesammelt wurde, beträgt die durchschnittliche Differenz zwischen der Absoluten Salinität S_A und Gl. (6) etwa 0,0107 g / kg. Der Wert der Absoluten Salinität S_A ausgedrückt in g / kg und der entsprechende Wert der Praktischen Salinität S unterscheiden sich bekanntermaßen um nicht mehr als etwa 0,5 %. Die Verwendung der Praktischen Salinität hat den Vorteil, dass sie (fast) direkt aus Messungen der Leitfähigkeit, der Temperatur und des Drucks bestimmt wird, während die Absolute Salinität im Allgemeinen aus einer Kombination dieser Messungen plus anderer Messungen und Korrelationen abgeleitet wird, die oft nicht gut etabliert sind.
Biologische Auswirkungen des Salzgehalts

Osmose durch eine semipermeable Membran, die Wassermoleküle (blau) leichter passieren lässt als Salzmoleküle (rot). Es gelangen mehr Wassermoleküle durch die Membran in den Meerwasserraum als Salzmoleküle in den Süßwasserraum, bis die Salzkonzentration auf beiden Seiten der Membran gleich ist. Dadurch erhöht sich der Druck im Meerwasserkompartiment, der sogenannte osmotische Druck. Adaptiert von ZME Science.
Alle Organismen müssen ein Gleichgewicht zwischen Wasser und gelösten Stoffen in ihrem Körper aufrechterhalten, um ihre Zellen am Leben zu erhalten. Dies wird Homöostase genannt. Um dies zu regulieren, können sie gelöste Stoffe durch ihre Membranen, die für die im Wasser gelösten oder suspendierten Stoffe durchlässig sind, importieren und exportieren. Die zufällige Bewegung von gelösten Substanzen durch eine durchlässige Membran wird Diffusion genannt. Die Diffusion erfolgt so lange, bis die Konzentrationen auf beiden Seiten der Membran gleich sind. Wenn ein gelöster Stoff die Membran nicht passieren kann, wird Konzentrationsgleichheit auf beiden Seiten durch die Nettowasserbewegung durch die Membran erreicht. Die Nettobewegung von Wasser durch eine semipermeable Membran als Reaktion auf Konzentrationsunterschiede von gelösten Stoffen wird „Osmose“ genannt. Dies ist für das Überleben der Zelle unerlässlich. Ist die Salzkonzentration außen höher als innen, verliert die Zelle Wasser, wird dehydriert und stirbt. Im umgekehrten Fall nimmt die Zelle Wasser auf, sie schwillt an und platzt möglicherweise. Aus diesem Grund investieren Organismen Zeit und Energie in die Aufrechterhaltung der Homöostase.
Salzgehaltssensoren Meerwasserdichte Meerwasserintrusion und Durchmischung in Ästuaren Ästuarine Zirkulation Salzkeil-Ästuare Schelfmeer Austausch mit dem Ozean
Bitte beachten Sie, dass auch andere Personen den Inhalt dieses Artikels bearbeitet haben können.
- Für andere Artikel dieses Autors siehe Kategorie:Artikel von Souza Dias, Francisco
- Für andere Artikel dieses Autors siehe Kategorie:Artikel von TÖPKE, Katrien
- Für eine Übersicht der Beiträge dieses Autors siehe Spezial:Beiträge/Francisco Souza Dias
- Für eine Übersicht der Beiträge dieses Autors siehe Spezial:Beiträge/Ktopke