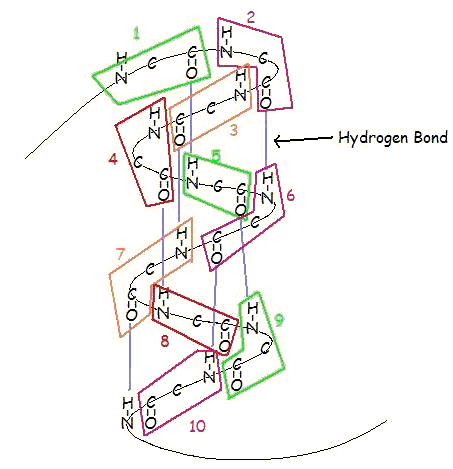
Eine α-Helix ist eine rechtsgängige Windung von Aminosäureresten auf einer Polypeptidkette, die typischerweise zwischen 4 und 40 Resten liegt. Diese Spule wird durch Wasserstoffbrückenbindungen zwischen dem Sauerstoff von C=O auf der oberen Spule und dem Wasserstoff von N-H auf der unteren Spule zusammengehalten. Eine solche Wasserstoffbrückenbindung wird genau alle 4 Aminosäurereste gebildet, und jede vollständige Windung der Helix beträgt nur 3,6 Aminosäurereste. Dieses regelmäßige Muster verleiht der α-Helix ganz bestimmte Eigenschaften in Bezug auf die Dicke der Windung und die Länge jeder vollständigen Windung entlang der Helixachse.
Die strukturelle Integrität einer α-Helix hängt zum Teil von der richtigen sterischen Konfiguration ab. Aminosäuren, deren R-Gruppen zu groß (Tryptophan, Tyrosin) oder zu klein (Glycin) sind, destabilisieren α-Helixen. Auch Prolin destabilisiert α-Helices aufgrund seiner unregelmäßigen Geometrie; seine R-Gruppe bindet zurück an den Stickstoff der Amidgruppe, was eine sterische Hinderung bewirkt. Außerdem verhindert das Fehlen eines Wasserstoffs am Stickstoff von Prolin dessen Beteiligung an der Wasserstoffbrückenbindung.
Ein weiterer Faktor, der die Stabilität der α-Helix beeinflusst, ist das Gesamtdipolmoment der gesamten Helix aufgrund der einzelnen Dipole der an der Wasserstoffbrückenbindung beteiligten C=O-Gruppen. Stabile α-Helixen enden typischerweise mit einer geladenen Aminosäure, um das Dipolmoment zu neutralisieren.