Ein System bezieht sich auf alle Teile des Universums, die untersucht werden.
Wenn Sie ein Experiment in einem Becherglas durchführen, dann befindet sich das System, das Sie untersuchen, im Becherglas.
Das System unterliegt den umgebenden Faktoren wie Lufttemperatur und -druck.
Die Thermodynamik befasst sich mit der Untersuchung des Wärmeenergieaustauschs zwischen einem System und seiner Umgebung.
Es gibt drei Arten von thermodynamischen Systemen. Basierend auf dem möglichen Wärme- und Stoffaustausch werden sie als offene, geschlossene oder isolierte Systeme klassifiziert.
Typen thermodynamischer Systeme
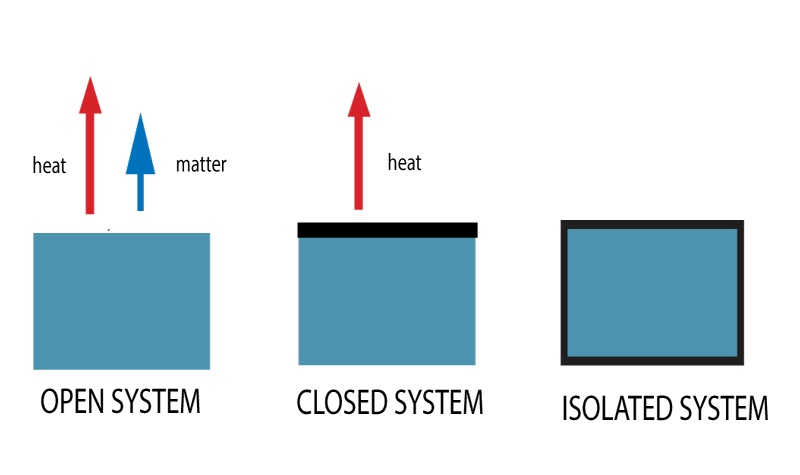
Offene Systeme
Vielleicht haben Sie schon von offenen und geschlossenen Systemen gehört. Ein offenes System ist eines, bei dem sowohl Energie als auch Materie frei in ein System hinein und aus ihm heraus übertragen werden können.
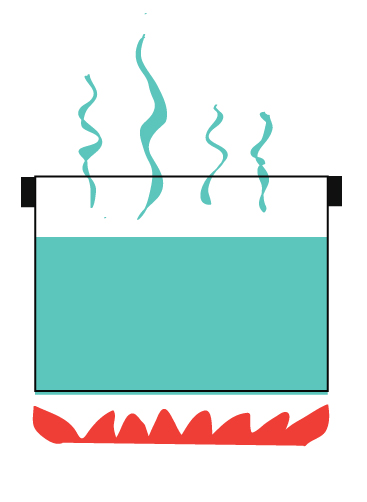
Zum Beispiel kochendes Wasser ohne Deckel.
Wärme entweicht in die Luft.
Dampf (der Materie ist) entweicht in die Luft.
Geschlossene Systeme
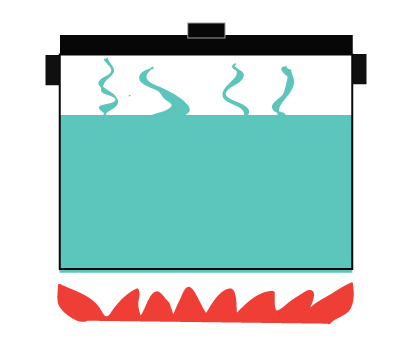
Ein geschlossenes System erlaubt dagegen keinen Austausch von Materie, sondern nur die Übertragung von Energie.
Es erlaubt die Übertragung von Wärme vom Herd auf das Wasser
Wärme wird auch an die Umgebung abgegeben
Dampf darf nicht entweichen
Beispiel für ein geschlossenes System – ein Schnellkochtopf.
Nb: If a system is 100% closed, it is in danger of exploding. That's why a pressure cooker should be designed with safety mechanisms to prevent the system from over-pressurzing by allowing steam to escape when needed.
Isolierte Systeme
Dieses System ist komplett geschlossen.
Weder Materie noch Wärme können an die Umgebung abgegeben werden.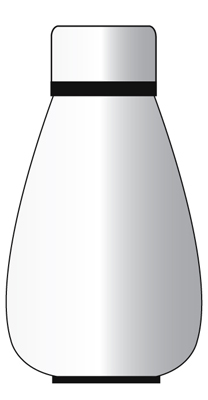 Beispiel – Eine Thermosflasche.
Beispiel – Eine Thermosflasche.
Der Zweck einer Thermosflasche ist das Warmhalten von Speisen.
Eine Thermoskanne kann als isoliertes System betrachtet werden, aber nur für kurze Zeit.
Sie verhindert, dass sowohl Wärme als auch Materie an die Umgebung abgegeben werden.
Schließlich entweicht die Wärme in der Thermoskanne an die Umgebung und der Inhalt in der Kanne wird abgekühlt.