Die Glykogenolyse, oder der Glykogenabbau, setzt Glukose frei, wenn sie benötigt wird.
Glykogen ist in der Leber eine Glukosereserve für die Aufrechterhaltung eines normalen Blutzuckerspiegels, und sein Abbau erfolgt vor allem:
- im nüchternen Zustand, z. B. während des nächtlichen Fastens;
- zwischen den Mahlzeiten;
- während einer hochintensiven körperlichen Aktivität.
In Hepatozyten wird die Glykogenolyse durch Glukagon und Adrenalin stimuliert, durch Insulin gehemmt und unterliegt auch einer negativen allosterischen Regulation durch Glukose (siehe unten).
Im Muskel ist Glykogen eine Energiequelle für die Muskelaktivität; daher erfolgt der Glykogenabbau während der Kontraktion und nur in den an der Aktivität beteiligten Muskeln.
In den Muskelzellen wird die Glykogenolyse durch Adrenalin stimuliert und durch positive und negative allosterische Effektoren, AMP und Kalziumionen (Ca2+) bzw. ATP und Glukose-6-Phosphat, reguliert (siehe unten).
INHALTSVERZEICHNIS
- Schritte der Glykogenolyse
- Metabolisches Schicksal von Glucose-1-Phosphat in Muskel und Leber
- Kovalente Regulation der Glykogenolyse in Muskel und Leber
- β-.Adrenergische Rezeptoren
- Stimulatorische G-Proteine
- Adenyl-Cyclase
- Proteinkinase A
- Phosphorylase-Kinase
- Allosterische Regulation der Glykogenolyse in Muskel und Leber
- Muskel-Phosphorylase-Kinase
- Hepatische Phosphorylase-Kinase
- Muskel-Glykogenphosphorylase
- Allosterische Regulation von PP1
- Hepatische Glykogenphosphorylase
Schritte der Glykogenolyse
Die Glykogenolyse beginnt durch die Wirkung der Glykogenphosphorylase (EC 2.4.1.1), einem Homodimer, das für seine Aktivität die Anwesenheit von Pyridoxal-5-phosphat, einem Derivat von Pyridoxin oder Vitamin B6, benötigt. Das Enzym katalysiert die phosphorolytische Spaltung der α-(1,4)-glykosidischen Bindung, wobei Glukosemoleküle nacheinander von den nicht-reduzierenden Enden, d. h. den Enden mit einer freien 4′-OH-Gruppe, der äußeren Verzweigungen freigesetzt werden. Bei dieser Reaktion, die kein ATP, sondern ein Orthophosphat verbraucht, entsteht Glukose-1-Phosphat.
Glykogen(n Glukosereste) + Pi → Glukose-1-Phosphat + Glykogen(n-1 Glukosereste)
Anmerkung: Im Dünndarm wird die pankreatische α-Amylase (EC 3.2.1.1) katalysiert die hydrolytische Spaltung der α-(1,4)-glykosidischen Bindungen der Stärke und liefert Glukosemoleküle.
In vivo katalysiert die Glykogenphosphorylase eine irreversible Phosphorolyse, eine besonders vorteilhafte Reaktion für Skelettmuskel und Herz (s. u.). Die Irreversibilität der Reaktion wird durch das Verhältnis / gewährleistet, das meist größer als 100 ist. Umgekehrt ist die Reaktion in vitro leicht reversibel.
Glykogenphosphorylase wirkt repetitiv auf die nicht-reduzierenden Enden von Verzweigungen und kommt zum Stillstand, wenn die Glukoseeinheit, die 4 Reste von der Verzweigungsstelle entfernt ist, erreicht ist: das ist die äußere Grenze des Grenzdextrins. An diesem Punkt schließen zwei enzymatische Aktivitäten, die auf derselben Polypeptidkette vorhanden sind, den Glykogenabbau ab: die α-(1,4)-Glucan-6-Glykosyltransferase (EC 2.4.1.24) und die Amylo-α-(1,6)-Glucosidase oder Debranching-Enzym (EC 3.2.1.33). Die erste enzymatische Aktivität überträgt drei der verbleibenden vier Glukoseeinheiten von der Verzweigung auf das nicht-reduzierende Ende einer anderen Verzweigung, so dass in der ersten Kette nur eine einzige Glukoseeinheit verbleibt, die über eine α-(1,6)-glykosidische Bindung an die Kette gebunden ist. Die zweite enzymatische Aktivität hydrolysiert diese α-(1,6)-glykosidische Bindung, wodurch Glukose und eine unverzweigte Kette von α-(1,4)-verknüpften Glukoseeinheiten freigesetzt werden.
Ohne die Verzweigung kann die Glykogenphosphorylase weiterhin Glukoseeinheiten abbauen, bis sie das nächste Grenzdextrin erreicht.
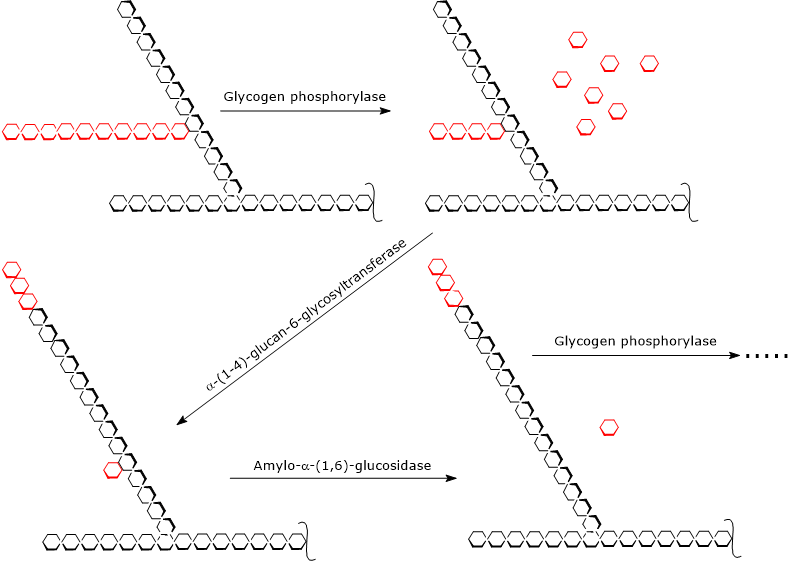
Die Produkte der von den drei Enzymaktivitäten katalysierten Reaktionen sind demnach:
- Glukose-1-Phosphat (etwa 90 % der freigesetzten Glukosemoleküle);
- eine kleine Menge freier Glukose, die restlichen 10 %;
- ein kleineres und weniger verzweigtes Glykogenmolekül.
Metabolisches Schicksal von Glukose-1-Phosphat im Muskel und in der Leber
Glukose-1-Phosphat ist ein geladenes Molekül und ist daher in der Zelle gefangen.
Es wird zu Glukose-6-Phosphat in der Reaktion umgewandelt, die von Phosphoglucomutase (EC 5.4.2.2) katalysiert wird, dem gleichen Enzym, das auch bei der Glykogensynthese eingreift und Glukose-6-Phosphat in Glukose-1-Phosphat umwandelt. Dieses Enzym katalysiert eine reversible Reaktion: Die Richtung wird durch die relativen Konzentrationen der beiden Moleküle bestimmt und verschiebt in diesem Fall die Phosphatgruppe von C1 nach C6.
Glukose 1-Phosphat ⇄ Glukose 6-Phosphat
Im Muskel und in den meisten anderen Organen und Geweben geht die Glukose aus der Glykogenolyse als Glukose 6-Phosphat in die Glykolyse ein, wobei der von der Hexokinase katalysierte Aktivierungsschritt umgangen wird. Daher spart die Glykogenphosphorylase unter Freisetzung eines bereits „aktivierten“ Glukosemoleküls ein ATP ein. Ein ATP-Molekül wird benötigt, um ein weiteres glykolytisches Zwischenprodukt, das Fructose-1,6-bisphosphat, zu synthetisieren.
Auf diese Weise wird ein Teil der Aktivierungsenergie, die für die Glykogensynthese benötigt wird, konserviert: Die Nettoausbeute an ATP pro Glukosemolekül durch Glykolyse zu Laktat beträgt 3 statt 2, ein Vorteil für den arbeitenden Muskel. Die Gesamtgleichung lautet:
Glykogen(n Glukosereste) + 3 ADP + 3 Pi → Glykogen(n-1 Glukosereste) + 2 Laktat + 3 ATP
In der Leber wird Glukose-6-Phosphat aus Glykogen durch Glukose-6-Phosphatase (EC 3.1.3.9) dephosphoryliert und dann in die Blutbahn abgegeben. Dies sind die Schritte des Abbaus von Glukoseeinheiten, in Form von phosphorylierter Glukose, durch die hepatische Glykogenolyse:
Glykogen(n Glucosereste) + Pi → Glucose-1-Phosphat + Glykogen(n-1 Glucosereste)
Glucose-1-Phosphat → Glucose-6-phosphat
Glucose-6-phosphat + H2O → Glucose + Pi
Die Gesamtgleichung lautet:
Glykogen(n Glukosereste) + H2O → Glykogen(n-1 Glukosereste) +Glukose
Kovalente Regulation der Glykogenolyse in Muskel und Leber
Der Glykogenabbau unterliegt einer feinen Kontrolle durch kovalente und/oder allosterische Modifikationen einiger Schlüsselproteine, wie Phosphorylase-Kinase (EC 2.7.11.19), Glykogenphosphorylase und Proteinphosphatase 1.
Hier werden die Wirkungen von zwei Hormonen analysiert, die über kovalente Modifikationen von Zielproteinen wirken:
- Adrenalin (auch Epinephrin genannt), das von den Nebennieren produziert wird und z. B. auf Muskel-, Leber- und Fettzellen wirkt;
- Glucagon, das von den Alpha-Zellen der Bauchspeicheldrüse produziert wird und auf Hepatozyten und Fettzellen wirkt.
Diese Hormone lösen durch Bindung an ihre Membranrezeptoren eine identische Kaskade von intrazellulären Ereignissen aus, die ihr Signal um mehrere Größenordnungen verstärken, die Glykogenolyse stimulieren und die Glykogensynthese hemmen.
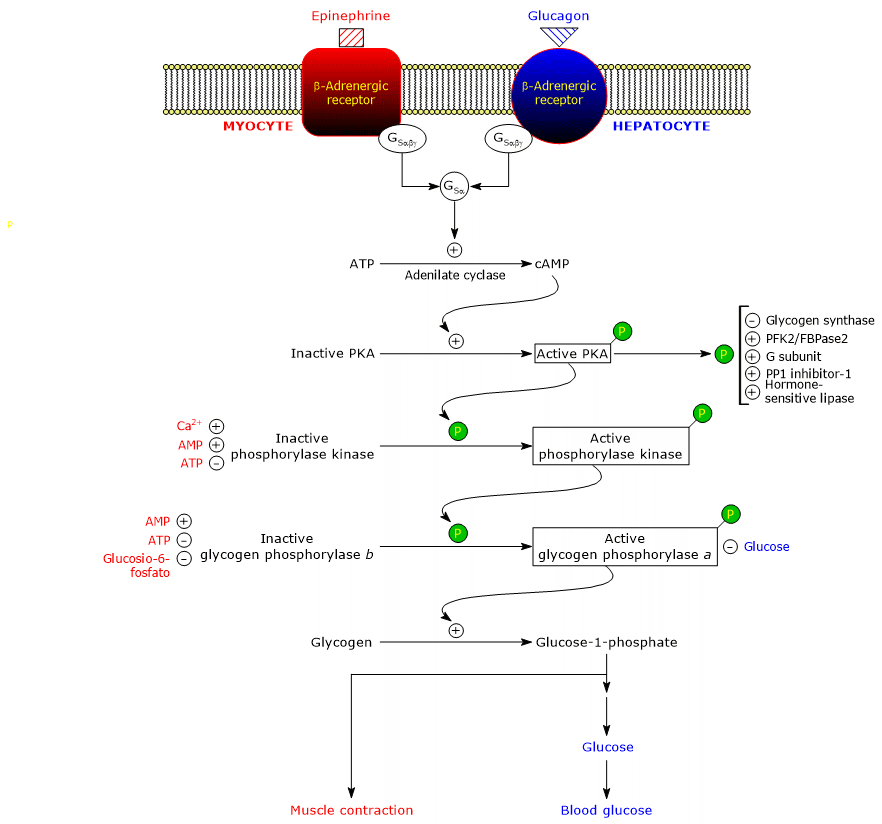
Es ist zu beachten, dass auch Acetylcholin, durch die Bindung an den Rezeptor, der sich an der neuromuskulären Verbindung befindet, die gleiche Aktivierungskaskade wie Adrenalin und Glucagon auslöst.
Hier die an der Kaskade beteiligten Proteine.
β-adrenerge Rezeptoren
Die Rezeptoren für Adrenalin und Glucagon sind integrale Membranproteine, mit sieben transmembranen α-Helices.
Der Begriff „adrenerge“ leitet sich von Adrenalin ab. Es gibt vier Subtypen von adrenergen Rezeptoren: α1, α2, β1 und β2. In der folgenden Diskussion werden nur β1- und β2-Rezeptoren betrachtet, die als β bezeichnet werden und auf die gleiche Weise wirken.
β-adrenerge Rezeptoren verursachen Veränderungen im Energiestoffwechsel, wie zum Beispiel:
- eine Erhöhung des Glykogenabbaus in Muskel- und Leberzellen;
- eine Erhöhung des Triglyceridabbaus (Lipolyse) im Fettgewebe.
Stimulatorische G-Proteine
Die Bindung des Hormons an den Rezeptor bewirkt eine Konformationsänderung im zytosolischen Teil des Rezeptors, und dies modifiziert die Interaktion mit dem zweiten Protein in der Kaskade: dem stimulatorischen Guanin-Nukleotid-Bindungsprotein oder, einfacher, dem stimulatorischen G-Protein (GS). Es ist ein Heterotrimer, das aus drei Untereinheiten besteht: α (mit der Nukleotid-Bindungsstelle), β und γ. In der inaktiven Form, GSαβγ-GDP, ist das Heterotrimer an β-adrenerge Rezeptoren gekoppelt.
Die Konformationsänderungen im Rezeptor ermöglichen es, den Ersatz von GDP durch GTP in der α-Untereinheit des GSαβγ-Komplexes zu katalysieren. Dies führt zur Dissoziation des Trimers in ein inaktives Dimer, βγ, und den GSα-GTP-Komplex, der sich entlang der Ebene der inneren Oberfläche der Plasmamembran, an der er durch eine kovalent gebundene Palmitoylgruppe verankert ist, bewegt, bis er die Adenylylcyclase (EC 4.6.1.1.1) erreicht.
Anmerkung: Die Wirkung von GS ähnelt der der Ras-Proteine, einer anderen Klasse von G-Proteinen, die an der Insulinsignaltransduktion beteiligt sind.
Adenylylcyclase
Es handelt sich um ein integrales Membranenzym, dessen aktives Zentrum auf der zytosolischen Seite der Plasmamembran liegt. Durch die Interaktion zwischen GSα und Adenylcyclase wird das Enzym aktiviert, das wiederum die Synthese von cAMP aus ATP katalysiert. Dies führt zu einem Anstieg der intrazellulären Konzentration des zyklischen Nukleotids.
Die stimulierende Aktivität von GSα ist selbstlimitierend, da es ein GPTasi ist, d.h. es hydrolysiert das gebundene GTP zu GDP und schaltet sich dadurch selbst ab. In der inaktiven Form dissoziiert GSα von der Adenylcyclase und reassoziiert mit dem Gβγ-Dimer. Somit steht das Heterotrimer wieder für die Interaktion mit einem Hormon-Rezeptor-Komplex zur Verfügung.
Proteinkinase A
cAMP bindet und aktiviert die cAMP-abhängige Proteinkinase oder Proteinkinase A oder PKA (EC 2.7.11.11). Die inaktive Form des Enzyms ist ein Tetramer, das aus zwei katalytischen Untereinheiten und zwei regulatorischen Untereinheiten besteht. Jede der beiden regulatorischen Untereinheiten besitzt eine autoinhibitorische Domäne, d. h. einen Bereich, der die Bindungsstelle für das Substrat der jeweiligen katalytischen Untereinheit besetzt. Die Bindung von zwei cAMP-Molekülen an zwei Stellen auf jeder regulatorischen Untereinheit führt zu einer Konformationsänderung, die ihre Dissoziation vom Tetramer bewirkt und die beiden katalytischen Untereinheiten als aktive Enzyme freisetzt. Die aktive Form von PKA katalysiert die Phosphorylierung einiger Proteine und aktiviert oder hemmt sie, wie zum Beispiel:
- Glykogensynthase (EC 2.4.1.11), gehemmt;
- hormonsensitive Lipase (EC 3.1.1.79), aktiviert;
- Phosphofructokinase 2/Fructose-2,6-Bisphosphatase (EC 2.7.1.105 bzw. EC 3.1.3.46), aktiviert;
- Inhibitor-1 und die Glykogen-bindende (G)-Untereinheit der Proteinphosphatase 1, aktiviert;
- Phosphorylase-Kinase, aktiviert.
cAMP hat eine sehr kurze Halbwertszeit: Es wird in der von der zyklischen Nukleotidphosphodiesterase (EC 3.1.4.53) katalysierten Reaktion zu AMP hydrolysiert, das keine Second-Messenger-Aktivität hat. Koffein und Theophyllin, zwei Methylxanthine, die in Kaffee bzw. Tee enthalten sind, hemmen die Phosphodiesterase, erhöhen dadurch die Halbwertszeit von cAMP und verstärken seine Wirkung.
Phosphorylase-Kinase
Der nächste Schritt in der Kaskade wird von der Phosphorylase-Kinase katalysiert.
Das Protein besteht aus vier verschiedenen Untereinheiten, die jeweils in vierfacher Ausfertigung vorliegen und einen Komplex bilden, der als (αβγδ)4 bezeichnet wird. Die γ-Untereinheiten haben katalytische Aktivität, während α, β und δ regulatorische Untereinheiten sind. α- und β-Untereinheiten werden phosphoryliert, wenn das Enzym vom inaktiven in den aktiven Zustand übergeht. Die δ-Untereinheit, auch Calmodulin genannt, ist ein regulatorisches Protein, das Calcium-Ionen bindet. Dieses Protein ist auch in einer großen Anzahl anderer Enzyme vorhanden. Es wirkt als Calcium-Sensor, d. h. es reagiert auf Veränderungen der intrazellulären Calcium-Konzentration und beeinflusst die Aktivität von Proteinen, mit denen es interagiert (siehe unten). Die Phosphorylase-Kinase existiert in zwei Isoformen, von denen eine in der Leber und die andere im Skelett- und Herzmuskel exprimiert wird; sie unterscheiden sich hinsichtlich der α- und γ-Untereinheiten, die von unterschiedlichen Genen kodiert werden.
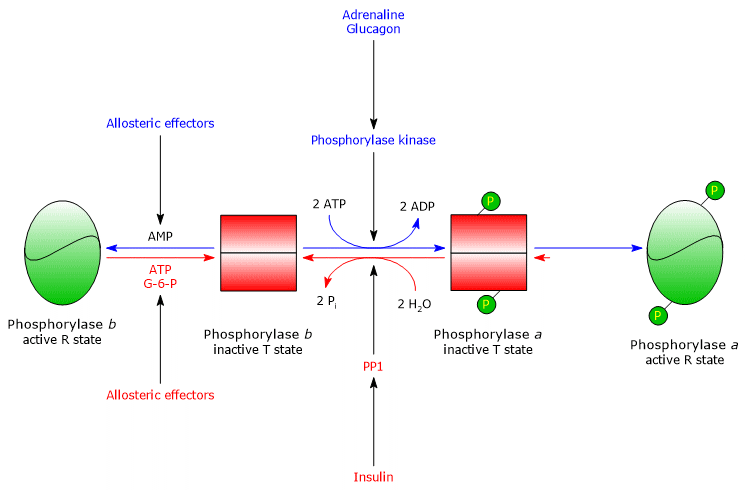
Eines der Zielproteine der Phosphorylase-Kinase ist die Glykogenphosphorylase. Dieses Enzym existiert als Isoenzyme in verschiedenen Geweben und in zwei Konformationszuständen im dynamischen Gleichgewicht, die als:
- T, für tense oder taut, was weniger aktiv ist;
- R, für relaxed, was aktiver ist und in der Lage ist, an Glykogen zu binden, auch im phosphorylierten Zustand (siehe unten).
Die Kinase phosphoryliert einen einzelnen Serinrest (Ser-14) in jeder der beiden Untereinheiten der Glykogenphosphorylase, die sich fast vollständig im T-Zustand befindet, und wandelt sie in die aktive Form um, die sich umgekehrt fast vollständig im R-Zustand befindet, und löst damit den Abbau von Glykogen aus.
Das phosphorylierte Enzym ist die aktivere Form des Enzyms und wird als Glykogenphosphorylase a bezeichnet; das nicht-phosphorylierte Enzym ist die weniger aktive Form des Enzyms und wird als Glykogenphosphorylase b bezeichnet. Die beiden Enzymformen können allosterisch gehemmt oder aktiviert werden (siehe unten).
Im Muskel wird bei der Glykogenolyse Glukose-1-Phosphat freigesetzt, das, wie zuvor gesehen, im Muskel selbst verstoffwechselt wird, um Energie für die Muskelkontraktion und damit für die durch Adrenalin ausgelöste Kampf-oder-Flucht-Reaktion zu erzeugen.
In der Leber löst Glukagon die Freisetzung von Glukose in den Kreislauf aus, um einer Unterzuckerung entgegenzuwirken.
Nach Beendigung der Stresssituation katalysiert die Phosphorylase a-Phosphatase, auch Phosphoproteinphosphatase 1 oder PP1 (EC 3.1.3.17) genannt, die Entfernung der Phosphatgruppen aus der Phosphorylasekinase und der Glykogenphosphorylase a und wandelt sie damit in inaktive Formen um (das Enzym entfernt auch die Phosphatgruppen aus der Glykogensynthase). PP1 besteht aus einer katalytischen Untereinheit, die eine geringe katalytische Effizienz und eine geringe Affinität zu Glykogen hat, und der bereits erwähnten G-Untereinheit, die zu einer Familie von Proteinen gehört, die andere Proteine an Glykogen binden, die als Glykogen-Targeting-Proteine bekannt sind (auch Phosphorylase-Kinase, Glykogen-Phosphorylase und Glykogen-Synthase werden durch Proteine dieser Familie an Glykogenpartikel gebunden).
PP1 wird auch durch ein anderes Protein gehemmt, das Inhibitor 1 von PP1 genannt wird.
Wie bereits erwähnt, wird PKA phosphoryliert:
- G-Untereinheit, die in der phosphorylierten Form nicht in der Lage ist, die katalytische Untereinheit von PP1 zu binden, und daher trifft PP1 nicht auf seine Glykogen-assoziierten Ziele (umgekehrt ermöglicht die durch Insulinstimulation induzierte Phosphorylierung der G-Untereinheit, die diverse Aminosäurereste betrifft, die Bindung an die katalytische Untereinheit von PP1);
- Inhibitor-1, der in der phosphorylierten Form in der Lage ist, die PP1-Aktivität zu hemmen.
Die Bindung des Hormons an seinen Rezeptor löst also eine Kaskadenreaktion aus, die u. a. zur Hemmung der PP1-Aktivität führt. Diese hält sowohl die Glykogenphosphorylase als auch die Glykogensynthase phosphoryliert: das erste Enzym wird aktiviert, während das letztere gehemmt wird. Auf diese Weise wird der Kohlenhydratstoffwechsel optimiert.
Allosterische Regulation der Glykogenolyse in Muskel und Leber
Die Glykogenolyse wird ebenfalls durch positive und negative allosterische Effektoren reguliert. Sie wirken auf drei Enzyme: Muskelphosphorylase-Kinase, hepatische und muskuläre Glykogenphosphorylase und PP1.
Muskelphosphorylase-Kinase
Die Enzymaktivität wird durch zwei positive allosterische Effektoren, Kalzium-Ionen und AMP, und einen negativen allosterischen Effektor, ATP, reguliert.
Ein Anstieg der intrazellulären Kalziumionenkonzentration ist das Signal für die Muskelkontraktion, und sobald es aus dem sarkoplasmatischen Retikulum freigesetzt wird, bindet Kalzium an die δ-Untereinheit (Calmodulin) des Enzyms und aktiviert es.
AMP akkumuliert im Muskel während einer intensiven Kontraktion aufgrund des ATP-Verbrauchs, bindet an das Enzym und aktiviert es. Umgekehrt, wenn die ATP-Konzentration hoch ist, d.h. der Muskel nicht kontrahiert, bindet es an die allosterische Stelle für AMP und inaktiviert die Kinase.
Phosphorylase-Kinase in der Leber
Einige Hormone können sowohl durch die Auslösung kovalenter Modifikationen von Zielproteinen als auch durch die Freisetzung von Kalzium-Ionen aus dem endoplasmatischen Retikulum wirken.
In der Leber wird die Phosphorylase-Kinase durch Hormone reguliert, die die Freisetzung von Kalzium-Ionen verursachen. Beispiele sind Vasopressin, aber auch Adrenalin, wenn es an die α1-Rezeptoren bindet. Bei Adrenalin wird durch die Bindung an die α1-Rezeptoren ein G-Protein aktiviert, das die Phospholipase C-β stimuliert, die wiederum Phosphatidylinositol-4,5-bisphosphat in Inositol-1,4,5-Triphosphat (IP3) und Diacylglycerol umwandelt. Inositol-1,4,5-Triphosphat bewirkt die Freisetzung von Calciumionen aus dem endoplasmatischen Retikulum. Kalziumionen, die an die δ-Untereinheit der Phosphorylase-Kinase binden, führen zu deren Aktivierung.
Muskelglykogenphosphorylase
Muskelglykogenphosphorylase b wird in Gegenwart hoher Konzentrationen von AMP aktiviert, das durch Bindung an eine spezifische Nukleotid-Bindungsstelle die quaternäre Struktur des Enzyms verändert und das allosterische Gleichgewicht in Richtung des aktiven R-Zustands der b-Form verschiebt. Umgekehrt wirken ATP und Glukose-6-Phosphat, die mit AMP um dieselbe Nukleotid-Bindungsstelle konkurrieren, als negative allosterische Effektoren und verschieben das allosterische Gleichgewicht in Richtung des inaktiven T-Zustands der b-Form.
Muskel-Glykogenphosphorylase a ist aktiv, unabhängig von AMP-, ATP- und Glukose-6-Phosphat-Spiegeln.
Im ruhenden Muskel liegt fast die gesamte Glykogenphosphorylase in der inaktiven b-Form vor.
In der Tat, sorgt die kovalente und allosterische Regulation des Enzyms dafür, dass der intrazelluläre Glukosespiegel fein reguliert wird.
- Wenn eine Zelle mit einer ausreichenden Energieladung das hormonelle Signal erhält, das die Aktivierungskaskade auslöst, bleibt die Glykogenphosphorylase b, die durch ATP und Glukose-6-Phosphat gehemmt wird, im T-Zustand, bis die Ladung hoch ist.
- Wenn die zelluläre Energieladung niedrig ist, beginnt die Glykogenphosphorylase b, die durch AMP aktiviert wird, mit dem Glykogenabbau, selbst in Abwesenheit des hormonellen Stimulus, der ihre Umwandlung in die aktive a-Form induziert.
Allosterische Regulation von PP1
PP1 wird allosterisch durch Glucose-6-Phosphat aktiviert, also wenn die zelluläre Energieladung niedrig ist.
Hepatische Glykogenphosphorylase
In der Leber erfolgt die allosterische Regulation des Enzyms durch unterschiedliche Mechanismen.
- Der erste Unterschied betrifft die Reaktion auf AMP: Die hepatische Glykogenphosphorylase b wird durch AMP nicht aktiviert.
- Der zweite Unterschied betrifft die Glykogenphosphorylase a: Das Enzym wird durch Glukose gehemmt, die ein kompetitiver Inhibitor ist (das Monosaccharid verschiebt das allosterische Gleichgewicht in Richtung des inaktiven T-Zustands der a-Form.
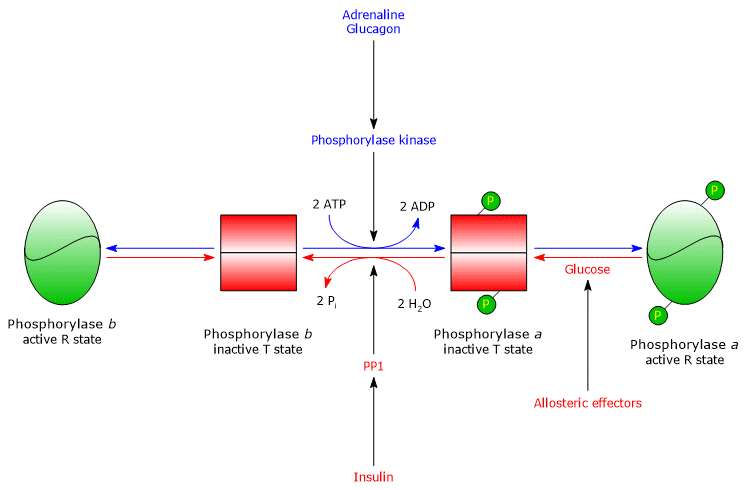
In der Leber, ist der Zweck der Glykogenolyse die Bereitstellung von Glukose für andere Gewebe, wenn der Blutzuckerspiegel niedrig ist. Wenn sich der Blutzuckerspiegel wieder normalisiert, steigt seine Konzentration in den Hepatozyten an und er bindet an die Glykogenphosphorylase a, wodurch eine Konformationsänderung induziert wird, die die phosphorylierten Serinreste der PP1-Aktivität aussetzt, die das Enzym durch Dephosphorylierung inaktiviert. Daher ermöglicht die allosterische Stelle für Glukose der hepatischen Glykogenphosphorylase dem Enzym, als Blutzuckersensor zu fungieren und entsprechend auf Änderungen des Blutzuckerspiegels zu reagieren. Letztlich reagiert das hepatische Isoenzym nur auf Glukose, nicht auf AMP, also auf die zelluläre Energieladung, und das ist bemerkenswert, weil Fettsäuren und nicht Glukose die primäre Energiequelle für die Leber sind.
Berg J.M., Tymoczko J.L., und Stryer L. Biochemistry. 5. Auflage. W. H. Freeman and Company, 2002
Nelson D.L., M. M. Cox M.M. Lehninger. Principles of Biochemistry. 4th Ed. W.H. Freeman and Company, 2004
Rawn J.D. Biochimica. Mc Graw-Hill, Neil Patterson Publishers, 1990
Roach P.J., Depaoli-Roach A.A., Hurley T.D., Tagliabracci V.S. Glycogen and its metabolism: some new developments and old themes. Biochem J 2012:441;763-87. doi:10.1042/BJ20111416
Rosenthal M.D., Glew R.H. Medical Biochemistry – Human Metabolism in Health and Disease. John Wiley J. & Sons, Inc., Publication, 2009