Das Periodensystem ist eine tabellarische Anordnung der chemischen Elemente, geordnet nach Ordnungszahl, Elektronenkonfigurationen und wiederkehrenden chemischen Eigenschaften. Diese Reihenfolge zeigt periodische Trends, wie z. B. Elemente mit ähnlichem Verhalten in der gleichen Spalte. Im Allgemeinen sind die Elemente innerhalb einer Reihe (Periode) links die Metalle und rechts die Nichtmetalle.
Das Periodensystem ist eines der sinnbildlichsten Symbole der Wissenschaft, es fasst einen Großteil des Wissens der Chemie zusammen. In jeder seiner Versionen ist es in Klassenzimmern und Laboren auf der ganzen Welt präsent. Keine andere Disziplin hat ein ähnliches Dokument.
Das in der zweiten Hälfte des 19. Jahrhunderts entwickelte Periodensystem lieferte eine systematische Einteilung der Elemente in natürliche Gruppen. Der Umfang dieser Anordnung ermöglichte es, die Eigenschaften einiger unbekannter Elemente und die wahrscheinlichen Verbindungen, die sie bildeten, mit beträchtlicher Sicherheit vorherzusagen. Spätere Entwicklungen lieferten die theoretische Grundlage für das heutige Periodensystem. Die große Zahl der bekannten Elemente und synthetisierten Substanzen machte es dringend notwendig, sie zu klassifizieren.
Ein bisschen Geschichte zum Periodensystem
Im Frühjahr 1812 versuchte der deutsche Chemiker John W. Döbereiner eine erste Annäherung, indem er die entdeckten Elemente in Dreiergruppen ordnete. Bei dieser Klassifizierung wurden sie in aufsteigender Reihenfolge nach ihrer Atommasse gruppiert.
Im Jahr 1860 verifizierte der Franzose Alexandre Béguyer (ein französischer Geologe) eine gewisse Periodizität der Elemente, indem er ihre Größen und physikalischen Eigenschaften verglich. In seinen Studien verifizierte er eine logische Abfolge zwischen den beobachteten Größen und Eigenschaften der Atome und ihren jeweiligen Größen und Häufigkeiten.
Im Jahr 1864 veröffentlichte Julius Lothar Meyer die erste Version des Periodensystems und später der russische Chemiker Dmitri Iwanowitsch Mendelejew, der das Periodengesetz und das Periodensystem der chemischen Elemente formulierte und veröffentlichte.

Dmitri Iwanowitsch Mendelejew
Mendelejews Prognosefähigkeit war brillant; Er stellte nicht nur das Gesetz der chemischen Periodizität auf, er ordnete auch die gefundenen Elemente und sparte Platz für die noch nicht entdeckten und sagte sogar deren physikalische und chemische Eigenschaften voraus.
Das Periodensystem heute
Das Verhalten der Atome wird durch ihre elektronische Konfiguration bestimmt, wobei die Verteilung der Elektronen im äußersten Niveau ihre Reaktivität und chemische Natur bestimmt. Aus diesem Grund werden die Elemente, die eine ähnliche elektronische Verteilung besitzen, auch ähnliche chemische Eigenschaften aufweisen.
Die Eigenschaften der Atome wiederholen sich periodisch, wenn die chemischen Elemente nach ihrer aufsteigenden Ordnungszahl (Z) geordnet werden.
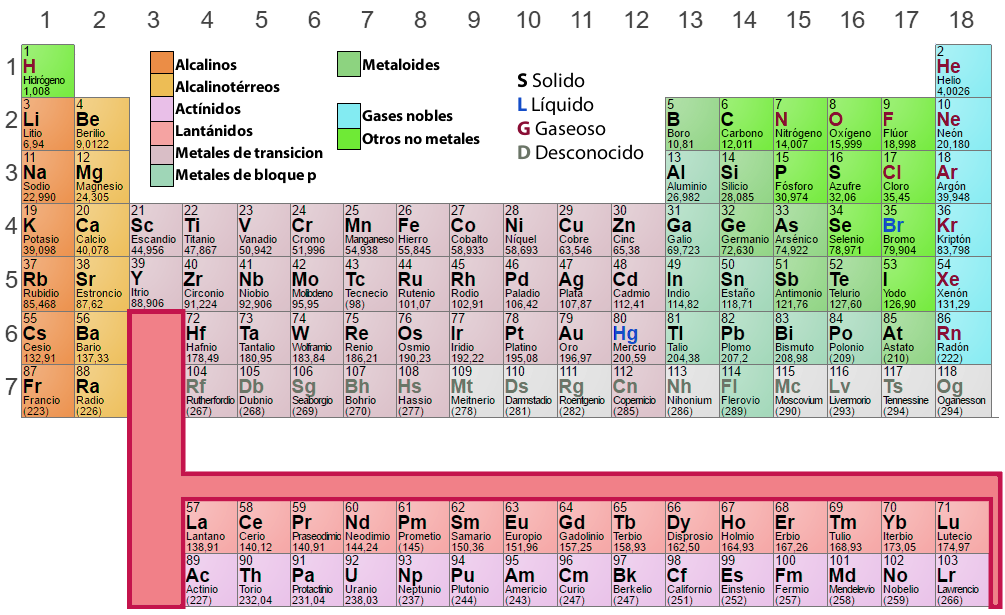
Analyse des Periodensystems
Im Periodensystem sind Elemente, die ein ähnliches Muster der Elektronenkonfiguration in der äußeren Schale haben, in den gleichen Spalten (Gruppen oder Familien) angeordnet. Diejenigen Elemente, die identische Energieniveaus haben, sind in den gleichen Reihen (Perioden) angeordnet.
Gruppen oder Familien
Dies ist eine vertikale Anordnung der Elemente im Periodensystem, nach ähnlichen chemischen Eigenschaften. Die traditionelle Nummerierung der achtzehn Spalten ist I A, II A, III A, IV A, usw., wie wir im obigen Periodensystem sehen. Heutzutage empfiehlt die IUPAC (International Union of Pure and Applied Chemistry) eine fortlaufende Nummerierung, d.h.: 1, 2, 3, 4, 5, usw. Es ist wichtig, Folgendes zu beachten:
- Wasserstoff (H), obwohl in Gruppe IA (1) vorkommend, ist kein Alkalimetall. Im Gegenteil, Wasserstoff
unterscheidet sich so sehr von den anderen chemischen Elementen, dass manche Klassifizierungen ihn lieber außerhalb der
Tabelle platzieren. - Die Gruppe A ist die wichtigste in der Tabelle, ihre Elemente werden als repräsentativ bezeichnet.
- Elemente in den Gruppen III B, IV B, V B, VI B, VII B, VIII B, I B und II B bilden die sogenannten Übergangs
Elemente. Beachten Sie, dass die Gruppe VIII B eine Dreiergruppe ist. - Eine weitere wichtige Unterteilung, die wir im Periodensystem vornehmen können, ist die, in der wir die
Elemente in Metalle, Nichtmetalle und Edelgase einteilen.
Elemente in der gleichen Gruppe besitzen ähnliche chemische Eigenschaften und zeichnen sich dadurch aus, dass sie eine gleiche Anzahl von Elektronen im letzten Energieniveau haben. Jedes Element einer Gruppe wird in verschiedene Perioden eingeordnet und zur Kennzeichnung wird mit römischen Ziffern (I, II, III, IV, etc.) die Anzahl der Elektronen in der letzten Ebene notiert, gefolgt von einem Buchstaben (A oder B), der seine Natur und die Arten der Orbitale, die es aufweist, kennzeichnet.
Perioden
Die sieben horizontalen Linien oder Reihen, die im Periodensystem vorkommen, nennt man Perioden, das ist wichtig zu wissen:
- In der sechsten Periode umfasst das dritte Gitter 15 Elemente (von Lanthan bis Lutetium), die der Einfachheit halber auf einer Linie unterhalb der Tabelle angegeben sind; beginnend mit Lanthan bilden diese Elemente die sogenannte Lanthanidenreihe.
- Analog dazu umfasst das dritte Gitter in der siebten Periode ebenfalls 15 chemische Elemente (Actinium bis Laurentium), die in der zweiten Zeile unterhalb der Tabelle angegeben sind. Beginnend mit Actinium bilden sie die Actinidenreihe.
- Es ist zu beachten, dass alle Elemente nach Uran (U-92) nicht in der Natur vorkommen, sondern künstlich synthetisiert werden müssen. Sie werden als transuranische Elemente bezeichnet. Neben diesen Elementen werden auch Technetium (Tc-43), Promethium (Pm-61) und Astat (As-85) künstlich synthetisiert.
Elemente der gleichen Periode haben die gleiche Anzahl von Energieniveaus mit Elektronen. Die Perioden werden unter Berücksichtigung des Wertes des äußersten Energieniveaus nummeriert. Jede Periode beginnt mit einem Alkalimetall und endet mit einem Edelgas, außer der ersten Stufe, in der sich Wasserstoff befindet.
Elemente im Periodensystem
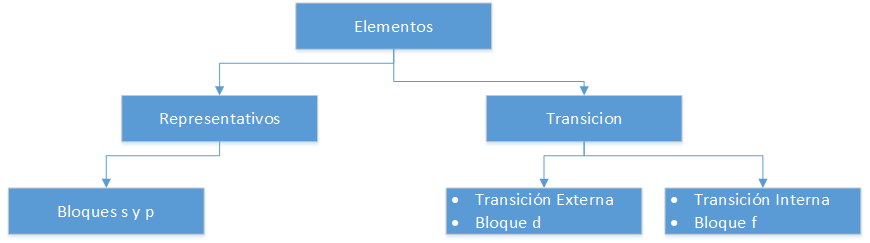
Repräsentative Elemente
Sie entsprechen der Gruppe A des Periodensystems. Sie entsprechen nicht der Oktettregel, d.h. ihr letztes Energieniveau ist kleiner als 8 Elektronen. So haben z.B. die Atome der repräsentativen Elemente der Gruppe III A, wie z.B. Aluminium (Al), 3 Valenzelektronen in ihrer letzten Schale, d.h. sie haben unvollständige p-Orbitale (p1 bis p6).
Die Elemente der Gruppen IA bis VA, haben die Tendenz, Elektronen abzugeben, um die nächstliegende Edelgaskonfiguration (ns2 np6) zu erreichen. Im Gegensatz dazu nehmen Elemente der Gruppen VI A und VII A Elektronen auf, um die nächstliegende Edelgaskonfiguration zu erreichen.
| Gruppe | Name | Elektronische Konfiguration |
|---|---|---|
| IA | Alkaline | ns1 |
| IIA | A. | ns2np2 |
| VA | Stickstoffhaltig | ns2np3 |
| VIA | Kohlenstoffhaltig | ns2np4 |
| VIA | Kohlenstoffhaltig | ns2np4 |
| VIIA | Halogene | ns2np5 |
| 0 | Edelgase | ns2np6 |
Externe Übergangselemente
Sie befinden sich in der Gruppe B des Periodensystems. Die Elemente, die zu dieser Klassifizierung gehören, haben d-Orbitale (d1 bis d10) in ihrem letzten Energieniveau.
Innere Übergangselemente
Sie befinden sich im unteren Teil des Periodensystems, man nennt sie auch Seltene Erden. Ihr Hauptmerkmal ist, dass sie f-Orbitale (f1 bis f14) in ihrem letzten Energieniveau haben.
Natur der Elemente
Edelgase
- Spalte 18 im Periodensystem.
- Gruppe VIII oder 0.
- Sie sind dadurch gekennzeichnet, dass alle ihre elektronischen Niveaus vollständig sind.
- Elektronische Konfiguration vom Typ ns2p6, ns2 (Helium).
- Unter normalen Bedingungen sind sie chemisch inert (sehr unreaktiv).
Metallische Elemente
- Sie sind fast alle fest (bei Raumtemperatur), mit Ausnahme von Quecksilber, Cäsium und Rubidium.
- Sie sind sehr gute Leiter für elektrischen Strom.
- Sie verlieren leicht Elektronen und werden zu stabilen Kationen.
- Sie haben einen metallischen Glanz und sind sehr gute Wärmeleiter.
- Sie sind duktil, d.h. sie können unter Krafteinwirkung verformt werden, ohne zu brechen.
- Sie sind verformbar, d.h. ihre Verformbarkeit erlaubt es, sie zu Blechen zu verarbeiten.