Zimtsäure Chemische Eigenschaften,Verwendungen,Herstellung
Chemische Eigenschaften
Zimtsäure existiert in cis- und trans-Formen. Das stabilere Isomer ist das trans-Isomer, das natürlich vorkommt und das übliche Handelsprodukt ist. Sie erscheint als weiße monokline Prismen mit leichtem Zimtaroma. Es ist löslich in Ethanol, Methanol, Petrolether und Chloroform; es ist leicht löslich in Benzol, Ether, Aceton, Essigsäure, Schwefelkohlenstoff und Ölen, aber unlöslich in Wasser.
Zimtsäure wurde erstmals 1780 von Trommsdorf als Kristalle aus Zimtöl isoliert. Er hielt sie für Benzoesäure. Dumas und Peligot ‚ identifizierten sie 1835, und 1856 gelang Bertagnini die Synthese aus Benzaldehyd und Acetylchlorid.
Zimtsäure geht typische Reaktionen mit einer Carboxylgruppe und einer olefinischen Doppelbindung ein. Die Carboxylgruppe kann zu Zimtsäureestern verestert werden, von denen einige wichtige Geschmacks- und Duftstoffe sind. Bei Reaktion mit anorganischen Säurechloriden, wie Thionylchlorid oder Phosphorchloriden, entsteht aus Zimtsäure Zimtamylchlorid . Beim Erhitzen bildet Zimtsäure Styrol und Kohlendioxid. Mit Oxidationsmitteln oder beim Erhitzen mit Alkali spaltet sich die olefinische Doppelbindung unter Bildung von Benzaldehyd .
Physikalische und chemische Eigenschaften
Zimtsäure, auch Benzalacetat, 3-Phenyl-2-propensäure genannt, gehört zu den ungesättigten aromatischen Säuren und riecht leicht nach Zimt. Sie kommt in Balsam, Zimtöl und Cocablatt in freier oder Esterform vor. Aufgrund des Vorhandenseins einer Doppelbindung hat Zimtsäure trans-/ cis-zwei Isomere, wobei die cis-Form zusätzlich drei Arten von homogenen Polykristallen enthält. Sowohl die trans-Form als auch die cis-Form liegen in der Natur vor. Die trans-Form existiert in der Gegenwart von ätherischen Ölen wie Storax, Zimtöl, peruanischem Balsam, Basilikumöl und Kakaoblättern. Die cis-Form existiert in Malakka-Galgantöl, wobei die trans-Form stabiler ist als die cis-Form. Die handelsüblichen Produkte liegen meist in der trans-Form vor. Es hat eine relative Molekülmasse von 148,17. Die erste kristalline Form der cis-Form wird Allozimtsäure genannt, wobei die aus Wasser ausgefällte Verbindung monoklin ist. Es ist farblos bis weiß prismatische Kristalle mit der relativen Dichte von 1,284 (4 ℃), der Schmelzpunkt ist 42 ℃, der Siedepunkt 265 ℃ (Zersetzung ) und 125 ℃ (2,533 × 103Pa); es ist schwer löslich in Wasser (25 ℃, wenn 0,937), aber leicht löslich in Alkohol, Ether und Ethylacetat.Die zweite polymorphe wird alpha-iso-Zimtsäure mit der Verbindung aus Ligroin ausgefällt ist die monokline Kristall. Es ist farblos bis weiß prismatische Kristalle mit dem mp ist 58 ℃ und der Siedepunkt 265 ℃. Es ist löslich in Ethanol, Essigsäure, Chloroform und Aceton und leicht löslich in Ether. Das dritte Polymorph wird beta-Iso-Zimtsäure genannt; es erscheint als monokline farblose bis weiße prismatische Kristalle mit dem mp bei 68 ℃. Es ist löslich in Alkohol, Ether, Essigsäure, Chloroform und Aceton. Das aus verdünntem Ethanol gefällte Trans-Isomer gehört zum monoklinen Kristall und erscheint als weiße bis blassgelbe prismatische Kristalle mit einer relativen Dichte von 1,2475 (4 ℃), einem Schmelzpunkt von 133 ℃ und einem Siedepunkt von 300 ℃. Es ist sehr schwer löslich in Wasser (25 ℃: 0,1; 98 ℃: 0,588), löslich in Ethanol (25 ℃: 23), Chloroform (15 ℃: 5,9), leicht löslich in Benzol, Ether, Aceton, Essigsäure und Schwefelkohlenstoff. Bei der Destillation bei 140 ℃ wird es durch Decarboxylierung zu Styrol (Styrax BP). Bei der Oxidation bildet es Benzoesäure. Sowohl die cis- als auch die trans-Isomere haben ein Blütenhonigaroma mit süßem und würzigem Geschmack. Ratte-Oral LD50: 2500 mg/kg.
Rolle und Zweck
Zimtsäure ist eine wichtige Art von organischem synthetischem Rohstoff. Es wird hauptsächlich für die Synthese von Methylzimtsäure, Ethylzimtsäure und Zimtsäurebenzylester verwendet. Es ist weit verbreitet in der Parfümindustrie und der pharmazeutischen Industrie. In der Medizin wurde sie schon immer als Insektenschutzmittel eingesetzt.
Zimtsäure wurde als Gewürz für die Herstellung von Kirsch-, Aprikosen-, Honig- und Zimtaromen und -geschmack verwendet; sie kann auch als Ausgangsmaterial für Zimtsäureester verwendet werden. Die GB2760-1996 unseres Landes sah vor, dass Zimtsäure ein zulässiges essbares Gewürz ist; darüber hinaus kann sie auch als Rohstoff der lichtempfindlichen Harz-Polyvinylzimtsäure-Serie verwendet werden; sie kann auch als Rohstoff für die Synthese von Methyl-, Ethyl- und Benzylestern verwendet werden. Diese Ester können als Duftstoffe in Kosmetika und Seife verwendet werden, sie können auch als Rohstoffe für Lokalanästhetika, hämostatische Mittel und Pharmazeutika (Milchsäure, Prenylamin und Baclofen usw.) verwendet werden; Zimtsäure kann auch als Pflanzenwachstumsregulatoren und Rohstoffe für Pestizide, Korrosionsschutzmittel für Obst und Gemüse, Rohstoffe für Ultraviolettmittel und lichtempfindliches Harz für kosmetische Sonnenschutzmittel verwendet werden. Zimtsäure kann auch als Standard für die organische Spurenanalyse und die Bestimmung der Doppelbindung, die Bestimmung von Uran und Vanadium und die Thoriumtrennung verwendet werden.
Verwendungen
Zimtsäure ist ein wichtiges Zwischenprodukt bei der Herstellung ihrer Ester, die als Duftstoffe, für Pharmazeutika und für die enzymatische Herstellung von l-Phenylalanin, dem Ausgangsstoff für Peptid-Süßstoffe, verwendet werden. Natriumcinnamat ist als Korrosionsschutzmittel bekannt. Zimtsäure wird auch als Aufheller in cyanidfreien galvanischen Zinkbädern, als Korrosionsinhibitor bei der Entkalkung von Zink und in Aerosoldosen, als ungiftiger Hitzestabilisator für Polyvinylchlorid, als Vernetzungsmittel für Dimethylterephthalat-Ethylenglykol-Copolymer und Polyurethane, als Flammschutzmittel für Polycaprolactam, in waschbeständigen Polyurethanklebstoffen für Polyesterfasern und zur Verbesserung der Lagerstabilität von trocknungsölmodifizierten Alkydharzlacken eingesetzt.
Zubereitung
Zimtsäure wird auch durch Knoevenagel-Kondensation von Benzaldehyd mit Malonsäure in Gegenwart von schwach basischen Katalysatoren, wie Ammoniak und Aminen, hergestellt.
Zusammen 10ml Benzaldehyd mit 10g Malonsäure und 40ml 8%iger ethanolischer Ammoniaklösung in einem 100ml Rundkolben mit Rückflusskondensator auf dem Wasserbad unter Rückfluss erhitzen, bis eine klare Lösung entsteht (ca. 8-10 Stunden). Stellen Sie den Aufbau auf Abwärtsdestillation ein und destillieren Sie den überschüssigen Alkohol ab. Erhitzen Sie den verbleibenden öligen Anteil weiter, bis die Entwicklung von Kohlendioxid aufhört. Lösen Sie den Rückstand in 20 ml Wasser, kühlen Sie ihn ab und geben Sie verdünnte Salzsäure hinzu, bis er sauer ist. Die ausgefallene ungesättigte Säure im Buchner-Trichter auffangen, mit kaltem Wasser auswaschen. In heißem Wasser umkristallisieren und Kristalle der Zimtsäure sammeln, m.p 132°C.
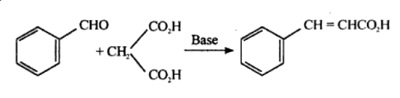
Synthese von Zimtsäure aus Benzaldehyd
Gehaltsanalyse
500 mg der Probe, die zuvor 3 Stunden in einem mit Kieselgel gefüllten Trockner getrocknet wurde, genau abwiegen; 0,1mol/L Wasserstoff hinzufügen.
Toxizität
GRAS (FEMA).
Die akute orale LD50 bei Ratten beträgt 2,5 g/kg und die akute dermale LD50 bei Kaninchen übersteigt 5 g/kg. Zimtsäure, die 24 Stunden lang unverdünnt auf intakte oder abgeschürfte Kaninchenhaut aufgetragen wurde, war leicht reizend; eine 4-prozentige Lösung in Petrolatum führte beim Menschen zu keiner Sensibilisierung.
Beschränkte Verwendung
FEMA (mg/kg): Softdrinks 31; Kaltgetränke 40; Süßwaren 30; Backwaren 36; Kaugummi 10.
Mäßig als Grenzwert nehmen (FDA§172.515, 2000).
Herstellungsmethode
Die kommerzielle Synthese von Zimtsäure ergibt fast immer das trans-Isomer.
Die Perkin-Reaktion ist die älteste bekannte Methode, Zimtsäure kommerziell herzustellen. Bei dieser Reaktion wird Benzaldehyd mit Essigsäureanhydrid in Gegenwart von Natriumacetat als Katalysator kondensiert.
Benzalchlorid reagiert mit Alkaliacetat im alkalischen Medium und ergibt eine hohe Ausbeute an Zimtsäure. Zimtsäure kann durch diese Reaktion in Gegenwart von Aminen, wie z. B. Pyridin, in mehr als 80 % Ausbeute erhalten werden.
Sie kann auch hergestellt werden durch: das Mischen von Benzoylaceton, Natriumcarbonat und Bleiche, wodurch Natriumzimtsäure entsteht, gefolgt von der Verarbeitung mit Sulfat.
Beschreibung
Zimtsäure ist eine weiße kristalline organische Säure, die in Wasser schwer löslich ist.
Sie wird aus Zimtöl oder aus Balsamen wie Storax gewonnen. Sie kommt auch in Sheabutter vor und ist der beste Hinweis auf ihre Umweltgeschichte und die Bedingungen nach der Extraktion. Sie kann auch synthetisch hergestellt werden.
Zimtsäure wird in Aromen, synthetischem Indigo und bestimmten Pharmazeutika verwendet, obwohl ihre Hauptverwendung in der Herstellung der Methyl-, Ethyl- und Benzylester für die Parfümindustrie liegt. Zimtsäure hat einen honigartigen Geruch; sie und ihr flüchtigerer Ethylester (Ethylcinnamat) sind Geschmackskomponenten im ätherischen Öl des Zimts, in dem der verwandte Zimtaldehyd der Hauptbestandteil ist. Zimtsäure ist auch Teil des biosynthetischen Shikimat- und Phenylpropanoidweges. Ihre Biosynthese erfolgt durch Einwirkung des Enzyms Phenylalanin-Ammoniak-Lyase (PAL) auf Phenylalanin.
Zimtsäure ist frei löslich in Benzol, Diethylether, Aceton und unlöslich in Hexan.
Zimtsäure ist auch eine Art Selbstinhibitor, der von Pilzsporen produziert wird, um die Keimung zu verhindern.
Chemische Eigenschaften
Zimtsäure ist fast geruchlos und hat einen brennenden Geschmack, dann wird sie süß und erinnert an Aprikose.
Vorkommen
Die trans-Form wurde unter den Bestandteilen der ätherischen Öle von Basilikum, chinesischem Zimt, Melaleuca bracteata, Alpinia galanga gefunden. Es wird berichtet, dass es in Perubalsam, asiatischem und amerikanischem Storax und Kakaoblättern gefunden wird. Es wird auch in Erdbeerfrüchten, Bier, Cognac, Sternfrucht (Averrhoa carambola L) und Mispel gefunden. Die cis- Form ist im Öl vonAlpinia malacensis vorhanden.
Verwendungen
Duftstoff & Aromastoff, Antidiabetikum
Verwendungen
Zimtsäure hat Sonnenschutzfähigkeiten. Einige Hersteller verwenden sie als Ersatz für PABA, weil sie weniger allergische und phototoxische Reaktionen hervorruft. Zimtsäure kommt in Zimtblättern und Kakaoblättern vor und ist ein ätherisches Öl bestimmter Pilze. Es kann allergische Hautausschläge verursachen.
Verwendungen
Zimtsäure ist ein Aromastoff, der aus kristallinen Schuppen besteht, weiß in der Farbe, mit einem Geruch, der an Honig und Blumen erinnert. es ist leicht löslich in Wasser, löslich in Alkohol, Chloroform, Essigsäure, Aceton, Benzol und den meisten Ölen und Alkalisalzen, die in Wasser löslich sind. es wird durch chemische Synthese gewonnen. es wird auch als 3-Phenylpropenoinsäure bezeichnet.
Definition
ChEBI: Eine Monocarbonsäure, die aus Acrylsäure besteht, die einen Phenylsubstituenten an der 3-Position trägt. Sie ist in Cinnamomum cassia enthalten.
Zubereitung
Es existieren zwei Isomere, trans- und cis-; das trans-Isomer ist für die Verwendung in Aromen von Interesse; neben der Extraktion aus natürlichen Quellen (Storax) kann es wie folgt hergestellt werden: (1) aus Benzaldehyd, wasserfreiem Natriumacetat und Essigsäureanhydrid in Gegenwart von Pyridin (Perkin-Reaktion); (2) aus Benzaldehyd und Ethylacetat (Claisen-Kondensation); (3) aus Benzaldehyd und Acetylenchlorid; (4) durch Oxidation von Benzylidenaceton mit Natriumhypochlorit.
Synthese-Referenz(en)
Journal of the American Chemical Society, 75, S. 1068, 1953 DOI: 10.1021/ja01101a016
The Journal of Organic Chemistry, 59, S. 710, 1994 DOI: 10.1021/jo00083a006
Sicherheitsprofil
Giftig bei intravenöser und intraperitonealer Aufnahme. Mäßig giftig bei Verschlucken. Hautreizend. Brennbare Flüssigkeit. Entwickelt beim Erhitzen bis zur Zersetzung beißenden Rauch und Dämpfe.
Chemische Synthese
Rainer Ludwig Claisen (1851-1930), deutscher Chemiker, beschrieb 1890 erstmals die Synthese von Zimtsäuren durch Reaktion von aromatischen Aldehyden mit Estern. Die Reaktion ist als Claisen-Kondensation bekannt.
Reinigungsmethoden
Man kristallisiert die Säure aus *Benzol, CCl4, heißem Wasser, Wasser/EtOH (3:1) oder 20%igem wässrigem EtOH. Trocknen Sie sie bei 60o im Vakuum. Sie ist wasserdampfflüchtig.