
Une pieuvre géante du Pacifique Nord femelle (Enteroctopus dofleini) vit trois à quatre ans ; elle pond des milliers d’œufs en un seul combat, puis meurt. En revanche, un séquoia du littoral (Sequoia sempervirens) mature vit plusieurs centaines d’années et produit des millions de graines chaque année (figure 1). Comme l’illustrent ces deux exemples, les organismes diffèrent considérablement dans leur mode de développement, le temps qu’ils mettent à croître, le moment où ils deviennent matures, le nombre de descendants d’une taille particulière qu’ils produisent et la durée de leur vie. Ensemble, les modèles de développement, de croissance, de maturation, de reproduction, de survie et de durée de vie spécifiques à l’âge, à la taille ou au stade définissent le cycle de vie d’un organisme, son histoire de vie.

Le principal objectif de la théorie de l’histoire de vie, une branche de l’écologie évolutive, est d’expliquer la remarquable diversité des histoires de vie parmi les espèces. Mais il y a une autre raison, plus convaincante, pour laquelle l’évolution du cycle de vie est importante : l’adaptation par la sélection naturelle est basée sur la variation de la fitness darwinienne entre les individus, et puisque les traits du cycle de vie déterminent la survie et la reproduction, ils sont les principales composantes de la fitness. L’étude de l’évolution du cycle biologique consiste donc à comprendre l’adaptation, la question la plus fondamentale de la biologie évolutive.
Nous présentons ici les bases de la théorie du cycle biologique et passons en revue ce que les biologistes ont appris sur l’évolution du cycle biologique. Pour une couverture plus approfondie, nous nous référons à Stearns (1992), Roff (1992, 2002), Charlesworth (1994), et Flatt et Heyland (2011). Voir également les articles de Shefferson (2010), Young (2010), et Fabian et Flatt (2011) de Nature Education Knowledge.
Les bases de la théorie de l’histoire de vie
La théorie de l’histoire de vie cherche à expliquer comment la sélection naturelle et d’autres forces évolutives façonnent les organismes pour optimiser leur survie et leur reproduction face aux défis écologiques posés par l’environnement (Stearns 1992, Roff 1992, Stearns 2000), ou comme David Reznick l’a récemment exprimé : « La théorie de l’histoire de vie prédit comment la sélection naturelle devrait façonner la façon dont les organismes concentrent leurs ressources pour faire des bébés » (Reznick 2010, p. 124). Pour ce faire, la théorie analyse l’évolution des composantes de la condition physique, appelées traits d’histoire de vie, et la façon dont elles interagissent : la taille à la naissance ; le modèle de croissance ; l’âge et la taille à la maturité ; le nombre, la taille et le sexe de la progéniture ; l’effort de reproduction spécifique à l’âge, au stade ou à la taille ; les taux de survie spécifiques à l’âge, au stade ou à la taille ; et la durée de vie.
La théorie classique traite l’évolution du cycle de vie comme un problème d’optimisation : compte tenu de facteurs écologiques particuliers (par exemple, les prédateurs, la nutrition) qui affectent la probabilité de survie et de reproduction d’un organisme, et compte tenu des contraintes limitatives et des compromis intrinsèques à l’organisme, quelles sont les valeurs et les combinaisons optimales des traits du cycle de vie qui maximisent le succès reproductif ? Pour trouver la solution à ce problème, nous devons comprendre ses « conditions limites » (Stearns 2000) : (1) comment les facteurs environnementaux extrinsèques affectent la survie et la reproduction ; et (2) comment les liens intrinsèques entre les traits du cycle de vie (compromis) et d’autres contraintes limitent l’évolution des traits du cycle de vie. Une fois que ces conditions ont été comprises et définies, les modèles d’histoire de vie peuvent être utilisés pour répondre à des questions telles que : Quelle taille doit atteindre un organisme ? À quel âge et à quelle taille doit-il atteindre la maturité ? Combien de fois doit-il se reproduire ? Combien de descendants doit-il produire et quelle doit être leur taille ? Pendant combien de temps doit-il se reproduire et combien de temps doit-il vivre ?
Les problèmes d’optimisation de l’histoire de vie sont généralement modélisés en utilisant l’équation d’Euler-Lotka, qui décrit le taux de croissance de la population (c’est-à-dire, fitness) d’un génotype clonal (ou d’une substitution d’allèle) en temps de génération continu en fonction de son âge à la maturité, de son âge à la dernière reproduction, de la probabilité de survie spécifique à l’âge et du nombre attendu de descendants spécifiques à l’âge (Stearns 1992, Roff, 1992, Brommer 2000) :
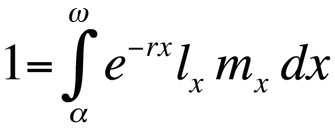
où α est l’âge à la première reproduction, ω l’âge à la dernière reproduction, lx la probabilité de survivre de la naissance à la classe d’âge x, mx le nombre attendu de descendants dans la classe d’âge x, et r le taux de croissance de la population ou paramètre malthusien. L’équation additionne les probabilités de survie et de reproduction sur l’ensemble de la durée de vie des individus de la population et peut ensuite être résolue pour r. Notez que dans le contexte de la théorie de l’histoire de vie, r mesure le taux de croissance ou l’aptitude d’un clone ou, chez les organismes à reproduction sexuée, le taux de propagation d’un allèle qui affecte l’histoire de vie. Ainsi, l’hypothèse implicite est que la population modélisée est constituée d’individus phénotypiquement et génétiquement identiques. Si la population décrite par l’équation d’Euler-Lotka est stationnaire (non croissante), r est nul et l’équation devient
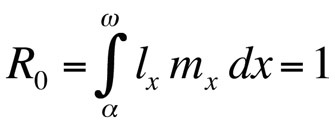
ou, si le temps de génération est discret,
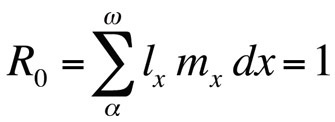
où R0 est le nombre attendu de filles par femelle et par vie (taux de reproduction net). Cette équation est plus simple que la version en temps continu et peut être utilisée chaque fois que r est nul ou proche de zéro ; pour les populations stables qui ne changent pas de taille, R0 est la mesure de fitness appropriée (Stearns 1992, Roff 1992, Brommer 2000). En utilisant ce cadre, on peut se demander quelle combinaison particulière de traits d’histoire de vie maximise la valeur adaptative, ou dans quelle mesure la valeur adaptative est affectée lorsque l’un des traits est modifié. Cette approche a été utilisée avec beaucoup de succès pour prédire l’évolution des traits d’histoire de vie.
Variation génétique pour les traits d’histoire de vie
L’évolution des traits d’histoire de vie par la sélection naturelle dépend de la variation génétique sur laquelle la sélection peut agir pour produire des adaptations en réponse à l’environnement. Les modèles mentionnés ci-dessus supposent implicitement que l’évolution du cycle biologique n’est pas limitée par un manque de variation génétique. Il est toutefois intéressant de noter que l’héritabilité (h2 = VA/VP = variance génétique additive divisée par la variance phénotypique), c’est-à-dire la proportion des différences phénotypiques entre les individus d’une population qui est expliquée par les différences génétiques additives entre eux, est généralement faible pour les traits du cycle biologique. Cette faible héritabilité pourrait être due à de faibles quantités de variance génétique additive ; pourtant, il existe une grande variation génétique pour les traits d’histoire de vie dans les populations naturelles et de laboratoire. Conformément à la notion selon laquelle les composantes de la valeur adaptative abritent une grande variation génétique, de nombreuses expériences de sélection artificielle en laboratoire ont réussi à provoquer des changements évolutifs dans les traits du cycle biologique dans la direction prévue (Stearns 1992, Roff 1992, Houle 2001). Une des raisons de la grande VA des traits d’histoire de vie peut être qu’il s’agit de traits très complexes, quantitatifs et polygéniques influencés par de nombreux loci (Houle 1992).
Mais comment concilier le fait que VA soit importante alors que dans le même temps h2 est faible ? Une raison probable de la faible héritabilité des traits d’histoire de vie est que, bien que VA (le numérateur) soit grand, VP (le dénominateur) est beaucoup plus grand que VA. Il convient de noter que la variance phénotypique VP est constituée de VA, la variance génétique additive, plus un reste, VR, qui est lui-même constitué de toutes les sources de variation génétique non additives (c’est-à-dire dues à la dominance, à l’épistasie, etc.) et de la variation phénotypique engendrée par l’environnement (c’est-à-dire la plasticité phénotypique, les interactions génotype/environnement ; voir ci-dessous). Ainsi, les traits d’histoire de vie ont probablement une faible héritabilité parce qu’ils sont influencés par de nombreux loci (ce qui gonfle à la fois VA et VP) tout en abritant des quantités substantielles de variation résiduelle VR, par exemple la variation due aux changements dans l’environnement (qui gonfle VP mais pas VA) (Houle 1992, Houle 2001).
En outre, bien que les traits d’histoire de vie soient soumis à une forte sélection, ce qui devrait épuiser la variance génétique, plusieurs facteurs peuvent maintenir la variation génétique pour ces traits, notamment l’équilibre mutation-sélection, l’hétérogénéité environnementale et les interactions génotype par environnement, ainsi que les corrélations génétiques négatives (Stearns 1992, Roff 1992, Houle 2001). Cependant, malgré des quantités généralement importantes de variation du cycle biologique, l’évolution du cycle biologique est également soumise à des contraintes.
Compromis d’histoire de vie et autres contraintes
L’aptitude serait évidemment maximale si la survie et la reproduction étaient maximales à tous les âges, stades ou tailles d’un organisme. En principe donc, le problème de base de l’évolution de l’histoire de vie est trivial : tous les traits de l’histoire de vie devraient toujours évoluer de manière à maximiser la survie et la reproduction et donc la fitness (Houle 2001). Cela conduirait très rapidement à l’évolution de « démons darwiniens » (Law 1979) qui domineraient le monde, c’est-à-dire des organismes qui commencent à se reproduire dès leur naissance, produisent un nombre infini de descendants et vivent éternellement. De tels organismes, cependant, n’existent pas dans le monde réel : Les ressources sont limitées, et les traits du cycle de vie sont soumis à des compromis intrinsèques et à d’autres types de contraintes, de sorte que la sélection naturelle ne peut pas maximiser les traits du cycle de vie – et donc la valeur adaptative – au-delà de certaines limites. Nous appelons ces limites des contraintes évolutives (Stearns 1992, Houle 2001) ; comme mentionné ci-dessus, elles représentent la » condition limite » intrinsèque que nous devons comprendre pour prédire l’évolution de l’histoire de vie.
L’un des types de contraintes les plus importants sont les compromis d’histoire de vie (Stearns 1992, Roff 1992, Flatt et Heyland 2011). Un trade-off existe lorsqu’une augmentation d’un trait d’histoire de vie (amélioration de la fitness) est couplée à une diminution d’un autre trait d’histoire de vie (réduction de la fitness), de sorte que le bénéfice de la fitness par l’augmentation du trait 1 est équilibré par un coût de la fitness par la diminution du trait 2 (figure 2A). (Notez que les compromis peuvent également impliquer plus de deux traits.) Au niveau génétique, on pense que ces compromis sont causés par des allèles ayant des effets pléiotropes antagonistes ou par un déséquilibre de liaison entre les loci.
Les compromis sont généralement décrits par des corrélations phénotypiques ou génétiques négatives entre les composantes de la fitness parmi les individus d’une population (Figure 2A). Si la relation est génétique, on prédit qu’une corrélation génétique négative limite (c’est-à-dire qu’elle ralentit ou empêche) l’évolution des traits impliqués. Ainsi, un compromis génétique existe dans une population lorsqu’un changement évolutif dans un trait qui augmente la valeur adaptative est lié à un changement évolutif dans un autre trait qui diminue la valeur adaptative. L’existence de corrélations génétiques peut être établie par des plans de sélection génétique quantitative ou par des réponses phénotypiques corrélées à la sélection. Par exemple, la sélection artificielle directe pour l’allongement de la durée de vie dans des populations de laboratoire génétiquement variables de drosophiles (Drosophila melanogaster) entraîne l’évolution d’une durée de vie adulte accrue (parfois en 10 générations ou moins), mais cette augmentation évolutive de la longévité est associée à une diminution de la reproduction précoce (par exemple, Zwaan et al. 1995). Cela suggère que la durée de vie et la reproduction précoce sont génétiquement couplées négativement, par exemple par le biais d’allèles pléiotropes antagonistes (par exemple, Flatt 2011, Fabian et Flatt 2011).
Au niveau physiologique, les compromis sont causés par l’allocation compétitive de ressources limitées à un trait d’histoire de vie par rapport à l’autre au sein d’un seul individu, par exemple lorsque les individus ayant un effort de reproduction plus élevé ont une durée de vie plus courte ou vice versa (Figure 2B). Une façon utile de penser aux compromis d’allocation des ressources est d’imaginer que le cycle biologique est une tarte finie, dont les différentes tranches représentent la façon dont un organisme répartit ses ressources entre la croissance, le stockage, l’entretien, la survie et la reproduction (Reznick 2010 ; Figure 2C). Le problème essentiel est le suivant : compte tenu des circonstances écologiques et du fait qu’agrandir une tranche signifie en réduire une autre, quelle est la meilleure façon de partager le gâteau ? Il convient de noter que, puisque les compromis en matière d’allocation des ressources peuvent avoir une base génétique et que différents génotypes peuvent différer dans certains aspects de l’allocation des ressources, les points de vue génétique et physiologique des compromis ne sont pas nécessairement incompatibles. Cependant, les compromis physiologiques au niveau individuel ne se traduisent pas toujours par des compromis génétiques (évolutionnaires) au niveau de la population. Par exemple, lorsque le compromis physiologique (au sein de l’individu) est génétiquement fixé ( » câblé « ) chez tous les individus de la population, tous les individus présenteront la même relation physiologique négative entre deux traits d’histoire de vie, mais la corrélation génétique entre les individus sera nulle (Stearns 1989, Stearns 1992).
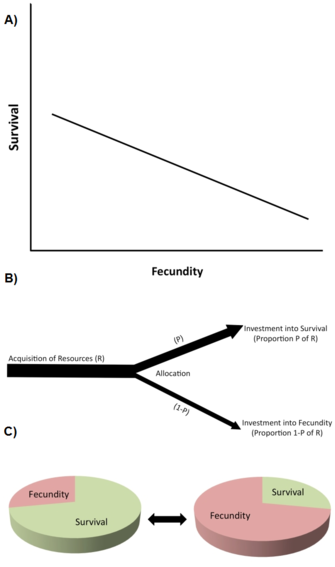
Le livre de Stearns (1992) énumère 45 compromis possibles entre 10 traits majeurs du cycle biologique, et on peut envisager qu’il en existe beaucoup plus. Les compromis qui ont reçu le plus d’attention comprennent (1) la reproduction actuelle par rapport à la survie ; (2) la reproduction actuelle par rapport à la reproduction future ; (3) la reproduction actuelle par rapport à la croissance parentale ; (4) la reproduction actuelle par rapport à la condition parentale ; et (5) le nombre par rapport à la taille de la progéniture.
Certaines des meilleures preuves de compromis d’histoire de vie fondés sur la génétique proviennent d’expériences de sélection artificielle et d’évolution expérimentale menées chez la drosophile (voir les revues de Stearns et Partridge 2001, Flatt et Schmidt 2009, Flatt 2011). En résumé, de nombreuses expériences ont trouvé : une corrélation négative entre la fécondité précoce et la durée de vie adulte ; une corrélation positive entre le temps de développement et la taille du corps ; une corrélation positive entre soit le temps de développement, soit la taille du corps avec la fécondité précoce ; et une corrélation négative entre la fécondité précoce et la fécondité tardive.
Les autres contraintes sur les histoires de vie qui empêchent la sélection naturelle d’atteindre un optimum de fitness particulier peuvent impliquer des facteurs biophysiques, biochimiques et structurels, des propriétés de développement de l’organisme, des contingences phylogénétiques et historiques, ou simplement un manque de variation génétique (Stearns 1992, Houle 2001).
Plasticité phénotypique des traits d’histoire de vie
La variation et les contraintes génétiques ne sont pas les seuls facteurs affectant l’expression et l’évolution des traits d’histoire de vie. Une autre question importante est que la variation du cycle biologique est souvent fortement influencée par l’environnement (par exemple, la température, la nutrition, les prédateurs,), un phénomène appelé plasticité phénotypique, c’est-à-dire la capacité d’un seul génotype (ou clone) à produire différents phénotypes dans différents environnements (Stearns 1992, Roff 1997, Pigliucci 2001, DeWitt et Scheiner 2004). La plasticité d’un génotype spécifique peut être décrite conceptuellement par une fonction mathématique appelée norme de réaction, c’est-à-dire une ligne ou une courbe qui relie les phénotypes produits par ce génotype aux changements de l’environnement qu’il subit (Figure 3A).
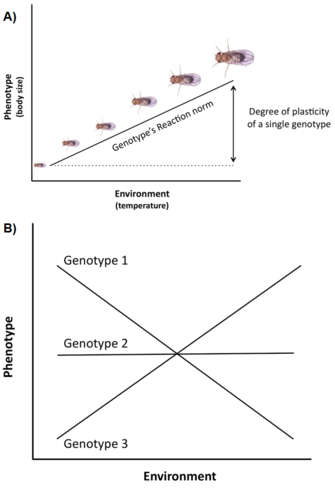
L’importance d’une telle plasticité dans l’évolution du cycle biologique est au moins triple (Stearns et Koella 1986, Stearns et al. 1991, Stearns 1992, Nylin et Gotthard 1998, DeWitt et Scheiner 2004, Flatt 2005) : (1) puisque la plasticité module l’expression phénotypique de la variation génétique pour des traits uniques d’histoire de vie et des corrélations génétiques pour des paires de traits, elle affecte la réponse génétique à la sélection à travers les environnements ; (2) s’il existe une variation adaptative parmi les génotypes pour la réponse plastique, la sélection peut produire une norme de réaction optimale qui maximise la fitness à travers les environnements ; et (3) la plasticité d’un trait spécifique peut tamponner homéostatiquement l’organisme contre les changements induits par l’environnement dans d’autres traits, de sorte que la performance de l’organisme et donc la fitness soient optimisées.
De nombreux traits d’histoire de vie (par ex, âge à la maturité, fécondité) présentent un haut degré de plasticité, et il existe souvent une variation génétique significative pour la plasticité dans les populations naturelles, c’est-à-dire que les génotypes ont des normes de réaction différentes, un phénomène appelé interaction génotype par environnement (GxE) (figure 3B). De plus, non seulement les traits uniques mais aussi les corrélations entre les traits peuvent être plastiques, et différents environnements peuvent changer la pente et/ou le signe de la corrélation entre les traits (Stearns et al. 1991, Stearns 1992). Chez les crapauds bêcheurs (Scaphiophus couchii), par exemple, les individus qui se développent dans des étangs de courte durée ont une période larvaire plus courte et une taille corporelle plus petite à la métamorphose (les traits étant corrélés négativement) que les individus qui se développent dans des étangs de longue durée (les traits étant corrélés positivement) (Newman 1988, Stearns et al. 1991).
Ayant discuté de l’approche de modélisation de l’optimalité et des facteurs qui influencent l’expression des traits d’histoire de vie, nous nous tournons maintenant vers la discussion de certaines prédictions majeures pour l’évolution des histoires de vie (pour plus de détails, voir Stearns 1992, Roff 1992, Charlesworth 1994, Stearns 2000, Roff 2002).
Prédictions pour l’évolution des traits d’histoire de vie
À quel âge et à quelle taille un organisme doit-il arriver à maturité ? Le succès reproductif d’un génotype dépend fortement de son taux de croissance et – conséquence de la croissance – de son âge et de sa taille à maturité. Pour prédire l’âge et la taille optimaux à la maturité, nous devons comprendre les coûts et les avantages relatifs (en termes de mortalité et de reproduction) d’une maturation précoce ou tardive et d’une croissance importante ou d’une petite taille. Les avantages d’une « stratégie » sont les coûts de l’autre, et vice versa. Les avantages d’une maturation précoce et d’une taille plus petite (c’est-à-dire les coûts d’une maturation tardive et d’une taille plus grande) sont les suivants (1) une probabilité plus élevée de survie jusqu’à la maturité en raison d’une durée plus courte de la période de développement et de la période juvénile à risque, et (2) un temps de génération plus court qui permet aux parents de produire une progéniture qui naît plus tôt et qui commence à se reproduire plus tôt. Ainsi, une mortalité juvénile élevée, par exemple, devrait favoriser l’évolution vers une maturité plus précoce. Inversement, les avantages d’une maturité plus tardive et d’une plus grande taille (c’est-à-dire les coûts d’une maturité plus précoce et d’une plus petite taille) comprennent : (1) une croissance plus longue qui conduit à une plus grande taille à maturité et donc à une fécondité accrue (puisque la fécondité augmente souvent avec la taille), (2) une mortalité adulte plus faible (et donc une fécondité à vie potentiellement plus élevée) en raison d’une plus grande taille (la mortalité due aux prédateurs est souvent plus faible pour les grands individus), et (3) une progéniture de meilleure qualité (par exemple, un investissement accru par progéniture, de meilleurs soins parentaux) qui améliore la survie de la progéniture produite.
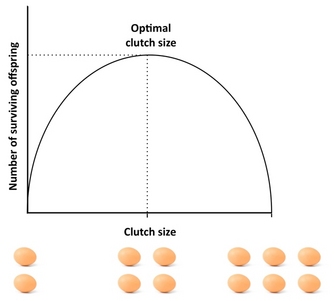
Combien de descendants un organisme devrait-il produire ? Un bon point de départ pour aborder cette question est la « ponte de Lack », un concept qui remonte à l’ornithologue David Lack (1947). L’idée de base de Lack était que les oiseaux devaient optimiser la taille de leur ponte en maximisant le nombre de descendants à l’envol (survivants). Les écarts par rapport à la taille optimale de la ponte réduisent le succès de la reproduction : si les parents produisent une ponte trop importante, ils risquent de ne pas être en mesure de subvenir aux besoins de tous leurs descendants et de les élever, certains d’entre eux ou tous mourant, tandis que s’ils produisent une ponte trop petite, le nombre de descendants à l’envol peut être inférieur à ce que les parents peuvent supporter (figure 4). Bien que Lack ait eu raison d’affirmer que la fitness est souvent maximisée lors d’un investissement intermédiaire, la taille des pontes est généralement plus petite que ce que prédit le concept de Lack. Cela est dû au fait que ce concept ignore plusieurs facteurs qui peuvent réduire la taille de la ponte, notamment la mortalité parentale, la reproduction future, le taux de production de petits-enfants et les conflits entre parents et progéniture. Par exemple, l’existence de compromis entre la reproduction actuelle et la survie des parents, la reproduction actuelle et future, ou le nombre et la taille de la progéniture peut entraîner des déviations par rapport à la ponte de Lack, et les modèles qui tiennent compte de ces facteurs donnent généralement une meilleure correspondance avec la taille observée de la ponte que la ponte de Lack. Pour une excellente étude empirique de la taille optimale de la ponte, voir l’étude de Daan et al. (1990) sur les crécerelles européennes.
À quelle fréquence un organisme doit-il se reproduire ? Doit-il être semelpares (c’est-à-dire se reproduire une seule fois) ou itéropares (c’est-à-dire se reproduire plusieurs fois) (figure 5 ; voir aussi Young 2010) ? La théorie suggère que l’itéroparité et l’évolution d’une durée de vie reproductive accrue sont favorisées lorsque la survie des adultes est élevée et lorsque la fécondité des adultes ou la survie des juvéniles est faible : une survie élevée (ou non variable) des adultes augmente le nombre d’événements reproductifs par vie, et une fécondité ou une survie des juvéniles faible (ou variable) entraîne des pertes de fitness qui sélectionnent un effort reproductif compensatoire accru. Inversement, la semelparité et l’évolution d’une durée de vie reproductive réduite sont favorisées lorsque la survie des adultes est faible et la survie des juvéniles élevée. Ainsi, une survie élevée (ou non variable) des adultes par rapport aux juvéniles favorise l’itéroparité et allonge la durée de vie reproductive, tandis qu’une mortalité élevée (ou variable) des adultes par rapport aux juvéniles favorise la semelparité et raccourcit la durée de vie reproductive. Les organismes sémelpares ont typiquement un effort reproductif plus élevé que les organismes itéropares.

Les considérations ci-dessus sont des aspects d’une question plus générale appelée » problème général d’histoire de vie » ou » modèle d’effort de reproduction » (Schaffer 1983, Stearns 1992, Roff 1992, Charlesworth 1994) : étant donné que la reproduction présente à la fois des avantages (ex, production de la progéniture) et des coûts (par exemple, diminution de la reproduction future, augmentation de la mortalité des parents ou de la progéniture), quel est l’investissement reproductif optimal qui maximise la valeur adaptative ? De nombreuses études théoriques et empiriques ont abordé ce problème ; certaines des principales conclusions de ces travaux sont (voir Stearns 1992, Roff 1992, Charlesworth 1994) : (1) l’effort de reproduction augmente souvent, mais pas toujours, avec l’âge parce que le coût de la reproduction actuelle en termes de reproduction future est censé diminuer avec l’âge (puisque le nombre d’événements reproductifs futurs où les coûts peuvent se manifester diminue avec l’âge) ; (2) si l’effort de reproduction produit des rendements décroissants ou si la mortalité augmente à mesure que l’effort augmente, l’investissement reproductif intermédiaire et l’itéroparité sont favorisés ; Dans le cas contraire, l’effort de reproduction maximal et la semelparité sont favorisés ; (3) si la mortalité augmente dans toutes les classes d’âge, l’effort de reproduction augmente au début de la vie et l’âge à la maturité diminue ; de même, si la mortalité adulte augmente, l’âge à la maturité devrait diminuer ; et (4) si la mortalité augmente après un âge particulier (ou dans une classe d’âge spécifique), l’effort de reproduction augmente avant et diminue après cet âge. Comme tests particulièrement beaux de tels modèles d’effort de reproduction, nous renvoyons le lecteur aux expériences de terrain et de laboratoire de David Reznick et de ses collègues sur des guppies de Trinidad (par exemple, Reznick et al. 1990).
Combien de temps un organisme doit-il vivre (voir aussi Fabian et Flatt 2011) ? L’évolution de la durée de vie peut être considérée comme un équilibre entre la sélection pour une augmentation de la durée de vie reproductive (et donc potentiellement une augmentation du succès reproductif) et le vieillissement (c’est-à-dire l’augmentation intrinsèque de la mortalité en fonction de l’âge). Les avantages de l’évolution d’une durée de vie reproductive plus longue incluent (voir aussi ci-dessus) : (1) un nombre plus élevé d’événements reproductifs (et donc de progénitures) par vie si la mortalité extrinsèque des adultes est faible, (2) un temps suffisant pour compenser, sur le plan reproductif, les progénitures perdues en raison d’une mortalité juvénile élevée, et (3) une diminution de l’incertitude reproductive due à une forte variation de la mortalité juvénile d’un cycle de reproduction à l’autre, là encore en étant capable de compenser les progénitures perdues. Ces effets sont contrecarrés par ceux qui augmentent la mortalité des adultes (par exemple, les coûts de survie de la reproduction ; le vieillissement) par rapport à la mortalité juvénile. Ainsi, l’augmentation de la moyenne (et/ou de la variance) de la mortalité adulte par rapport à la mortalité juvénile tend à favoriser une durée de vie reproductive plus courte et la semelparité, tandis que la diminution de la moyenne (et/ou de la variance) de la mortalité adulte par rapport à la mortalité juvénile tend à favoriser une durée de vie reproductive plus longue et l’itéroparité.
Aujourd’hui, beaucoup de ces prédictions de la théorie de l’histoire de vie sont bien étayées par des preuves ; nous terminerons cet article en donnant un exemple d’une expérience particulièrement élégante qui a confirmé les principales prédictions du « problème général de l’histoire de vie ».
Un exemple de test empirique de la théorie
Pour tester les principes de base de la théorie de l’histoire de vie, Stearns et al. (2000) ont utilisé une population consanguine de mouches à fruits (D. melanogaster) pour établir deux ensembles de lignées répliquées » d’évolution expérimentale » : trois lignées ont été exposées à un traitement de forte mortalité adulte (HAM ; en tuant aléatoirement 90 % des mouches deux fois par semaine) et trois lignées à un traitement de faible mortalité adulte (LAM ; en tuant 10 % des mouches deux fois par semaine). Après quatre ans d’évolution expérimentale dans ces conditions en laboratoire, Stearns et ses collaborateurs ont mesuré les phénotypes du cycle de vie de toutes les lignées dans les deux traitements afin d’examiner les réponses évolutives des mouches à une mortalité extrinsèque élevée ou faible. Les résultats de cette expérience à long terme ont été à la fois clairs et intrigants, confirmant les prédictions théoriques : les mouches à fruits qui ont évolué dans des conditions de MAM se sont développées plus rapidement à l’état larvaire, se sont refermées plus tôt et à une plus petite taille à l’âge adulte, ont eu un pic de fécondité précoce plus élevé et ont présenté une durée de vie plus courte que les mouches MAM qui ont évolué dans la série d’adaptations opposées. En d’autres termes, les mouches évoluant dans un environnement très dangereux ont réagi sur le plan évolutif en accélérant leur développement, en réduisant leur âge et leur taille à maturité, en pondant plus d’œufs plus tôt et en vivant moins longtemps : elles se sont adaptées à des niveaux élevés de mortalité aléatoire en déplaçant leur effort de reproduction vers des âges plus précoces et en comprimant toute leur histoire de vie en une durée de vie plus courte. Ainsi, à l’instar des conclusions de Reznick et al. (1990) chez les guppies, ces résultats confirment les principales prédictions de la théorie de l’histoire de vie, en particulier le rôle majeur de la mortalité extrinsèque des adultes dans le façonnement de l’évolution de la croissance, de la maturation, de la reproduction et du vieillissement.
Résumé
Nous avons présenté ici les bases de la théorie de l’histoire de vie. La théorie de l’histoire de vie tente de comprendre comment la sélection naturelle conçoit les organismes pour atteindre le succès reproductif, étant donné la connaissance de la façon dont les facteurs sélectifs de l’environnement (c’est-à-dire la mortalité extrinsèque) et les facteurs intrinsèques à l’organisme (c’est-à-dire les compromis, les contraintes) affectent la survie et la reproduction. En utilisant une variété de méthodes théoriques et empiriques, et en particulier en appliquant la théorie de l’optimalité, les théoriciens de l’histoire de vie ont dérivé des prédictions majeures sur l’évolution des principaux traits de l’histoire de vie, y compris l’âge et la taille à maturité, le nombre et la taille de la progéniture, l’effort de reproduction spécifique à l’âge ou à la taille, la durée de vie reproductive et le vieillissement. Sur la base de ces prédictions, et en les testant dans des expériences de terrain et de laboratoire, par exemple chez les mouches, les poissons ou les oiseaux, les biologistes de l’histoire de vie nous ont fourni des réponses convaincantes à des questions fondamentales telles que : A quelle vitesse un organisme doit-il se développer ? À quel âge et à quelle taille doit-il atteindre la maturité ? Combien de descendants doit-il avoir et quelle doit être leur taille ? Doit-il se reproduire une ou plusieurs fois ? Et combien de temps doit-il vivre ? En abordant ces problèmes, la théorie de l’histoire de la vie a eu un impact majeur sur notre compréhension de l’adaptation par sélection naturelle, la question la plus fondamentale de toute la biologie évolutive.