Calcul des charges formelles
La charge formelle d’un atome dans une molécule est la charge hypothétique que l’atome aurait si nous pouvions redistribuer les électrons des liaisons de manière égale entre les atomes. Une autre façon de le dire est que la charge formelle résulte lorsque nous prenons le nombre d’électrons de valence d’un atome neutre, que nous soustrayons les électrons non liants, puis que nous soustrayons le nombre de liaisons reliées à cet atome dans la structure de Lewis.
On calcule donc la charge formelle comme suit :
Charge formelle = (électrons de valence de l’élément « libre ») – (électrons non partagés) – (liaisons).
On peut revérifier les calculs de charge formelle en déterminant la somme des charges formelles de toute la structure. La somme des charges formelles de tous les atomes d’une molécule doit être nulle ; la somme des charges formelles d’un ion doit être égale à la charge de l’ion.
Nous devons nous rappeler que la charge formelle calculée pour un atome n’est pas la charge réelle de l’atome dans la molécule. La charge formelle n’est qu’une procédure comptable utile ; elle n’indique pas la présence de charges réelles.
Calcul de la charge formelle à partir des structures de Lewis
Assignez des charges formelles à chaque atome de l’ion interhalogène \(\ce{ICl4-}\).
Solution
Nous divisons les paires d’électrons de liaison de manière égale pour toutes les liaisons \(\ce{I-Cl}\):
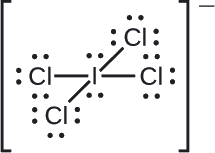
Nous attribuons des paires d’électrons solitaires à leurs atomes. Chaque atome de Cl se voit maintenant attribuer sept électrons, et l’atome de I en a huit.
Soustraire ce nombre du nombre d’électrons de valence de l’atome neutre :
- I : 7 – 8 = -1
- Cl : 7 – 7 = 0
La somme des charges formelles de tous les atomes est égale à -1, ce qui est identique à la charge de l’ion (-1).
Exercice \(\PageIndex{1}\)
Calculez la charge formelle de chaque atome de la molécule de monoxyde de carbone :

Réponse
C -1, O +1
Calcul de la charge formelle à partir des structures de Lewis
Attribuez des charges formelles à chaque atome de la molécule d’interhalogène \(\ce{BrCl3}\).
Solution
Attribuer un des électrons de chaque liaison Br-Cl à l’atome de Br et un à l’atome de Cl de cette liaison :
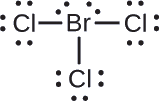
Attribuer les paires solitaires à leur atome. Maintenant, chaque atome de Cl a sept électrons et l’atome de Br a sept électrons.
Soustrayez ce nombre du nombre d’électrons de valence de l’atome neutre. Cela donne la charge formelle :
- Br : 7 – 7 = 0
- Cl : 7 – 7 = 0
Tous les atomes de \(\ce{BrCl3}\) ont une charge formelle de zéro, et la somme des charges formelles totalise zéro, comme il se doit dans une molécule neutre.
Exercice \(\PageIndex{2}\)
Déterminer la charge formelle de chaque atome dans \(\ce{NCl3}\).
Réponse
N : 0 ; les trois atomes de Cl : 0
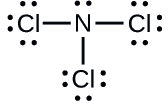
.