Le nitrate de magnésium représenté par la formule chimique Mg(NO3)2 ou MgN2O6 qui porte le nom IUPAC dinitrate de magnésium est une poudre hygroscopique cristalline blanche qui est soluble dans l’eau et l’alcool . C’est un sel de magnésium et il contient des liaisons chimiques qui sont de nature ionique .

Nitrate de magnésium
Identification du nitrate de magnésium |
|
| Numéro CAS | 10377-60-3 |
| PubChem CID | 25212 |
| ChemSpider ID | 23415 |
| Numéro CE | 233-826-7 |
Composition et synthèse
Le nitrate de magnésium peut être préparé en combinant du sulfate de magnésium avec du nitrate de calcium .
MgSO4 + Ca(NO3)2 = Mg(NO3)2 + CaSO4
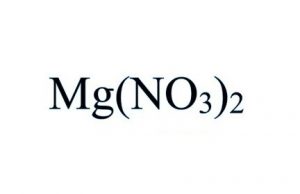
Formule du nitrate de magnésium
Propriétés et caractéristiques du magnésium. magnésium
Propriétés Générales Propriétés |
|||
| Masse molaire/poids moléculaire | 148.313 g/mol |
Propriétés physiques |
|
| Couleur/apparence | Cristaux blancs | Point de fusion/congélation | 89°C, 192.2°F | Point d’ébullition | 330°C, 626°F | Densité | 1.46 g cm-3 |
| État de la matière à température ambiante (phase normale) | Solide | ||
Chemical Propriétés |
|||
| Solubilité dans l’eau | 42 g/100 ml (à 20oC) | ||
| pH | 5-7 (acide) | ||
Propriétés atomiques |
|||
| Structure cristalline | . structure | Cubique | |
Structure du nitrate de magnésium
Réactions marquantes de Mg(NO3)2
Une réaction chimique entre le nitrate de magnésium et le carbonate de sodium produit du carbonate de magnésium et du nitrate de sodium .
Mg(NO3)2 + Na2CO3 = MgCO3 + 2NaNO3
Le nitrate de magnésium se décompose dans l’eau en formant de l’hydroxyde de magnésium, de l’ammoniac et de l’oxygène .
Mg(NO3)2 + 4H2O = Mg(OH)2 + 2NH3 + 4O2
En chauffant le Mg(NO3)2, il se décompose en oxyde de magnésium, dioxyde d’azote et oxygène .
2Mg(NO3)2 = 2MgO + 4NO2 + O2
Il réagit avec l’hydroxyde de sodium pour donner de l’hydroxyde de magnésium et du nitrate de sodium .
Mg(NO3)2 + 2NaOH = Mg(OH)2 + 2NaNO3
Utilisations du nitrate de magnésium
- Comme source sûre d’ions nitrate .
- Dans la production d’engrais azotés .
- Dans la pyrotechnie et la fabrication d’acide nitrique concentré .
- Aide au prilling et à l’enrobage pour la production de nitrate d’ammonium et constitue un ingrédient des cosmétiques et des shampooings .
Est-il dangereux
Etant un oxydant puissant, il peut présenter un risque d’incendie. Il peut également provoquer un risque d’explosion lorsqu’il est mis en contact avec des substances organiques. Le contact avec les yeux, la peau et l’inhalation doit être évité car il entraîne une irritation, une toux et un essoufflement. L’ingestion de grandes quantités entraîne des douleurs abdominales, des vertiges, une diarrhée sanglante, des vomissements, des convulsions, une faiblesse et un effondrement .
- Nitrate de magnésium – Pubchem.ncbi.nlm.nih.gov
- Nitrate de magnésium – Chemspider.com
- Nitrate de magnésium – Americanelements.com
- Nitrate de magnésium – Sciencemadness.org
- Nitrate de magnésium hexahydraté – Sigmaaldrich.com
- Nitrate de magnésium – Chemicalbook.com
- Question : Nitrate de magnésium et carbonate de sodium Mg(NO_3)_2 + Na_2 – Chegg.com
- Comment détermine-t-on l’équation équilibrée du nitrate de magnésium plus eau ? – Quora.com
- La décomposition thermique du nitrate de magnésium – Chemiday.com
- Question : L’hydroxyde de sodium réagit avec le nitrate de magnésium pour former de l’hydroxyde de magnésium – Chegg.com
.