Introduction
Les maladies auto-immunes représentent une grande variété de problèmes cliniques affectant de multiples organes et systèmes, et touchent au moins 5 % de la population1. Une grande diversité d’anticorps a été associée à différentes manifestations cliniques et les cliniciens se sont appuyés sur eux pour guider le diagnostic clinique, les implications pronostiques et, dans certains cas, les décisions thérapeutiques2,3. Les connaissances actuelles sur la pathogenèse des maladies auto-immunes s’accordent sur le fait qu’une interaction complexe de gènes et de caractéristiques environnementales est nécessaire à leur apparition.4
La combinaison du test ENA immunoblot en ligne (INNOLIA-ANA) et des techniques d’immunofluorescence indirecte pour détecter les anticorps antinucléaires sur des cellules HEp-2 comme substrat sont de bonnes méthodes de dépistage chez les patients ayant une suspicion clinique de maladie auto-immune, principalement le lupus érythémateux systémique (LES) et le syndrome de Sjögren (SS). Bien que des résultats faussement positifs puissent se produire, des titres >1:80 suggèrent la possibilité d’un trouble auto-immun et doivent inciter à commander des évaluations plus spécifiques pour déterminer les réactivités spécifiques des anticorps antinucléaires (ANA) tels que l’ADN anti-double brin et les antigènes nucléaires extractibles (ENA).5
Ro/SSA et La/SSB sont des complexes antigéniques hétérogènes formés par trois protéines différentes (Ro-52, Ro-60 et La) et quatre particules d’ARNY. La protéine Ro60 agit comme un point de contrôle de qualité pour les ARN mal repliés avec des chaperons moléculaires pour les ARN défectueux. Les ARN mal repliés sont reconnus et ensuite marqués par Ro60 pour être dégradés. Ro52 interagit avec différentes molécules, parmi lesquelles la calréticuline et la protéine de liaison à la chaîne lourde des immunoglobulines. On pense que Ro52 modifie le rôle ou la stabilité de ses substrats par ubiquitination, et que cette modification pourrait entraîner des événements biologiques médiés par Ro52.6
Des anticorps anti-Ro/SSA et anti-La/SSB ont été décrits dans diverses maladies auto-immunes. Dans le syndrome de Sjögren primaire (SSP), des anticorps circulants sont détectés chez environ 60 à 70 % des patients, et des niveaux plus élevés ont été associés à un début précoce de la maladie et à des manifestations systémiques.7,8 Le groupe d’étude GEMESS, qui comprenait 12 centres de référence en Espagne, a confirmé ces caractéristiques cliniques et de laboratoire dans une cohorte de patients atteints de SSP, et a observé des niveaux réduits de C4 chez les patients présentant un début précoce de la maladie9.
Les anti-Ro/SSA sont détectés chez 30 % des patients ayant reçu un diagnostic de SLE, en particulier (90 %) les sous-types à début tardif, le lupus érythémateux cutané subaigu, le lupus induit par les médicaments et les déficiences congénitales de C2, C4 et C1q, également chez les patients présentant un syndrome de chevauchement SS/SLE et une maladie indifférenciée du tissu conjonctif10. En revanche, l’anti-La/SSB est plus souvent associé au SS,11 et fortement corrélé, chez les anti-La/SSB positifs et les anti-Ro/SSA négatifs, au dysfonctionnement des organes (reins, poumons, foie).12
Depuis les années 80, le développement d’un blocage cardiaque congénital a été décrit dans les maladies auto-immunes, telles que le SS et le SLE. Cependant, l’atteinte cardiaque est davantage liée aux anticorps circulants de la mère qu’au diagnostic de maladie auto-immune. Bien que le profil immunitaire soit variable selon les études, l’anticorps anti-Ro52 est plus fréquent chez les mères d’enfants présentant un bloc cardiaque congénital, un lupus néonatal et des nouveau-nés présentant un QT prolongé sans bloc cardiaque congénital.10,13,14
La prévalence et les associations cliniques des anticorps anti-Ro/SSA et anti-La/SSB peuvent varier selon les groupes ethniques. En plus des études menées dans la population espagnole sur l’expression immunitaire du SS, d’autres études ont été développées ces dernières années sur le profil immunitaire des patients présentant des anticorps anti-Ro52, anti-Ro60 et anti-La. La plupart d’entre elles ont été réalisées sur des diagnostics spécifiques de troubles du tissu conjonctif. Dans une cohorte de patients atteints de SSP développée en Corée, des associations de ces anticorps avec différentes manifestations cliniques ont été observées. L’anticorps anti-Ro52 était l’autoanticorps le plus fréquent et était associé à des lésions hépatiques et musculaires.15 Une étude récente menée dans la population mexicaine afin de déterminer la prévalence du SSP dans le cadre d’un LED à début récent a montré que la présence de l’anticorps anti-Ro/SSA était un facteur prédictif de chevauchement, tandis que l’absence de l’anticorps anti-Ro/SSA, de l’anticorps anti-La/SSB et du facteur rhumatoïde était liée au risque le plus faible de chevauchement.16 Enfin, l’hôpital universitaire de Gand a proposé une étude visant à déterminer la distribution diagnostique associée au sérotype de l’anti-Ro/SSA ou de l’anti-La/SSB chez des patients consécutifs adressés au laboratoire de rhumatologie. Le LES était associé aux anti-Ro60 positifs et les anti-La isolés prédisposaient davantage au SSP.17
Nous avons entrepris cette étude pour évaluer les associations cliniques, de laboratoire et de diagnostic de cet important sous-ensemble d’anticorps dans un hôpital en Espagne.
MéthodesCentre de recherche
L’hôpital de Jerez de la Frontera est un centre régional spécialisé situé dans le sud-ouest de l’Espagne. Il fournit des services cliniques spécialisés et compte 550 lits. Son service d’immunologie analyse environ 5800 tests ANA et 1700 tests ENA immunoblot par an dans une population de 450 000 habitants. Parmi le personnel de son laboratoire, on trouve un biologiste et un immunologiste qui effectuent des tests spécialisés pour différents départements. Tout clinicien pratiquant peut demander des tests d’anticorps antinucléaires mais ils sont principalement demandés par les rhumatologues, suivis par les médecins de soins primaires, les gastro-entérologues, les internistes, les néphrologues, les pneumologues et les hématologues.
Échantillons
Un registre informatisé des résultats de laboratoire est disponible depuis juin 2002. Nous avons analysé rétrospectivement tous les échantillons consécutifs commandant un test ANA de juin 2002 à décembre 2012. Les sérums présentant un titre d’au moins 1:160 par test d’immunofluorescence sur cellules HEp-2 (Euroimmun, Allemagne) ont été considérés comme positifs et réalisés par un seul observateur formé. Les sérums présentant un test ANA positif pour cette dilution de titre ont été analysés à l’aide d’un test ENA en ligne disponible dans le commerce (INNO-LIA ANA, Fujirebio, Japon). Ce kit fournit un test qualitatif in vitro pour les auto-anticorps humains de la classe IgG contre 13 antigènes différents : RNP-70, RNP-A, RNP-C, Ro-52, Ro-60, La/SSB, Scl-70, CENP-B, histones, Jo-1, Sm, protéine ribosomale P et complexe U1-nRNP dans le sérum ou le plasma. La sensibilité et la spécificité globales de la détection des auto-anticorps par LIA étaient similaires ou supérieures à celles des techniques conventionnelles combinées.18,19 Cet immunoblot a une spécificité de 99,6 % pour l’anti-La, alors que l’anti-Ro60 a une spécificité de 98,2 % et l’anti-Ro52 de 98,3 %.20
En outre, le système informatique nous permet de détecter dans le dosage immunologique les anti-Ro et/ou les anti-La positifs avec un test ANA négatif, car chez les patients ayant une forte suspicion clinique d’une maladie auto-immune, le dosage immunoblot ENA a été réalisé malgré un test ANA négatif. Enfin, seuls les patients ayant plus d’un échantillon de sérum positif pour l’anti-Ro/SSA ou l’anti-La/SSB ont été inclus dans l’étude.
Les données cliniques et de laboratoire ont été obtenues soit par deux observateurs formés en examinant les dossiers cliniques, soit par une base de données de laboratoire informatisée.
Variables
Les variables indépendantes comprenaient les données démographiques (âge, sexe), cliniques (diagnostic, caractéristiques de la maladie), de laboratoire (hémoglobine, numération leucocytaire et plaquettaire, taux d’hormones thyroïdiennes) ou immunologiques (taux de complément, hypergammaglobulinémie, facteur rhumatoïde).
Analyse statistique
Les statistiques descriptives ont été utilisées avec les fréquences et les pourcentages pour les variables qualitatives et la moyenne, l’écart-type et l’étendue pour les variables quantitatives. Les associations cliniques entre les différents ensembles de combinaisons positives par rapport aux variables cliniques ou de laboratoire ont été analysées par des tableaux de contingence en utilisant le test du chi carré ou le test exact de Fisher. Dans tous les cas, le niveau alpha a été fixé à 0,01 comme ajustement pour les comparaisons multiples. La force de l’association est présentée sous forme d’odds ratio et de ses intervalles de confiance à 99 %. Nous avons effectué l’analyse en grappes des variables en utilisant le lien moyen entre les groupes, et en utilisant comme mesure d’intervalle, la distance euclidienne au carré. Les analyses ont été effectuées à l’aide de SPSS 16.0 (SPSS Inc., Chicago, IL).
Résultats
Un total de 41 102 échantillons de sérum ont été envoyés au département d’immunologie pour la détection des ANA. 12 124 échantillons étaient positifs chez 2 970 patients. 322 patients ayant plus d’un échantillon de sérum positif pour les anticorps anti-Ro52 et/ou anti-Ro60 et/ou anti-La avec un titre de dilution >160 ont été inclus. Les femmes représentaient 90,4% de l’échantillon. Elles avaient un âge compris entre 10 et 84 ans, une moyenne de 44,4 ans et un écart-type de 15,7 ans. Certains sérums isolés étaient positifs pour le test immunoblot ENA avec un test ANA négatif. Mais les 322 patients ont montré que tous ou la plupart de leurs sérums étaient positifs pour le test ANA, et le profil des sérums pour chaque patient était pratiquement identique. Aucun patient n’a été trouvé dans notre étude avec plus d’un test de sérum négatif pour l’IIF.
Les principales données cliniques et de laboratoire des patients avec des échantillons positifs pour l’anti-Ro52 et/ou l’anti-Ro60 et/ou l’anti-La (322 cas) sont présentées dans le tableau 1. Les spécificités des différents antigènes de ces patients sont représentées dans le tableau 2. Nous pouvons voir que le résultat positif le plus fréquent était l’anti-Ro52 chez 269 patients (83,5%), suivi par 205 patients avec l’anti-Ro60 (63,7%) et 155 avec l’anti-La (48,1%).
Le tableau 3 montre différentes associations entre les combinaisons d’anticorps anti-Ro52/anti-Ro60/anti-La et le diagnostic, les résultats cliniques ou de laboratoire. Le tableau 4 montre des associations significatives de test positif pour la présence d’anticorps circulants anti-Ro52, anti-Ro60 et anti-La. Un niveau de signification strict ayant été sélectionné, certaines associations intéressantes n’ont pas été présentées, telles que le groupe anti-Ro52+ avec motif cytoplasmique (OR 3,72, IC à 99 % : 0,9-16, valeur p : 0,04) et le groupe anti-Ro60+ avec lupus cutané subaigu (SCLE) (OR 7,0, IC à 99 % : 0,9-55,3, p : 0,023).
En utilisant l’analyse par grappes, quatre groupes d’auto-anticorps peuvent être identifiés. Le cluster 1 comprend les anticorps contre SmB, SmD, RNP,70, RNP-A et RNP-C. Le cluster 2 est formé pour les anticorps contre Scl-70, Ribosomal P, Jo1 et centromère. Le cluster 3 est formé pour les anticorps contre Ro60 et SSB. Le cluster 4 est constitué d’anticorps contre Ro52 (figure 1).
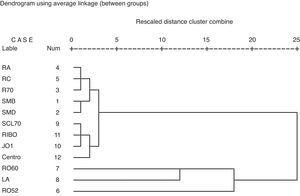
Analyse de cluster pour identifier le cluster d’anticorps dans notre échantillon de patients.
Discussion
Les rhumatologues ont établi l’importance des résultats cliniques et sérologiques dans la classification de nombreuses maladies auto-immunes. Certaines préoccupations ont été publiées sur l’importance de l’évaluation critique des tests spécialisés dans les soins cliniques. Il semble que la commande de nombreux tests pourrait produire des résultats de laboratoire multiples qui doivent être soigneusement évalués dans le contexte des résultats cliniques.17,21
Dans notre étude, nous décrivons les associations cliniques, diagnostiques et immunologiques avec toutes les combinaisons possibles d’anticorps anti-Ro52, anti-Ro60 et anti-La, trouvées dans une grande cohorte de patients d’un seul centre en Espagne pendant 10 ans. Au total, 322 patients présentaient plus d’une positivité pour ces anticorps, et les maladies les plus répandues étaient le SLE et le SSP, principalement associés au profil immunologique anti-Ro52+/anti-Ro60+/anti-La- et anti-Ro52+/anti-Ro60+/anti-La+, respectivement.
Notre définition stricte de la signification statistique pourrait faire que certaines associations soient perdues, mais nous sommes convaincus que les associations décrites pourraient être plus robustes. La pertinence clinique et pratique de ces associations pourrait être particulièrement intéressante pour les anti-Ro52 isolés (anti-Ro52+/anti-Ro60-/anti-La-). Ce sous-ensemble d’auto-anticorps présente des associations cliniques et immunologiques indépendantes, données confirmées par notre analyse en grappes.22,23 Un anticorps anti-Ro52 isolé positif était associé à la sclérose systémique, en particulier chez les personnes atteintes du syndrome de CREST, et à la dermatomyosite (OR 11,65, IC à 99 % : 1,28-105,79, p : 0,018). D’autres associations ont été observées principalement avec certains résultats de laboratoire tels que l’anti-Jo-1 (OR 3,45, IC à 99 % : 1,12-10,59, p : 0,03), l’anti-centromère (OR 2,66, IC à 99 % : 1,04-2,80, p : 0,03) ou des profils d’immunofluorescence particuliers tels que le profil centromérique, cytoplasmique et nucléolaire. De plus, en comparant le groupe positif isolé anti-Ro52+ (anti-Ro52+/anti-Ro60-/anti-La-) avec la triple réactivité positive (anti-Ro52+/anti-Ro60+/anti-La+), les associations cliniques, de laboratoire et de diagnostic trouvées dans un groupe étaient inverses dans l’autre. Ainsi, le sous-ensemble immunologique anti-Ro52+/anti-Ro60+/anti-La+ a été associé positivement à la xérostomie et au motif à fines mouchetures et négativement à la sclérose systémique (OR 0,22, 99% CI : 0,05-1,00, p : 0,026). Ceci met en évidence la valeur clinique diagnostique de la combinaison. En ce qui concerne le résultat positif du groupe d’anti-Ro60+, principalement associé à l’anti-La- (anti-Ro52+/anti-Ro60+/anti-La- et anti-Ro52-/anti-Ro60+/anti-La-), était très indicatif pour le LES.
Nos résultats sont similaires à ceux rapportés précédemment6,22.-25 La présence d’anticorps circulants anti-Ro52, anti-Ro60 et anti-La positifs prédisposait à la xérostomie et à la xérophtalmie (xérostomie chez les anti-Ro60 OR 1,75, IC 99% : 1,10-2,79, p : 0,012). Ces données cliniques sont corroborées par de nombreuses études sur le SSP.6-9,11,17,24 Un anti-Ro52 positif avec un anti-Ro60 et un anti-La négatifs ont montré une association négative avec la photosensibilité, cependant, dans des études précédentes, les patients avec un anti-Ro52+ avaient une fréquence plus élevée d’atteinte cutanée.17,26 En outre, cette combinaison immunologique (anti-Ro52+/anti-Ro60-/anti-La-) était également inversement associée à la xérostomie et à la xérophtalmie. Cependant, dans des études antérieures, les anticorps anti-Ro52 positifs isolés étaient étroitement liés aux principales caractéristiques cliniques, histopathologiques et immunologiques du SSP.27 Les anticorps anti-Ro60 positifs isolés ou les anticorps anti-Ro60+ combinés aux anticorps anti-Ro52+ augmentaient la probabilité de SLE ou de chevauchement SLE/SS, comme décrit dans plusieurs travaux,11,17,28 mais, dans notre cohorte, ils étaient également fortement associés aux ulcères buccaux et à l’arthrite. La réactivité anti-La était fortement associée au SSP et à ses principales manifestations cliniques (xérostomie et xérophtalmie), comme dans de nombreuses autres études menées dans différentes populations.11,17,26
La plupart des études précédentes sur l’utilité de ces anticorps ont été réalisées sur des échantillons de patients atteints d’une maladie auto-immune diagnostiquée, en particulier le LED et le SS. Cependant, peu d’études ont été réalisées pour décrire l’association diagnostique des anticorps anti-Ro et anti-La identifiés dans un échantillon consécutif.17
En plus du diagnostic, nous avons déterminé l’utilité des profils immunologiques avec l’anti-Ro52 et/ou l’anti-Ro60 et/ou l’anti-La dans la prédiction des données cliniques et de laboratoire dans un échantillon consécutif de patients et ceux-ci sont commandés pour tous les départements d’hôpital et de soins primaires. Nous avons examiné tous les échantillons de chaque patient au cours de cette période et avons enregistré la combinaison de réactivité anti-Ro52, anti-Ro60 et anti-La la plus répandue. Le seuil de positivité choisi >160 augmente la validité de l’étude, car le test ANA positif et le dosage des anti-Ro/SSA et des anti-La/SSB peuvent être détectés chez jusqu’à 25-30% et 1,6% des individus sains, respectivement. Leur prévalence est plus élevée avec l’âge, et leur positivité sans données cliniques pertinentes peut être trompeuse.29
Donc, dans notre étude, nous avons montré qu’un profil immunitaire peut nous conduire à un certain diagnostic ou au développement de manifestations de la maladie. Ceci est plus important dans le cas de l’apparition de maladies auto-immunes, car les anticorps circulants peuvent être présents plusieurs années avant le diagnostic de la maladie, et pourraient indiquer la gravité de ses manifestations.17,30
Certaines limites inhérentes à ces études sont les évaluations cliniques rétrospectives des dossiers cliniques et les biais diagnostiques possibles des médecins traitants qui voient ces patients et ordonnent des tests de laboratoire spécialisés. Un grand nombre de nos patients dont le test ANA était positif se sont révélés négatifs lors de la détermination du test ENA par immunoblot. Cela pourrait être lié au type d’immunodosage mis au point. Dans les cas de forte suspicion clinique, la détection d’anticorps spécifiques est recommandée11.
Divulgations éthiquesProtection des sujets humains et animaux
Les auteurs déclarent que cette recherche n’a pas été menée d’expériences sur des humains ou des animaux.
Confidentialité des données
Les auteurs déclarent avoir suivi les protocoles du lieu de travail sur la publication des données des patients.
Droit à la vie privée et au consentement éclairé
Les auteurs déclarent que cet article n’apparaît pas les données des patients.
Conflit d’intérêt
Les auteurs ne déclarent aucun conflit d’intérêt.