
OK, alors… c’est quoi un atome et qu’est-ce que ça a à voir avec les molécules ?
Parlons petit, et je veux dire vraiment tout petit. Les ATOMES sont les éléments constitutifs de base de tout ce que vous pouvez voir autour de vous, et même de beaucoup de choses que vous ne pouvez pas voir, comme l’air que vous respirez. Les atomes sont si petits qu’il y en a des millions, des milliards et des trillions dans la plus petite particule que tu puisses voir. Les solides, les liquides, les gaz – toute la matière – sont constitués d’atomes (ou d’autres choses, comme les molécules, qui sont faites d’atomes)!
 Les ÉLÉMENTS sont les types d’atomes que nous pouvons avoir. Le carbone est un élément, l’hydrogène est un élément, et l’oxygène aussi. (Nous pouvons les appeler par leur nom ou par leur symbole – C pour carbone, H pour hydrogène et O pour oxygène). Tous les éléments sont répertoriés dans un tableau périodique. Si c’est dans le tableau, c’est un élément !
Les ÉLÉMENTS sont les types d’atomes que nous pouvons avoir. Le carbone est un élément, l’hydrogène est un élément, et l’oxygène aussi. (Nous pouvons les appeler par leur nom ou par leur symbole – C pour carbone, H pour hydrogène et O pour oxygène). Tous les éléments sont répertoriés dans un tableau périodique. Si c’est dans le tableau, c’est un élément !
Les atomes peuvent s’associer – ils forment des liaisons entre eux – pour former des MOLECULES. Par exemple, deux atomes d’hydrogène s’accrochent ensemble pour former une molécule d’hydrogène, H2 pour faire court. Plutôt simple, non ?
Par exemple, deux atomes d’hydrogène s’accrochent ensemble pour former une molécule d’hydrogène, H2 pour faire court. Plutôt simple, non ?
Cliquez ici pour jeter un coup d’œil à un modèle 3-D d’hydrogène (H2).
Maintenant, si vous collez un atome d’oxygène entre ces deux hydrogènes, vous avez une molécule d’eau – H2O !
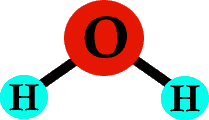
Cliquez ici pour voir l’eau (H2O) en 3-D.
Chaque type d’atome forme généralement le même nombre de liaisons (ils ont tendance à être têtus de cette façon). Par exemple, un atome d’hydrogène forme une liaison, un atome d’oxygène en forme deux, et le carbone en forme quatre. Regardez à nouveau cette molécule d’eau – chaque hydrogène a une liaison, et l’oxygène au milieu a deux liaisons.
Les molécules peuvent être beaucoup plus grosses. Une molécule de vitamine C est constituée de 20 atomes (6 carbones, 8 hydrogènes et 6 oxygènes – c’est C6H8O6). Si vous prenez ces 20 atomes de vitamine C et que vous les mélangez, en les liant dans un ordre différent, vous obtiendrez une molécule totalement différente qui non seulement a une apparence différente, mais qui agit aussi différemment. (Si vos jambes sortaient de votre tête, vous agiriez aussi bizarrement ! !!)
| Vitamine C C6H8O6 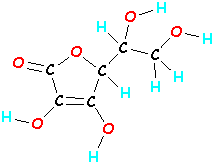 |
Somebody Else C6H8O6 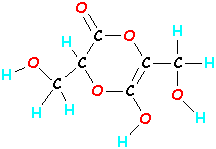 |
Donc, les molécules sont des atomes collés ensemble, mais pas n’importe comment. En changeant quel atome est lié à quel autre, on peut changer les propriétés d’une molécule, c’est-à-dire son aspect et son comportement – et cela change l’aspect et le comportement de tout un BOUTON de molécules accrochées ensemble. Par exemple, l’eau est un liquide, l’hydrogène est un gaz, et la vitamine C est un solide.
« ET ALORS ? !! » vous demandez. Eh bien, lorsque nous parlons de polymères, la façon dont les atomes sont liés les uns aux autres peut avoir un impact ÉNORME sur l’aspect et la réaction d’un objet fabriqué à partir de ces polymères lorsque vous le cognez, marchez dessus ou le jetez contre le mur. Par exemple, est-ce que ça va coller au mur ou rebondir ?
Une expérience de liaison
Le type de liaison dont nous avons parlé ici est appelé » liaison covalente « , ce qui signifie qu’elle est faite en partageant des électrons entre deux atomes.
Plus de choses sur les liaisons et la structure des atomes ici, sinon ….
Parlons POLYMÈRES ! !!
 |
Retour aux bases des polymères |
 |
Retour à la page principale |