La glycogénolyse, ou dégradation du glycogène, permet de libérer le glucose au moment où il est nécessaire.
Dans le foie, le glycogène constitue une réserve de glucose pour le maintien d’une glycémie normale, et sa dégradation se produit principalement :
- à jeun, par exemple pendant le jeûne nocturne ;
- entre les repas ;
- pendant une activité physique de haute intensité.
Dans les hépatocytes, la glycogénolyse est stimulée par le glucagon et l’adrénaline, inhibée par l’insuline, et soumise à une régulation allostérique négative par le glucose également (voir ci-dessous).
Dans le muscle, le glycogène est une source d’énergie pour l’activité musculaire ; par conséquent, la dégradation du glycogène se produit pendant la contraction, et uniquement dans les muscles impliqués dans l’activité.
Dans les cellules musculaires, la glycogénolyse est stimulée par l’adrénaline, et régulée par des effecteurs allostériques positifs et négatifs, AMP et ion calcium (Ca2+), et ATP et glucose 6-phosphate, respectivement (voir ci-dessous).
CONTENUS
- Étapes de la glycogénolyse
- Destinations métaboliques du glucose 1-phosphate dans le muscle et le foie
- Régulation covalente de la glycogénolyse dans le muscle et le foie
- β-.Adrénergiques
- Protéines G stimulatrices
- Adenyl cyclase
- Protéine kinase A
- Phosphorylase kinase
- Phosphorylase kinase musculaire
- Hépatique. phosphorylase kinase
- Glycogène phosphorylase musculaire
- Régulation allostérique de PP1
- Glycogène phosphorylase hépatique
Régulation allostérique de la glycogénolyse dans le muscle et le foie
Étapes de la glycogénolyse
La glycogénolyse débute par l’action de la glycogène phosphorylase (EC 2.4.1.1), un homodimère qui nécessite pour son activité la présence de pyridoxal-5-phosphate, un dérivé de la pyridoxine ou vitamine B6. L’enzyme catalyse le clivage phosphorolytique de la liaison α-(1,4) glycosidique, libérant les molécules de glucose une à une à partir des extrémités non réductrices, c’est-à-dire les extrémités avec un groupe 4′-OH libre, des branches externes. Cette réaction, qui ne consomme pas d’ATP mais un orthophosphate, donne du glucose 1-phosphate.
Glycogène(n résidus de glucose) + Pi → Glucose 1-Phosphate + Glycogène(n-1 résidus de glucose)
Note : dans l’intestin grêle, l’α-amylase pancréatique (EC 3.2.1.1) catalyse le clivage hydrolytique des liaisons α-(1,4) glycosidiques de l’amidon, et donne des molécules de glucose.
In vivo, la glycogène phosphorylase catalyse une phosphorolyse irréversible, une réaction particulièrement avantageuse pour le muscle squelettique et le cœur (voir ci-dessous). L’irréversibilité de la réaction est assurée par le rapport /, qui est généralement supérieur à 100. A l’inverse, la réaction est facilement réversible in vitro.
La glycogène phosphorylase agit de façon répétitive sur les extrémités non réductrices des ramifications, s’arrêtant lorsque l’unité glucose qui se trouve à 4 résidus du point de ramification est atteinte : c’est la limite extérieure de la dextrine limite. À ce stade, deux activités enzymatiques, présentes sur la même chaîne polypeptidique, achèvent la dégradation du glycogène : l’α-(1,4)-glucane-6-glycosyltransférase (EC 2.4.1.24) et l’amylo-α-(1,6)-glucosidase ou enzyme de débranchement (EC 3.2.1.33). La première activité enzymatique transfère trois des quatre unités de glucose restantes de la branche à l’extrémité non réductrice d’une autre branche, laissant dans la première chaîne une seule unité de glucose, qui est attachée à la chaîne par une liaison α-(1,6)-glycosidique. La deuxième activité enzymatique hydrolyse cette liaison α-(1,6)-glycosidique, libérant le glucose et une chaîne non ramifiée d’unités de glucose liées à l’α-(1,4).
Sans la branche, la glycogène phosphorylase peut continuer à éliminer des unités de glucose jusqu’à ce qu’elle atteigne la dextrine limite suivante.
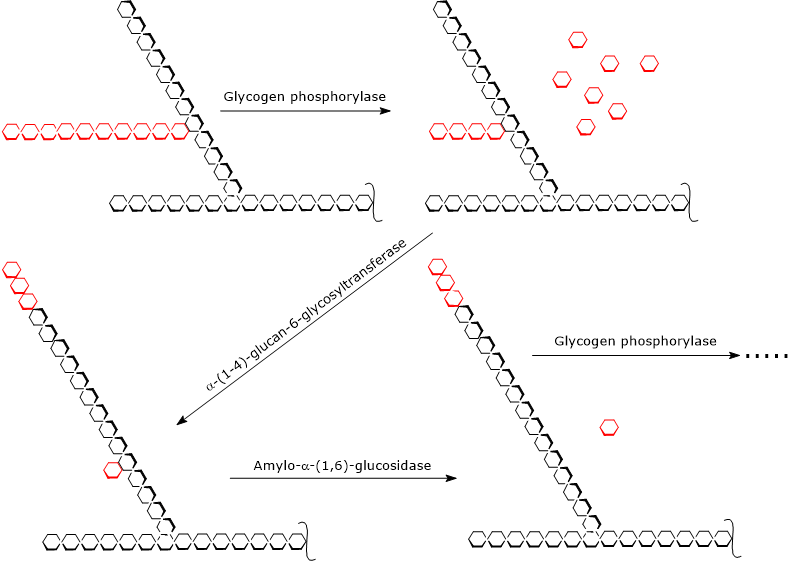
Donc, les produits des réactions catalysées par les trois activités enzymatiques sont :
- le glucose 1-phosphate (environ 90% des molécules de glucose libérées);
- une petite quantité de glucose libre, les 10% restants ;
- une molécule de glycogène plus petite et moins ramifiée.
Destinations métaboliques du glucose 1-phosphate dans le muscle et le foie
Le glucose 1-phosphate est une molécule chargée, et donc elle est piégée dans la cellule.
Il est converti en glucose 6-phosphate dans la réaction catalysée par la phosphoglucomutase (EC 5.4.2.2), la même enzyme qui intervient également dans la synthèse du glycogène en convertissant le glucose 6-phosphate en glucose 1-phosphate. Cette enzyme catalyse une réaction réversible : le sens est déterminé par les concentrations relatives des deux molécules, et déplace dans ce cas le groupe phosphate de C1 à C6.
Glucose 1-Phosphate ⇄ Glucose 6-Phosphate
Dans le muscle, et dans la plupart des autres organes et tissus, le glucose issu de la glycogénolyse entre dans la glycolyse sous forme de glucose 6-phosphate, en contournant l’étape d’activation catalysée par l’hexokinase. Par conséquent, la glycogène phosphorylase, en libérant une molécule de glucose déjà « activée », économise un ATP. Une molécule d’ATP est nécessaire pour synthétiser un autre intermédiaire glycolytique, le fructose 1,6-bisphosphate.
De cette façon, une partie de l’énergie d’activation nécessaire à la synthèse du glycogène est conservée : le rendement net d’ATP par molécule de glucose par la glycolyse en lactate est de 3 au lieu de 2, un avantage pour le muscle qui travaille. L’équation globale est :
Glycogène(n résidus de glucose) + 3 ADP + 3 Pi → Glycogène(n-1 résidus de glucose) + 2 Lactate + 3 ATP
Dans le foie, le glucose 6-phosphate du glycogène est déphosphorylé par la glucose 6-phosphatase (EC 3.1.3.9), puis libéré dans la circulation sanguine. Ce sont les étapes de l’élimination des unités de glucose, sous forme de glucose phosphorylé, par la glycogénolyse hépatique :
Glycogène(n résidus de glucose) + Pi → Glucose 1-Phosphate + Glycogène(n-1 résidus de glucose)
glucose-1-phosphate → glucose-6-phosphate
glucose-6-phosphate + H2O → glucose + Pi
L’équation globale est :
Glycogène(n résidus de glucose) + H2O → Glycogène(n-1 résidus de glucose) +Gglucose
Régulation covalente de la glycogénolyse dans le muscle et le foie
La dégradation du glycogène est sous un contrôle fin par des modifications covalentes et/ou allostériques de certaines protéines clés, comme la phosphorylase kinase (EC 2.7.11.19), la glycogène phosphorylase et la protéine phosphatase 1.
Ici, les effets de deux hormones, qui agissent par des modifications covalentes de protéines cibles, sont analysés :
- l’adrénaline (aussi appelée épinéphrine), produite par les glandes surrénales, qui agit par exemple sur les muscles, le foie et les cellules graisseuses ;
- le glucagon, produit par les cellules alpha du pancréas, qui agit sur les hépatocytes et les adipocytes.
Ces hormones, en se liant à leurs récepteurs membranaires, déclenchent une cascade identique d’événements intracellulaires qui amplifient de plusieurs ordres de grandeur leur signal, stimulant la glycogénolyse et inhibant la synthèse du glycogène.
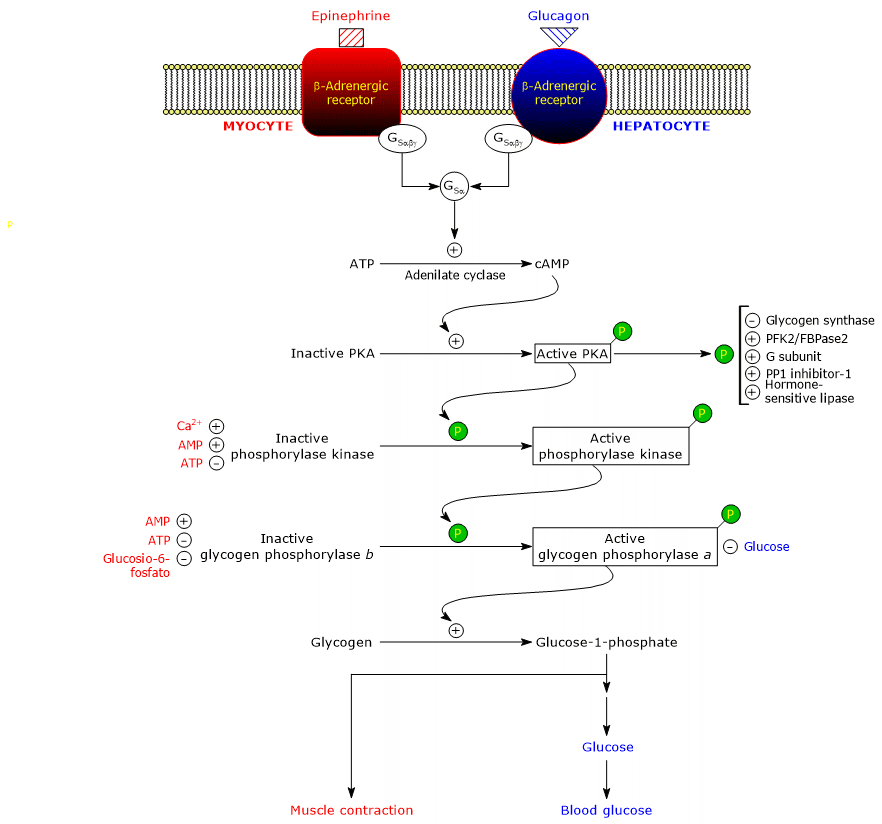
Il faut noter que même l’acétylcholine, par sa liaison au récepteur situé à la jonction neuromusculaire, déclenche la même cascade d’activations de l’adrénaline et du glucagon.
Voici les protéines impliquées dans cette cascade.
Récepteursβ-adrénergiques
Les récepteurs de l’adrénaline et du glucagon sont des protéines membranaires intégrales, avec sept α-hélices transmembranaires.
Le terme « adrénergique » dérive de l’adrénaline. Il existe quatre sous-types de récepteurs adrénergiques : α1, α2, β1 et β2. Dans la discussion qui suit, seuls les récepteurs β1 et β2, appelés β, et qui agissent de la même manière, seront considérés.
Les récepteurs β-adrénergiques provoquent des modifications du métabolisme énergétique, telles que :
- une augmentation de la dégradation du glycogène dans les cellules musculaires et hépatiques ;
- une augmentation de la dégradation des triglycérides (lipolyse) dans le tissu adipeux.
Les protéines G stimulatrices
La liaison de l’hormone au récepteur entraîne un changement de conformation de la partie cytosolique du récepteur, ce qui modifie l’interaction avec la deuxième protéine de la cascade : la protéine de liaison des guanine nucléotides stimulateurs ou, plus simplement, la protéine G stimulatrice (GS). Il s’agit d’un hétérotrimère composé de trois sous-unités : α (contenant le site de liaison des nucléotides), β et γ. Sous sa forme inactive, GSαβγ-GDP, l’hétérotrimère est couplé aux récepteurs β-adrénergiques.
Les changements de conformation du récepteur lui permettent de catalyser le remplacement du GDP par le GTP dans la sous-unité α du complexe GSαβγ. Cela entraîne la dissociation du trimère en un dimère inactif, βγ, et le complexe GSα-GTP qui se déplace le long du plan de la surface interne de la membrane plasmique, à laquelle il est ancré par un groupe palmitoyle lié de manière covalente, jusqu’à ce qu’il atteigne l’adénylyl cyclase (EC 4.6.1.1).
Note : l’action de la GS ressemble à celles des protéines Ras, une autre classe de protéines G qui sont impliquées dans la transduction du signal de l’insuline.
Adenyl cyclase
C’est une enzyme à membrane intégrale, dont le site actif se trouve sur le côté cytosolique de la membrane plasmique. L’interaction entre le GSα et l’adényl cyclase active l’enzyme qui, à son tour, catalyse la synthèse de l’AMPc à partir de l’ATP. Cela entraîne une augmentation de la concentration intracellulaire du nucléotide cyclique.
L’activité stimulante de la GSα est autolimitée, car elle est une GPTasi, c’est-à-dire qu’elle hydrolyse le GTP lié en GDP, s’éteignant ainsi. Sous sa forme inactive, GSα se dissocie de l’adényl cyclase et se réassocie avec le dimère Gβγ. Par conséquent, l’hétérotrimère est à nouveau disponible pour interagir avec un complexe hormone-récepteur.
Protéine kinase A
L’AMPc se lie et active la protéine kinase dépendante de l’AMPc ou protéine kinase A ou PKA (EC 2.7.11.11). La forme inactive de l’enzyme est un tétramère composé de deux sous-unités catalytiques et de deux sous-unités régulatrices. Chacune des deux sous-unités régulatrices possède un domaine auto-inhibiteur, c’est-à-dire une région qui occupe le site de liaison du substrat de chaque sous-unité catalytique. La liaison de deux molécules d’AMPc à deux sites sur chaque sous-unité régulatrice entraîne un changement de conformation qui provoque leur dissociation du tétramère, libérant les deux sous-unités catalytiques comme enzymes actives. La forme active de la PKA catalyse la phosphorylation de certaines protéines, les activant ou les inhibant, comme :
- la glycogène synthase (EC 2.4.1.11), inhibée;
- Lipase sensible aux hormones (EC 3.1.1.79), activée;
- phosphofructokinase 2/fructose-2,6-bisphosphatase (EC 2.7.1.105 et EC 3.1.3.46 respectivement), activées ;
- l’inhibiteur-1 et la sous-unité de liaison au glycogène (G) de la protéine phosphatase 1, activés ;
- la phosphorylase kinase, activée.
L’AMPc a une demi-vie très courte : il est hydrolysé en AMP, qui n’a pas d’activité de second messager, dans la réaction catalysée par la nucléotide cyclique phosphodiestérase (EC 3.1.4.53). La caféine et la théophylline, deux méthylxanthines contenues respectivement dans le café et le thé, inhibent la phosphodiestérase, augmentant ainsi la demi-vie de l’AMP, et renforçant ses effets.
Phosphorylase kinase
L’étape suivante de la cascade est catalysée par la phosphorylase kinase.
La protéine est constituée de quatre sous-unités différentes, chacune présente en quatre exemplaires pour former un complexe appelé (αβγδ)4. Les sous-unités γ ont une activité catalytique, tandis que les sous-unités α, β et δ sont des sous-unités régulatrices.Les sous-unités α et β sont phosphorylées lorsque l’enzyme passe de l’état inactif à l’état actif. La sous-unité δ, également appelée calmoduline, est une protéine régulatrice qui fixe les ions calcium. Cette protéine est également présente dans un grand nombre d’autres enzymes. Elle agit comme un capteur de calcium, c’est-à-dire qu’elle réagit aux changements de la concentration de calcium intracellulaire, influençant l’activité des protéines avec lesquelles elle interagit (voir ci-dessous). La phosphorylase kinase existe sous deux isoformes, l’une exprimée dans le foie et l’autre dans les muscles squelettiques et cardiaques ; elles diffèrent au niveau des sous-unités α et γ, qui sont codées par des gènes différents.
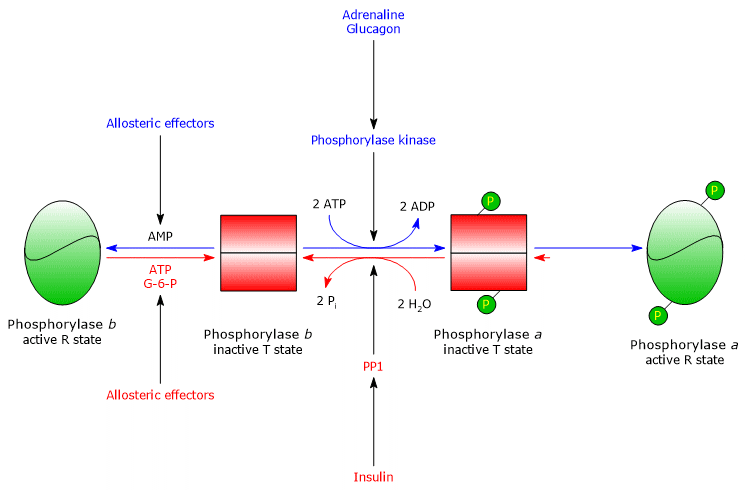
L’une des protéines cibles de la phosphorylase kinase est la glycogène phosphorylase. Cette enzyme existe sous forme d’isoenzymes dans différents tissus, et dans deux états conformationnels en équilibre dynamique, désignés comme :
- T, pour tendu ou tendu, qui est moins actif ;
- R, pour détendu, qui est plus actif, et capable de se lier au glycogène, également à l’état phosphorylé (voir ci-dessous).
La kinase phosphoryle un seul résidu sérine (Ser-14) dans chacune des deux sous-unités de la glycogène phosphorylase, qui est presque entièrement à l’état T, la transformant en forme active, qui, à l’inverse, est presque entièrement à l’état R, et déclenchant donc la dégradation du glycogène.
L’enzyme phosphorylée est la forme la plus active de l’enzyme et est appelée glycogène phosphorylase a ; l’enzyme non phosphorylée est la forme la moins active de l’enzyme, et est appelée glycogène phosphorylase b. Les deux formes enzymatiques peuvent être inhibées ou activées de manière allostérique (voir ci-dessous).
Dans le muscle, la glycogénolyse libère du glucose 1-phosphate qui, comme nous l’avons vu précédemment, est métabolisé dans le muscle lui-même pour produire de l’énergie pour la contraction musculaire, et donc pour la réponse de combat ou de fuite déclenchée par l’adrénaline.
Dans le foie, le glucagon déclenche la libération de glucose dans la circulation pour contrer l’hypoglycémie.
Une fois la situation stressante terminée, la phosphorylase a, également appelée phosphoprotéine phosphatase 1 ou PP1 (EC 3.1.3.17), catalyse l’élimination des groupes phosphates de la phosphorylase kinase et de la glycogène phosphorylase a, les transformant ainsi en formes inactives (l’enzyme élimine également les groupes phosphates de la glycogène synthase). La PP1 est composée d’une sous-unité catalytique, qui a une faible efficacité catalytique et une faible affinité pour le glycogène, et de la sous-unité G susmentionnée, qui appartient à une famille de protéines qui lient d’autres protéines au glycogène, connues sous le nom de protéines ciblant le glycogène (la phosphorylase kinase, la glycogène phosphorylase et la glycogène synthase sont également liées aux particules de glycogène par des protéines de cette famille).
La PP1 est également inhibée par une autre protéine appelée inhibiteur 1 de la PP1.
Comme nous l’avons vu précédemment, la PKA phosphoryle :
- la sous-unité G, qui, sous la forme phosphorylée, n’est pas capable de se lier à la sous-unité catalytique de PP1, et donc PP1 ne rencontre pas ses cibles associées au glycogène (à l’inverse, la phosphorylation de la sous-unité G induite par la stimulation insulinique, affectant divers résidus d’acides aminés, permet la liaison à la sous-unité catalytique de PP1) ;
- l’inhibiteur-1, qui, sous sa forme phosphorylée, est capable d’inhiber l’activité de PP1.
Donc, la liaison de l’hormone à son récepteur déclenche une réaction en cascade qui conduit, entre autres, à l’inhibition de l’activité de PP1. Celle-ci maintient la phosphorylation de la glycogène phosphorylase et de la glycogène synthase : la première enzyme est activée tandis que la seconde est inhibée. De cette manière, le métabolisme glucidique est optimisé.
Régulation allostérique de la glycogénolyse dans le muscle et le foie
La glycogénolyse est également régulée par des effecteurs allostériques positifs et négatifs. Ils agissent sur trois enzymes : la phosphorylase kinase musculaire, la glycogène phosphorylase hépatique et musculaire, et la PP1.
Phosphorylase kinase musculaire
L’activité de l’enzyme est régulée par deux effecteurs allostériques positifs, l’ion calcium et l’AMP, et un effecteur allostérique négatif, l’ATP.
Une augmentation de la concentration intracellulaire en ions calcium est le signal de la contraction musculaire et, une fois libéré du réticulum sarcoplasmique, le calcium se lie à la sous-unité δ (calmoduline) de l’enzyme, l’activant.
L’AMP s’accumule dans le muscle lors d’une contraction intense, due à la consommation d’ATP, et se lie à l’enzyme pour l’activer. A l’inverse, lorsque la concentration en ATP est élevée, c’est-à-dire que le muscle ne se contracte pas, il se lie au site allostérique de l’AMP inactivant la kinase.
Phosphorylase kinase hépatique
Certaines hormones peuvent agir à la fois en déclenchant des modifications covalentes des protéines cibles et en provoquant la libération d’ions calcium par le réticulum endoplasmique.
Dans le foie, la phosphorylase kinase est régulée par des hormones qui provoquent la libération d’ions calcium. On peut citer la vasopressine, mais aussi l’adrénaline lorsqu’elle se lie aux récepteurs α1. En ce qui concerne l’adrénaline, sa liaison aux récepteurs α1 active une protéine G qui stimule la phospholipase C-β, laquelle convertit à son tour le phosphatidylinositol-4,5-bisphosphate en inositol 1,4,5-triphosphate (IP3) et en diacylglycérol. L’inositol 1,4,5-triphosphate provoque la libération d’ions calcium du réticulum endoplasmique. Les ions calcium, se liant à la sous-unité δ de la phosphorylase kinase, conduisent à son activation.
Glycogène phosphorylase musculaire
Le glycogène phosphorylase b musculaire est activé en présence de fortes concentrations d’AMP qui, se liant à un site de liaison nucléotidique spécifique, modifie la structure quaternaire de l’enzyme, déplaçant l’équilibre allostérique vers l’état actif R de la forme b. Inversement, l’ATP et le glucose-6-phosphate, qui entrent en compétition avec l’AMP pour le même site de liaison aux nucléotides, agissent comme des effecteurs allostériques négatifs, déplaçant l’équilibre allostérique vers l’état T inactif de la forme b.
La glycogène phosphorylase musculaire a est active, indépendamment des niveaux d’AMP, d’ATP et de glucose-6-phosphate.
Dans le muscle au repos, presque toute la glycogène phosphorylase est sous la forme b inactive.
En fait, la régulation covalente et allostérique de l’enzyme assure une régulation fine de la glycémie intracellulaire.
- Si une cellule ayant une charge énergétique suffisante reçoit le signal hormonal qui déclenche la cascade d’activations, la glycogène phosphorylase b, inhibée par l’ATP et le glucose-6-phosphate, reste à l’état T jusqu’à ce que la charge soit élevée.
- Si la charge énergétique cellulaire est faible, la glycogène phosphorylase b, activée par l’AMP, commence la dégradation du glycogène, même en l’absence du stimulus hormonal qui induit sa conversion en forme active a.
Régulation allostérique de la PP1
La PP1 est activée allostériquement par le glucose-6-phosphate, donc lorsque la charge énergétique cellulaire est faible.
Glycogène phosphorylase hépatique
Dans le foie, la régulation allostérique de l’enzyme se fait par différents mécanismes.
- La première différence concerne la réponse à l’AMP : la glycogène phosphorylase b hépatique n’est pas activée par l’AMP.
- La seconde différence concerne la glycogène phosphorylase a : l’enzyme est inhibée par le glucose, qui est un inhibiteur compétitif (le monosaccharide déplace l’équilibre allostérique vers l’état T inactif de la forme a.
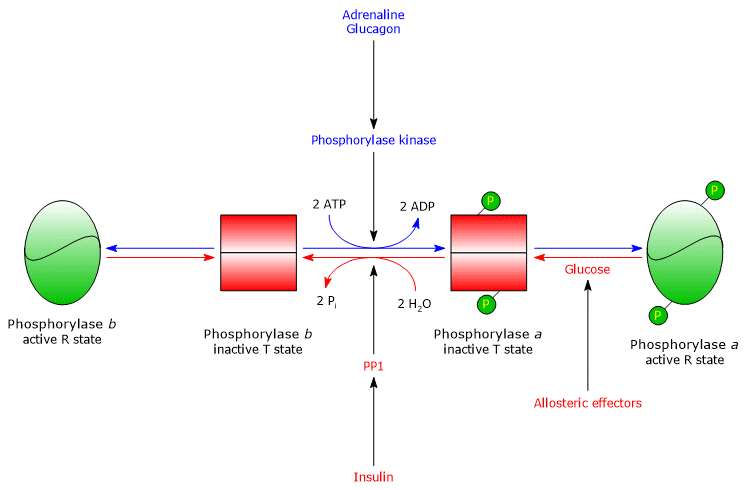
Dans le foie, le but de la glycogénolyse est de fournir du glucose aux autres tissus lorsque le taux de glucose sanguin est faible. Lorsque le taux de glucose sanguin revient à la normale, sa concentration dans les hépatocytes augmente et il se lie à la glycogène phosphorylase a, induisant un changement de conformation qui expose les résidus sérine phosphorylés à l’activité de PP1, qui inactive l’enzyme par déphosphorylation. Par conséquent, le site allostérique pour le glucose de la glycogène phosphorylase hépatique permet à l’enzyme d’agir comme un capteur de glucose sanguin, répondant de manière appropriée aux changements du niveau de glucose sanguin. En fin de compte, l’isoenzyme hépatique ne répond qu’au glucose, et non à l’AMP, c’est-à-dire à la charge énergétique cellulaire, et cela mérite d’être souligné car les acides gras, et non le glucose, constituent la principale source d’énergie du foie.
Berg J.M., Tymoczko J.L. et Stryer L. Biochemistry. 5e édition. W. H. Freeman and Company, 2002
Nelson D.L., M. M. Cox M.M. Lehninger. Principes de biochimie. 4th Ed. W.H. Freeman and Company, 2004
Rawn J.D. Biochimica. Mc Graw-Hill, Neil Patterson Publishers, 1990
Roach P.J., Depaoli-Roach A.A., Hurley T.D., Tagliabracci V.S. Glycogène et son métabolisme : quelques nouveaux développements et vieux thèmes. Biochem J 2012:441;763-87. doi:10.1042/BJ20111416
Rosenthal M.D., Glew R.H. Medical Biochemistry – Human Metabolism in Health and Disease. John Wiley J. & Sons, Inc, Publication, 2009
.