- Établir la théorie atomique moderne.
- Apprendre comment les atomes sont construits.
Le plus petit morceau d’un élément qui maintient l’identité de cet élément est appelé un atome. Les atomes individuels sont extrêmement petits. Il faudrait environ cinquante millions d’atomes alignés pour former une ligne de 1 cm de long. Le point à la fin d’une phrase imprimée contient plusieurs millions d’atomes. Les atomes sont si petits qu’il est difficile de croire que toute la matière est faite d’atomes – mais c’est le cas.
Le concept selon lequel les atomes jouent un rôle fondamental en chimie est formalisé par la théorie atomique moderne, énoncée pour la première fois par John Dalton, un scientifique anglais, en 1808. Elle se compose de trois parties :
- Toute la matière est composée d’atomes.
- Les atomes d’un même élément sont identiques ; les atomes d’éléments différents sont différents.
- Les atomes se combinent dans des rapports de nombres entiers pour former des composés.
Ces concepts constituent la base de la chimie.
Bien que le mot atome vienne d’un mot grec qui signifie « indivisible », nous comprenons maintenant que les atomes eux-mêmes sont composés de parties plus petites appelées particules subatomiques. La première partie à être découverte fut l’électron, une minuscule particule subatomique dotée d’une charge négative. Il est souvent représenté par e-, l’exposant de droite indiquant la charge négative. Plus tard, deux particules plus grosses ont été découvertes. Le proton est une particule subatomique plus massive (mais toujours minuscule) dotée d’une charge positive, représentée par p+. Le neutron est une particule subatomique ayant à peu près la même masse que le proton mais sans charge. Il est représenté par n ou n0. Nous savons maintenant que tous les atomes de tous les éléments sont composés d’électrons, de protons et (à une exception près) de neutrons. Le tableau 3.1 » Propriétés des trois particules subatomiques » résume les propriétés de ces trois particules subatomiques.
Tableau 3.1 Propriétés des trois particules subatomiques
| Nom | Symbole | Masse (approx.; kg) | Charge |
|---|---|---|---|
| Proton | p+ | 1.6 × 10-27 | 1+ |
| Neutron | n, n0 | 1,6 × 10-27 | none |
| Electron | e- | 9.1 × 10-31 | 1- |
Comment ces particules sont-elles disposées dans les atomes ? Elles ne sont pas disposées au hasard. Les expériences menées par Ernest Rutherford en Angleterre dans les années 1910 ont mis en évidence un modèle nucléaire de l’atome. Les protons et les neutrons, relativement massifs, sont rassemblés au centre d’un atome, dans une région appelée noyau de l’atome (plusieurs noyaux). Les électrons se trouvent à l’extérieur du noyau et passent leur temps à tourner dans l’espace autour du noyau. (Voir la figure 3.1 » La structure de l’atome « .)
Figure 3.1 La structure de l’atome
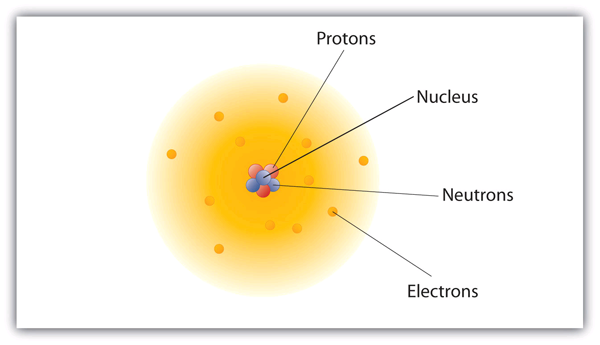
Les atomes ont des protons et des neutrons au centre, constituant le noyau, tandis que les électrons gravitent autour du noyau.
La théorie atomique moderne affirme que les atomes d’un élément sont identiques, tandis que les atomes d’éléments différents sont différents. Qu’est-ce qui rend les atomes d’éléments différents différents ? La caractéristique fondamentale que partagent tous les atomes d’un même élément est le nombre de protons. Tous les atomes d’hydrogène ont un et un seul proton dans le noyau ; tous les atomes de fer ont 26 protons dans le noyau. Ce nombre de protons est si important pour l’identité d’un atome qu’il est appelé numéro atomique de l’élément. Ainsi, l’hydrogène a un numéro atomique de 1, tandis que le fer a un numéro atomique de 26. Chaque élément a son propre numéro atomique caractéristique.
Les atomes d’un même élément peuvent cependant avoir un nombre différent de neutrons. Les atomes d’un même élément (c’est-à-dire les atomes ayant le même nombre de protons) ayant un nombre différent de neutrons sont appelés isotopes. La plupart des éléments naturels existent sous forme d’isotopes. Par exemple, la plupart des atomes d’hydrogène ont un seul proton dans leur noyau. Cependant, un petit nombre (environ un sur un million) d’atomes d’hydrogène ont un proton et un neutron dans leur noyau. Cet isotope particulier de l’hydrogène est appelé deutérium. Une forme très rare d’hydrogène possède un proton et deux neutrons dans son noyau ; cet isotope de l’hydrogène est appelé tritium. La somme du nombre de protons et de neutrons dans le noyau est appelée le nombre de masse de l’isotope.
Les atomes neutres ont le même nombre d’électrons que de protons, leur charge globale est donc nulle. Cependant, comme nous le verrons plus tard, ce ne sera pas toujours le cas.
Exemple 1
- Les atomes de carbone les plus courants ont six protons et six neutrons dans leur noyau. Quels sont le numéro atomique et le numéro de masse de ces atomes de carbone ?
- Un isotope de l’uranium a un numéro atomique de 92 et un numéro de masse de 235. Quel est le nombre de protons et de neutrons dans le noyau de cet atome ?
Solution
- Si un atome de carbone a six protons dans son noyau, son numéro atomique est 6. S’il a aussi six neutrons dans le noyau, alors le numéro de masse est 6 + 6, soit 12.
- Si le numéro atomique de l’uranium est 92, alors c’est le nombre de protons dans le noyau. Comme le numéro de masse est 235, alors le nombre de neutrons dans le noyau est 235 – 92, soit 143.
Testez-vous
Le nombre de protons dans le noyau d’un atome d’étain est 50, tandis que le nombre de neutrons dans le noyau est 68. Quels sont le numéro atomique et le numéro de masse de cet isotope ?
Réponse
Numéro atomique = 50, numéro de masse = 118
Lorsqu’on se réfère à un atome, on utilise simplement le nom de l’élément : le terme sodium désigne aussi bien l’élément qu’un atome de sodium. Mais il peut être peu commode d’utiliser le nom des éléments en permanence. Au lieu de cela, la chimie définit un symbole pour chaque élément. Le symbole atomique est une abréviation d’une ou deux lettres du nom de l’élément. Par convention, la première lettre du symbole d’un élément est toujours en majuscule, tandis que la deuxième lettre (si elle est présente) est en minuscule. Ainsi, le symbole de l’hydrogène est H, celui du sodium est Na, et celui du nickel est Ni. La plupart des symboles proviennent du nom anglais de l’élément, bien que certains symboles proviennent du nom latin de l’élément. (Le symbole du sodium, Na, vient de son nom latin, natrium.) Le tableau 3.2 » Noms et symboles des éléments courants » énumère certains éléments courants et leurs symboles. Vous devriez mémoriser les symboles du tableau 3.2 » Noms et symboles des éléments communs « , car c’est ainsi que nous représenterons les éléments tout au long de la chimie.
Tableau 3.2 Noms et symboles des éléments courants
Élément NomSymbole
| Élément. Nom | Symbole | ||||
|---|---|---|---|---|---|
| Aluminum | Al | Mercure | Hg | Argon | Ar | Molybdène | Mo | Arsenic | As | Néon | Ne |
| Baryum | Ba | Nickel | Ni | Béryllium | Be | Azote | N. | N | Bismuth | Bi | Oxygène | O | Bore | B | Palladium | Pd | Bromine | Br | Phosphore | P | Calcium | Ca | Platine | Pt |
| Carbone | C | Potassium | K | Chlore | Cl | Radium | Ra | Chromium | Cr | Radon | Rn | Cobalt | Co | Rubidium | Rb | . | Cuivre | Scandium | Sc |
| Fluor | F | Sélénium | Se | Laquelle ? | Gallium | Ga | Silicium | Si | Germanium | Ge | Argent | Ag | Gold | Au | Au. | Au | Sodium | Na |
| Hélium | He | Strontium | Sr | Hydrogène | H | Soufre | S |
| Iodine | I | Tantale | Ta | ||
| Iridium | Ir | Tin | Itd>… | Étain | Sn | Iron | Fe | Titanium | Ti | Krypton | Kr | Tungstène | W | Lead | Pb | Uranium | U |
| Lithium | Li | Xénon | Xe | Mg | Zinc | Zn | Manganèse | Mn | Zirconium | Zr |
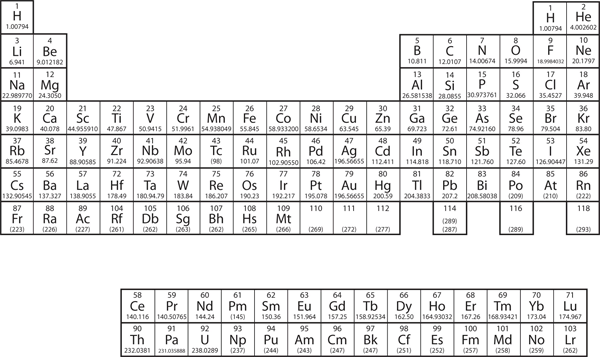
Les éléments sont regroupés dans un tableau spécial appelé tableau périodique. Un tableau périodique simple est illustré à la figure 3.2 » Un tableau périodique simple « , tandis qu’un tableau plus complet est présenté au chapitre 17 » Annexe : Tableau périodique des éléments ». Les éléments du tableau périodique sont classés par ordre croissant de numéro atomique. Le tableau périodique a une forme particulière qui deviendra importante pour nous lorsque nous étudierons l’organisation des électrons dans les atomes (voir le chapitre 8 « Structure électronique »). Une utilisation immédiate du tableau périodique nous aide à identifier les métaux et les non-métaux. Les non-métaux se trouvent dans le coin supérieur droit du tableau périodique, d’un côté de la ligne lourde qui divise la partie droite du tableau. Tous les autres éléments sont des métaux.
Figure 3.2 Un tableau périodique simple
Il existe un moyen simple de représenter les isotopes à l’aide des symboles atomiques. On utilise la construction
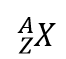
où X est le symbole de l’élément, A est le numéro de masse, et Z est le numéro atomique. Ainsi, pour l’isotope du carbone qui possède 6 protons et 6 neutrons, le symbole est
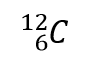
où C est le symbole de l’élément, 6 représente le numéro atomique, et 12 représente le numéro de masse.
Exemple 2
- Quel est le symbole d’un isotope de l’uranium qui a un numéro atomique de 92 et un numéro de masse de 235 ?
- Combien de protons et de neutrons y a-t-il dans 26Fe ?
Solution
- Le symbole de cet isotope est
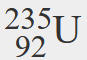
- Cet atome de fer possède 26 protons et 56 – 26 = 30 neutrons.
Testez-vous
Combien de protons y a-t-il dans 11N ?
Réponse
11 protons
Il est également courant d’indiquer le numéro de masse après le nom d’un élément pour indiquer un isotope particulier. Le carbone-12 représente un isotope du carbone avec 6 protons et 6 neutrons, tandis que l’uranium-238 est un isotope de l’uranium qui possède 146 neutrons.
Key Takeaways
- La chimie est basée sur la théorie atomique moderne, qui stipule que toute matière est composée d’atomes.
- Les atomes eux-mêmes sont composés de protons, de neutrons et d’électrons.
- Chaque élément a son propre numéro atomique, qui est égal au nombre de protons dans son noyau.
- Les isotopes d’un élément contiennent différents nombres de neutrons.
- Les éléments sont représentés par un symbole atomique.
- Le tableau périodique est un tableau qui organise tous les éléments.
Exercices
Listez les trois énoncés qui constituent la théorie atomique moderne.
Expliquez comment les atomes sont composés.
Quel est le plus gros, un proton ou un électron ?
Quel est le plus gros, un neutron ou un électron ?
Quelles sont les charges de chacune des trois particules subatomiques ?
Où se trouve la plus grande partie de la masse d’un atome ?
Esquisser un diagramme d’un atome de bore, qui possède cinq protons et six neutrons dans son noyau.
Esquisser le schéma d’un atome d’hélium, qui possède deux protons et deux neutrons dans son noyau.
Définir le numéro atomique. Quel est le numéro atomique d’un atome de bore ?
Quel est le numéro atomique de l’hélium ?
Définir l’isotope et donner un exemple.
Quelle est la différence entre le deutérium et le tritium ?
Quelle paire représente des isotopes?
a) ![]()
b) 26F et 25M
c) 14S et 15P
14. Quelle paire représente des isotopes ?
a) 20C et 19K
b) 26F et 26F
c) 92U et 92U
15. Donnez les symboles complets de chaque atome, y compris le numéro atomique et le numéro de masse.
a) un atome d’oxygène avec 8 protons et 8 neutrons
b) un atome de potassium avec 19 protons et 20 neutrons
c) un atome de lithium avec 3 protons et 4 neutrons
16. Donnez les symboles complets de chaque atome, y compris le numéro atomique et le numéro de masse.
a) un atome de magnésium avec 12 protons et 12 neutrons
b) un atome de magnésium avec 12 protons et 13 neutrons
c) un atome de xénon avec 54 protons et 77 neutrons
17. L’américium-241 est un isotope utilisé dans les détecteurs de fumée. Quel est le symbole complet de cet isotope ?
18. Le carbone 14 est un isotope utilisé pour effectuer des tests de datation radioactive sur des matériaux anciennement vivants. Quel est le symbole complet de cet isotope?
19. Donnez les symboles atomiques de chaque élément.
a) sodium
b) argon
c) azote
d) radon
20. Donnez les symboles atomiques de chaque élément.
a) argent
b) or
c) mercure
d) iode
21. Donnez le nom de l’élément.
a) Si
b) Mn
c) Fe
d) Cr
22. Donnez le nom de l’élément.
a) F
b) Cl
c) Br
d) I
Réponses
Toute la matière est composée d’atomes ; les atomes d’un même élément sont identiques, et les atomes d’éléments différents sont différents ; les atomes se combinent dans des rapports de nombres entiers pour former des composés.
Un proton est plus grand qu’un électron.
Proton : 1+ ; électron : 1- ; neutron : 0

Le numéro atomique est le nombre de protons dans un noyau. Le bore a un numéro atomique de cinq.
Les isotopes sont des atomes d’un même élément mais avec un nombre différent de neutrons.  en sont des exemples.
en sont des exemples.
a) isotopes
b) pas isotopes
c) pas isotopes
a) ![]()
b) 19K
c) ![]()
95A
a) Na
b) Ar
c) N
d) Rn
a) silicium
b) manganèse
c) fer
d) chrome
.