Tous les sels et les ions qui se dissolvent dans l’eau de mer contribuent à sa salinité globale. La salinité de l’eau de mer est généralement exprimée en grammes de sel par kilogramme (1000 g) d’eau de mer. En moyenne, environ 35 g de sel sont présents dans chaque 1 kg d’eau de mer, on dit donc que la salinité moyenne de l’océan est de 35 parties par mille (ppt). Notez que 35 ppt est équivalent à 3,5% (parties par cent). Certaines sources utilisent désormais des unités pratiques de salinité (PSU) pour exprimer les valeurs de salinité, où 1 PSU = 1 ppt. Les unités ne sont pas incluses, nous pouvons donc nous référer simplement à une salinité de 35.
De nombreuses substances différentes sont dissoutes dans l’océan, mais six ions comprennent environ 99,4 % de tous les ions dissous dans l’eau de mer. Ces six ions majeurs sont (tableau 5.3.1) :
Tableau 5.3.1 Les six ions majeurs de l’eau de mer
| g/kg dans… l’eau de mer | % d’ions en poids | |
|---|---|---|
| Chlorure Cl- | 19.35 | 55,07% |
| Sodium Na+ | 10,76 | 30,6% |
| Sulfate SO42- | 2,71 | 7.72% | Magnésium Mg2+ | 1,29 | 3,68% | Calcium Ca2+ | 0,41 | 1,17% | Potassium K+ | 0,39 | 1.1% |
| 99,36% |
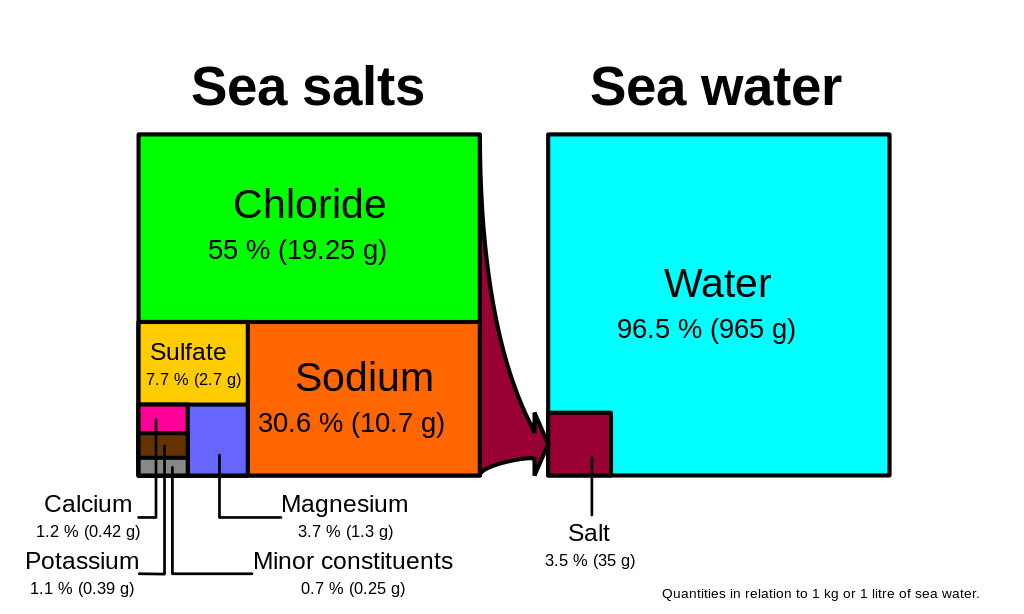
Le chlorure et le sodium, composants du sel de table (chlorure de sodium NaCl), constituent plus de 85 % des ions présents dans l’océan, ce qui explique le goût salé de l’eau de mer (figure 5.3.1). En plus des constituants majeurs, il existe de nombreux constituants mineurs : radionucléotides, composés organiques, métaux, etc. Ces constituants mineurs se trouvent à des concentrations de l’ordre de ppm (parties par million) ou ppb (parties par milliard), contrairement aux ions majeurs qui sont beaucoup plus abondants (ppt) (tableau 5.3.2). Pour mettre cela en perspective, 1 ppm = 1 mg/kg, soit l’équivalent d’une cuillère à café de sucre dissoute dans 14 000 canettes de soda. 1 ppb = 1 μg/kg, ou l’équivalent d’une cuillère à café d’une substance dissoute dans cinq piscines olympiques ! Ces constituants mineurs représentent de nombreuses substances, mais ensemble, ils constituent moins de 1 % des ions présents dans l’eau de mer. Certains d’entre eux peuvent être importants en tant que minéraux et oligo-éléments vitaux pour les organismes vivants, mais ils n’ont pas beaucoup d’impact sur la salinité globale. Mais compte tenu de la vaste taille des océans, même les matériaux présents à l’état de traces peuvent représenter des réservoirs assez importants. Par exemple, l’or est un élément à l’état de trace dans l’eau de mer, que l’on trouve à des concentrations de parties par trillion, et pourtant, si l’on pouvait extraire tout l’or contenu dans seulement un km3 d’eau de mer, il vaudrait environ 20 millions de dollars !
Tableau 5.3.2 Concentrations de quelques éléments mineurs dans l’eau de mer
| g/kg dans l’… eau de mer | g/kg en eau de mer | ||
|---|---|---|---|
| Carbone | 0.028 | Ferron | 2 x 10-6 |
| Azote | 0,0115 | Manganèse | 2 x 10-7 | Oxygène | 0.006 | Cuivre | 1 x 10-7 |
| Silicium | 0.002 | Mercure | 3 x 10-8 |
| Phosphore | 6 x 10-5 | Or | 4 x 10-9 | Uranium | 3.2 x 10-6 | Le plomb | 5 x 10-10 |
| Aluminium | 2 x 10-6 | Radon | 6 x 10-.19 |
Parce que les six ions majeurs de l’eau de mer comprennent plus de 99% de la salinité totale, les changements d’abondance des constituants mineurs ont peu d’effet sur la salinité globale. En outre, la règle des proportions constantes stipule que même si la salinité absolue de l’eau de l’océan peut différer en différents endroits, les proportions relatives des six ions majeurs dans cette eau sont toujours constantes. Par exemple, quelle que soit la salinité totale d’un échantillon d’eau de mer, 55% de la salinité totale sera due au chlorure, 30% au sodium, et ainsi de suite. Comme la proportion de ces ions majeurs ne change pas, nous les appelons des ions conservateurs.
Vu ces proportions constantes, pour calculer la salinité totale, vous pouvez simplement mesurer la concentration d’un seul des ions majeurs et utiliser cette valeur pour calculer le reste. Traditionnellement, le chlorure est l’ion mesuré car il est le plus abondant, et donc le plus simple à mesurer avec précision. En multipliant la concentration de chlorure par 1,8, on obtient la salinité totale. Par exemple, en regardant la figure 5.3.1, 19,25 g/kg (ppt) de chlorure x 1,8 = 35 ppt. Aujourd’hui, pour des mesures rapides de la salinité, on utilise souvent la conductivité électrique plutôt que de déterminer les concentrations de chlorure (voir encadré ci-dessous).
Il existe un certain nombre de méthodes pour mesurer la salinité de l’eau. Les mesures les plus précises utilisent l’analyse chimique directe de l’eau de mer en laboratoire, mais il existe un certain nombre de moyens d’obtenir des mesures de salinité immédiates sur le terrain. Pour une estimation rapide de la salinité, on peut utiliser un réfractomètre à main (à droite).

Cet instrument mesure le degré de courbure, ou de réfraction, des rayons lumineux lorsqu’ils traversent un fluide. Plus la quantité de sels dissous dans l’échantillon est importante, plus le degré de réfraction de la lumière est élevé. L’observateur dépose une goutte d’eau sur l’écran bleu et regarde à travers l’oculaire. La ligne de séparation entre les sections bleue et blanche de l’échelle (en médaillon) peut être utilisée pour lire la salinité.
Pour des mesures plus précises, la plupart des océanographes utilisent un instrument qui mesure la conductivité électrique. On fait passer un courant électrique entre deux électrodes immergées dans l’eau, et plus la salinité est élevée, plus le courant sera facilement conduit (les ions présents dans l’eau de mer conduisent les courants électriques). Les sondes de conductivité sont souvent regroupées dans un instrument appelé CTD, qui signifie Conductivité, Température et Profondeur, qui sont les paramètres les plus couramment mesurés. Les CTD modernes peuvent être équipés d’une série de sondes mesurant des paramètres tels que la lumière, la turbidité (clarté de l’eau), les gaz dissous, etc. Les CTD peuvent être de grands instruments (ci-dessous), mais de petites sondes de salinité portatives sont également largement disponibles.

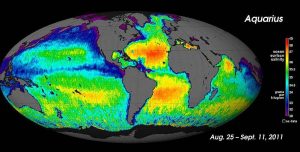
Pour les mesures de salinité à grande échelle, les océanographes peuvent utiliser des satellites, comme le satellite Aquarius, qui a pu mesurer des différences de salinité de surface aussi petites que 0,2 PSU en cartographiant la surface de l’océan tous les sept jours (ci-dessous).
Il est important de savoir que si la règle des proportions constantes s’applique à la majeure partie de l’océan, il peut y avoir certaines zones côtières où beaucoup de débit fluvial peut modifier légèrement ces proportions. En outre, il est important de se rappeler que la règle des proportions constantes ne s’applique qu’aux ions majeurs. Les proportions des ions mineurs peuvent fluctuer, mais n’oubliez pas qu’ils ne contribuent que très peu à la salinité globale. Comme les concentrations des ions mineurs ne sont pas constantes, on parle d’ions non conservateurs.
Pourquoi les ions majeurs se retrouvent-ils en proportions constantes ? Il y a un apport constant d’ions provenant du ruissellement des rivières et d’autres processus, généralement dans des proportions très différentes de celles que l’on trouve dans l’océan. Alors pourquoi les proportions dans les océans ne changent-elles pas ? La plupart des ions rejetés par les rivières ont des temps de résidence assez faibles (voir section 5.2) par rapport aux ions présents dans l’eau de mer, généralement parce qu’ils sont utilisés dans des processus biologiques. Ces faibles temps de résidence ne permettent pas aux ions de s’accumuler et de modifier la salinité. En outre, le temps de mélange de l’océan mondial est d’environ 1 000 ans, ce qui est très court par rapport aux temps de résidence des principaux ions, qui peuvent atteindre des dizaines de millions d’années. Ainsi, pendant le temps de résidence d’un seul ion, l’océan s’est mélangé de nombreuses fois, et les ions majeurs se sont répartis uniformément dans tout l’océan.
Variations de la salinité
La salinité totale en haute mer est en moyenne de 33-37 ppt, mais elle peut varier de manière significative en différents endroits. Mais comme les proportions d’ions majeurs sont constantes, les différences régionales de salinité doivent être dues davantage à l’apport et au retrait d’eau qu’à l’ajout ou au retrait d’ions. L’apport d’eau douce provient de processus tels que les précipitations, le ruissellement terrestre et la fonte des glaces. L’élimination de l’eau douce provient principalement de l’évaporation et de la congélation (lorsque l’eau de mer gèle, la glace qui en résulte est principalement constituée d’eau douce et les sels sont exclus, ce qui rend l’eau restante encore plus salée). Les différences de taux de précipitation, d’évaporation, de débit fluvial et de formation de glace jouent donc un rôle important dans les variations régionales de salinité. Par exemple, la mer Baltique a une très faible salinité de surface d’environ 10 ppt, parce qu’il s’agit d’une masse d’eau essentiellement fermée avec de nombreux apports fluviaux. À l’inverse, la mer Rouge est très salée (environ 40 ppt), en raison du manque de précipitations et de l’environnement chaud qui entraîne des niveaux élevés d’évaporation.
L’une des grandes étendues d’eau les plus salées de la planète est la mer Morte, entre Israël et la Jordanie. La salinité de la mer Morte est d’environ 330 ppt, ce qui est presque dix fois plus salé que l’océan. Cette salinité extrêmement élevée est le résultat des conditions chaudes et arides du Moyen-Orient, qui entraînent des taux d’évaporation élevés. En outre, dans les années 1950, le débit du Jourdain a été détourné de la mer Morte, de sorte qu’il n’y a plus d’apport significatif d’eau douce. En l’absence d’apport et en raison de l’évaporation élevée, le niveau d’eau de la mer Morte baisse d’environ 1 m par an. La forte salinité rend l’eau très dense, ce qui crée des forces de flottaison qui permettent aux gens de flotter facilement à la surface. Mais la salinité élevée signifie également que l’eau est trop salée pour la plupart des organismes vivants, de sorte que seuls les microbes peuvent y vivre, d’où le nom de mer Morte. Mais aussi salée que soit la mer Morte, elle n’est pas la masse d’eau la plus salée de la planète. Cette distinction appartient actuellement à l’étang Gaet’ale en Éthiopie, avec une salinité de 433 ppt !
Variations latitudinales
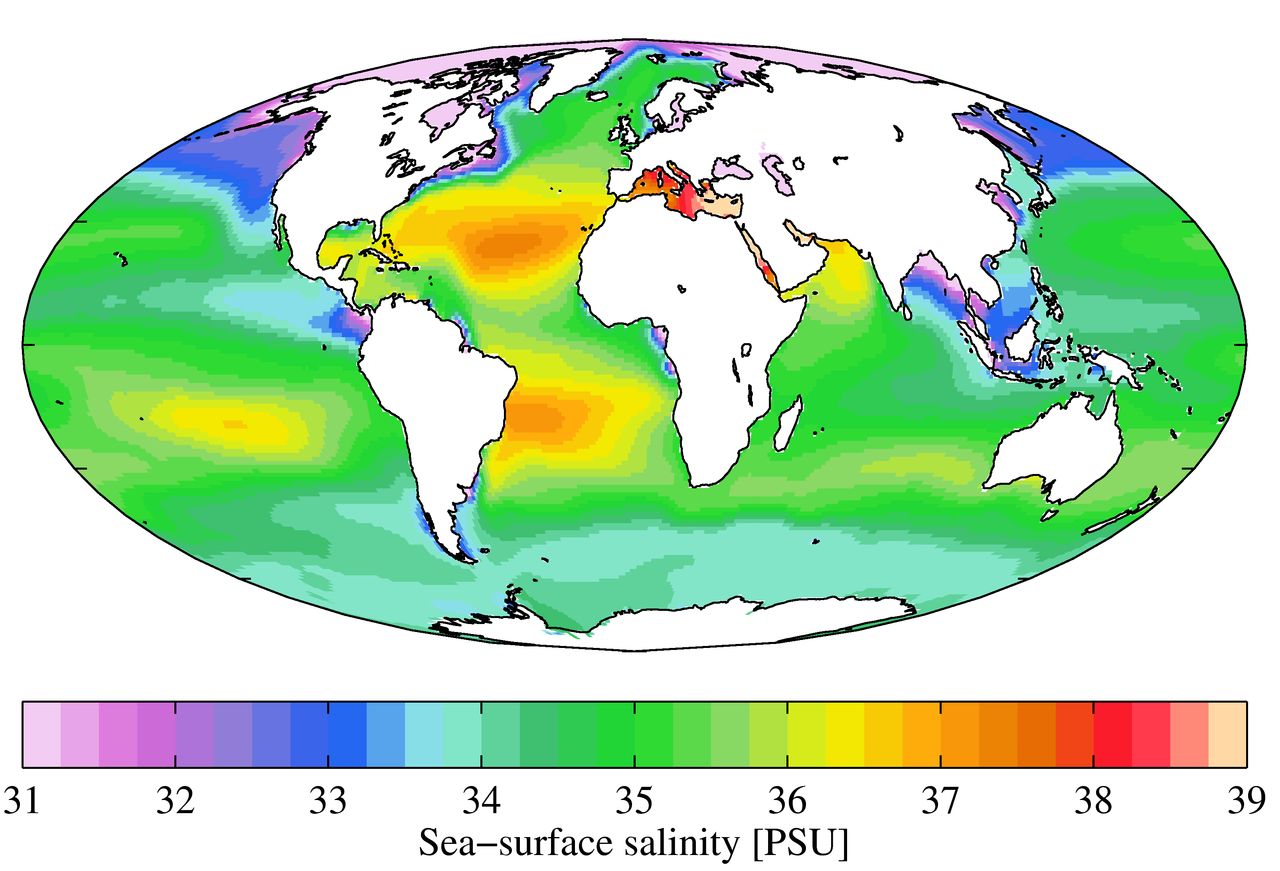
Bien que les conditions locales soient importantes pour déterminer les schémas de salinité dans un seul endroit, il existe certains schémas mondiaux qui méritent d’être étudiés de plus près. La température étant la plus élevée à l’équateur et la plus basse près des pôles, on pourrait s’attendre à des taux d’évaporation plus élevés, et donc à une salinité plus importante, dans les régions équatoriales (figure 5.3.2). C’est généralement le cas, mais dans la figure ci-dessous, la salinité le long de l’équateur semble être un peu plus faible qu’à des latitudes légèrement plus élevées. Cela s’explique par le fait que les régions équatoriales reçoivent régulièrement un volume important de pluie, ce qui dilue l’eau de surface le long de l’équateur. Les salinités les plus élevées se trouvent donc aux latitudes subtropicales, chaudes, avec une forte évaporation et moins de précipitations. Aux pôles, l’évaporation est faible, ce qui, associé à la fonte de la glace et de la neige, produit une salinité de surface relativement faible. L’image ci-dessous montre une salinité élevée dans la mer Méditerranée ; celle-ci est située dans une région chaude avec une forte évaporation, et la mer est largement isolée du mélange avec le reste des eaux de l’Atlantique Nord, ce qui entraîne une salinité élevée. Les salinités plus faibles, comme celles autour de l’Asie du Sud-Est, sont le résultat des précipitations et des volumes élevés d’apports fluviaux.
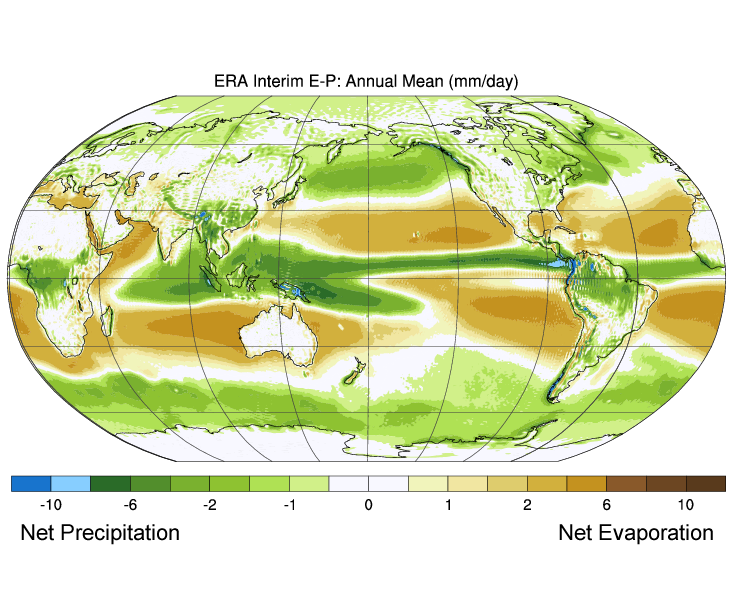
La figure 5.3.3 montre les différences mondiales moyennes entre l’évaporation et les précipitations (évaporation – précipitations). Les couleurs vertes représentent les régions où les précipitations dépassent l’évaporation, tandis que les régions brunes sont celles où l’évaporation est supérieure aux précipitations. Notez la corrélation entre les précipitations, l’évaporation et la salinité de surface, comme on peut le voir sur la figure 5.3.2.
Variation verticale
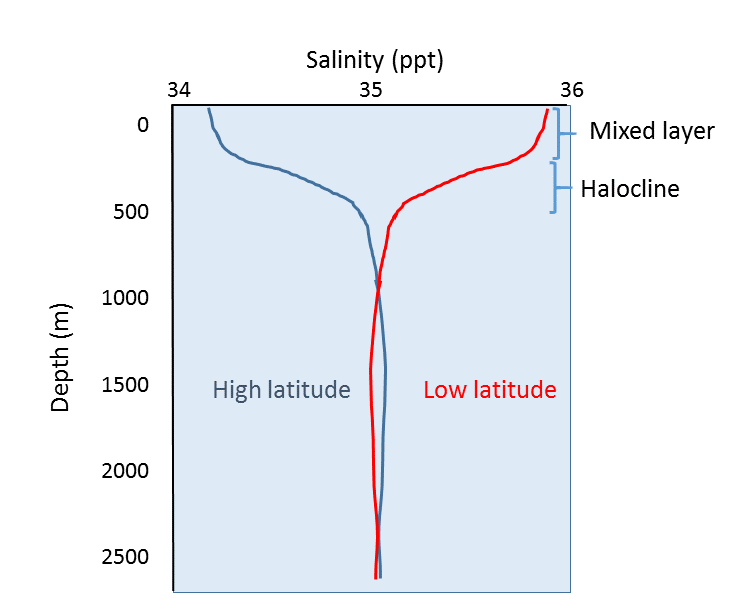
En plus de la variation géographique de la salinité, il existe également des changements de salinité avec la profondeur. Comme nous l’avons vu, la plupart des différences de salinité sont dues aux variations de l’évaporation, des précipitations, du ruissellement et de la couverture de glace. Tous ces processus se produisent à la surface de l’océan, et non en profondeur, de sorte que les différences de salinité les plus prononcées devraient se trouver dans les eaux de surface. La salinité dans les eaux plus profondes reste relativement uniforme, car elle n’est pas affectée par ces processus de surface. La figure 5.3.4 présente quelques profils de salinité représentatifs. À la surface, les quelque 200 m supérieurs présentent une salinité relativement uniforme dans ce qu’on appelle la couche mixte. Les vents, les vagues et les courants de surface brassent l’eau de surface, ce qui entraîne un mélange important dans cette couche et des conditions de salinité relativement uniformes. Sous la couche mixte se trouve une zone de changement rapide de salinité sur une faible variation de profondeur. Cette zone de changement rapide est appelée halocline, et elle représente une transition entre la couche mixte et l’océan profond. Sous l’halocline, la salinité peut présenter peu de variations jusqu’au fond de la mer, car cette région est très éloignée des processus de surface qui ont un impact sur la salinité. Dans la figure ci-dessous, notez la faible salinité de surface aux hautes latitudes, et la salinité de surface plus élevée aux basses latitudes, comme indiqué ci-dessus. Pourtant, malgré les différences en surface, la salinité en profondeur dans les deux endroits peut être très similaire.
un atome ou une molécule qui a gagné ou perdu des électrons et qui est donc devenu chargé (5.1)
la concentration d’ions dissous dans l’eau (5.3)
une mesure sans unité de la salinité égale aux parties par mille (5.3)
les six ions qui constituent plus de 99% des ions de l’océan (chlorure, sodium, sulfate, magnésium, calcium, potassium) (5.3)
les principaux ions de l’eau de mer se retrouvent toujours dans les mêmes proportions, quelle que soit la salinité globale (5.3)
les ions dont les proportions sont les mêmes, quelle que soit la salinité globale ; les ions majeurs de l’eau de mer (5.3)
les ions de l’eau de mer dont les proportions fluctuent avec les changements de salinité (5.3)
écoulement de l’eau le long d’une pente, soit à la surface du sol, soit à l’intérieur d’une série de canaux (12,2)
la durée moyenne pendant laquelle un élément restera dans l’océan avant d’être éliminé (5.2)
parties par mille
la distance au nord ou au sud de l’équateur, mesurée sous forme d’angle par rapport à l’équateur (2.1)
la couche supérieure de l’océan, où les vents, les vagues et les courants mélangent l’eau de sorte que les conditions sont relativement constantes ; environ les 100 m supérieurs (5.3)
où il y a un changement spectaculaire de salinité sur un petit changement de profondeur (5.3)
.