.jpg) La fabrication de l’ammoniac est cruciale pour l’industrie agricole mondiale car c’est à partir de lui que sont produits tous les engrais qui contiennent de l’azote.
La fabrication de l’ammoniac est cruciale pour l’industrie agricole mondiale car c’est à partir de lui que sont produits tous les engrais qui contiennent de l’azote.
Utilisations de l’ammoniac
La fabrication des engrais est de loin l’utilisation la plus importante de l’ammoniac. Il s’agit notamment de l’urée, des sels d’ammonium (phosphates d’ammonium, nitrate d’ammonium, nitrate d’ammonium de calcium) et des solutions d’ammoniac.
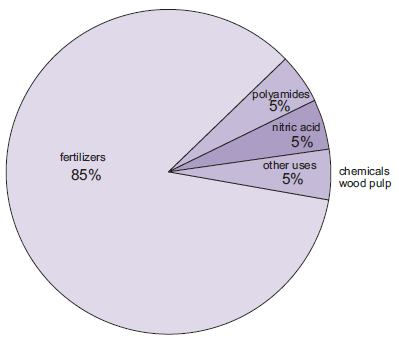
Figure 1 Les utilisations de l’ammoniac.
Une quantité croissante d’ammoniac, bien qu’encore faible par rapport aux autres utilisations, est utilisée comme solution concentrée pour lutter contre les rejets d’oxydes d’azote des centrales électriques.
Production annuelle d’ammoniac
L’ammoniac est, après l’acide sulfurique, le produit chimique dont le tonnage est le plus important. Il est de plus en plus fabriqué dans les pays qui disposent de sources de gaz naturel et de charbon à faible coût (la Chine et la Russie en représentent environ 40%). Les plus grandes usines produisent environ 3 000 tonnes par jour et il est prévu de construire des usines produisant 4 000 à 5 000 tonnes par jour, ce qui signifie que la production mondiale totale pourrait être gérée avec 100 unités de ce type. La production actuelle est de :
| Monde | 146 millions de tonnes |
| Chine | 48 millions de tonnes |
| Russie | 12 millions de tonnes | Inde | 11 millions de tonnes |
| U.S. | 9 millions de tonnes |
| Indonésie | 5 millions de tonnes |
| Trinidad et Tobago | 5 millions de tonnes | Ukraine | 4 millions de tonnes |
Données provenant de :
U.S. Geological Survey, Mineral Commodity Summaries, 2016.
L’augmentation du tonnage d’ammoniac fabriqué ne fait que suivre l’augmentation de la polulation mondiale et l’augmentation de son niveau de vie. On s’attend à ce que la demande d’ammoniac augmente à près de 200 millions de tonnes d’ici 20181.
1. Association internationale des engrais, 2014.
Fabrication de l’ammoniac
La fabrication de l’ammoniac à partir de l’azote et de l’hydrogène se déroule en deux étapes principales :
a) la fabrication de l’hydrogène
b) la synthèse de l’ammoniac (le procédé Haber)
La fabrication de l’hydrogène fait intervenir plusieurs procédés distincts. La figure 2 montre leur séquence et leur localisation dans une usine d’ammoniac (étapes1-5). Le convertisseur utilisé pour fabriquer de l’ammoniac à partir de l’hydrogène est également représenté (étape 6). Ce qui se passe dans chacune de ces étapes est décrit sous la figure.
|
Figure 2 Une usine d’ammoniac en Australie occidentale : 1 Unités de désulfuration |
.jpg) |
a) La fabrication de l’hydrogène
L’hydrogène est produit à partir de diverses matières premières, principalement à partir de gaz naturel, de charbon ou de naphte. Les modes d’obtention de l’hydrogène à partir de ces matières premières sont traités séparément.
Hydrogène à partir de gaz naturel (méthane)
Cela implique deux étapes :
i) la fabrication du gaz de synthèse (un mélange de monoxyde de carbone et d’hydrogène (reformage à la vapeur))
ii) l’élimination du monoxyde de carbone et la production d’un mélange d’hydrogène et d’azote (la réaction de décalage)
(i) La fabrication du gaz de synthèse
Quelle que soit la manière dont le méthane est obtenu, il contiendra certains composés organiques soufrés et du sulfure d’hydrogène, qui doivent tous deux être éliminés. Sinon, ils empoisonneront le catalyseur nécessaire à la fabrication du gaz de synthèse. Dans l’unité de désulfuration, les composés organiques du soufre sont souvent d’abord convertis en sulfure d’hydrogène, avant de réagir avec l’oxyde de zinc. La charge est mélangée à de l’hydrogène et passée sur un catalyseur d’oxydes mixtes de cobalt et de molybdène sur un support inerte (une alumine spécialement traitée) à environ 700 K.
.jpg)
Puis on fait passer les gaz sur de l’oxyde de zinc à ca 700 K et on élimine l’hydrogène sulfuré :
.jpg)
Le reformage primaire à la vapeur transforme le méthane et la vapeur en gaz de synthèse, un mélange de monoxyde de carbone et d’hydrogène :
.jpg)
Des températures élevées et de faibles pressions favorisent la formation des produits (principe de Le Chatelier). En pratique, les réactifs passent sur un catalyseur de nickel, finement divisé à la surface d’un support d’oxyde de calcium/oxyde d’aluminium contenu dans des tubes verticaux en alliage de nickel. Les tubes, jusqu’à 350 en parallèle, sont chauffés dans un four à plus de 1000 K et sous une pression d’environ 30 atm. Ceci est un exemple de réacteur tubulaire.
Le reformage secondaire à la vapeur fait réagir l’oxygène de l’air avec une partie de l’hydrogène présent et le mélange résultant passe sur un catalyseur en nickel. La vapeur et la chaleur produites par la combustion reforment la majeure partie du méthane résiduel. Parmi les réactions clés figurent :
small.jpg)
Le gaz émergeant de cette étape exothermique nette est à environ 1200 K et est refroidi dans des échangeurs de chaleur. La vapeur formée à partir de l’eau utilisée pour refroidir les gaz est utilisée pour faire fonctionner les turbines et donc les compresseurs et pour préchauffer les réactifs.
Certaines conceptions récentes utilisent directement la chaleur résiduelle du reformeur secondaire pour fournir de la chaleur au reformeur primaire.
A ce stade, le gaz contient de l’hydrogène, de l’azote, du monoxyde et du dioxyde de carbone et environ 0,25% de méthane. Comme l’air contient 1% d’argon, celui-ci s’accumule également dans le gaz de synthèse.
(ii) La réaction de décalage
Ce procédé convertit le monoxyde de carbone en dioxyde de carbone, tout en générant plus d’hydrogène.
Il se déroule en deux étapes. Dans la première, la réaction de décalage à haute température, le gaz est mélangé à de la vapeur et passé sur un catalyseur d’oxyde de fer/chrome(III) à environ 700 K dans un réacteur à lit fixe. Cela permet de diminuer la concentration en monoxyde de carbone de 11 % :
.jpg)
Dans la deuxième étape, la réaction de décalage à basse température, le mélange de gaz passe sur un catalyseur cuivre-zinc à environ 500 K. La concentration en monoxyde de carbone est encore réduite à 0,2 %.
La réaction se fait en deux étapes pour plusieurs raisons. La réaction est exothermique. Cependant, à haute température, la concentration de monoxyde de carbone à la sortie est encore assez élevée, en raison du contrôle de l’équilibre. Le catalyseur au cuivre utilisé dans l’étape à basse température est très sensible aux températures élevées et ne pourrait pas fonctionner efficacement dans l’étape à haute température. Ainsi, la majeure partie de la réaction est réalisée à haute température pour récupérer la plus grande partie de la chaleur. Le gaz est ensuite éliminé à basse température, où l’équilibre est beaucoup plus favorable, sur le catalyseur de cuivre très actif mais instable.
Le mélange gazeux contient maintenant environ 18% de dioxyde de carbone qui est éliminé par lavage du gaz avec une solution d’une base, en utilisant une des plusieurs méthodes disponibles. Celle qui est privilégiée est une base organique (dans l’absorbeur de dioxyde de carbone), une solution d’une éthanolamine, souvent du 2,2′-(méthylimino)bis-éthanol (N-méthyl diéthanolamine).
Le dioxyde de carbone est libéré en chauffant la solution dans le stripper de dioxyde de carbone). Une grande partie est liquéfiée et vendue, par exemple, pour les boissons gazeuses, comme liquide de refroidissement pour les centrales nucléaires et pour favoriser la croissance des plantes dans les serres.
Les dernières traces d’oxydes de carbone sont éliminées en faisant passer les gaz sur un catalyseur au nickel à 600 K :
.jpg)
Ce procédé est connu sous le nom de méthanation. On obtient un gaz de composition typique : 74% d’hydrogène, 25% d’azote, 1% de méthane, ainsi qu’un peu d’argon.
Hydrogène à partir de naphta
Si le naphta est utilisé comme charge d’alimentation, une étape supplémentaire de reformage est nécessaire. Le naphta est chauffé pour former une vapeur, mélangé à de la vapeur et passé dans des tubes, chauffés à 750 K et emballés avec un catalyseur, du nickel supporté sur un mélange d’oxydes d’aluminium et de magnésium. Le produit principal est du méthane accompagné d’oxydes de carbone, et il est ensuite traité par reformage à la vapeur, comme s’il s’agissait de gaz naturel, suivi de la réaction de shift.
Hydrogène à partir du charbon
Si l’on utilise du charbon, il est d’abord finement broyé et chauffé dans une atmosphère d’oxygène et de vapeur. Une partie du charbon brûle très rapidement dans l’oxygène (en moins de 0,1 s) provoquant l’augmentation de la température dans le four et le reste du charbon réagit avec la vapeur d’eau :
.jpg)
Le gaz émis contient environ 55% de monoxyde de carbone, 30% d’hydrogène, 10% de dioxyde de carbone et de petites quantités de méthane et d’autres hydrocarbures. Ce mélange est traité par la réaction de décalage.
Les principaux problèmes liés à l’utilisation du charbon comprennent les grandes quantités de dioxyde et de trioxyde de soufre générées par la combustion du charbon et les quantités importantes d’autres impuretés telles que l’arsenic et le brome, qui sont toutes très nocives pour l’atmosphère et qui sont toutes de graves poisons pour les catalyseurs du processus. L’élimination des cendres pose également un problème massif.
Hydrogène à partir de la biomasse
Le gaz de synthèse peut être produit à partir de la biopmasse. Le procédé est décrit dans l’unité sur les bioraffineries.
(b) La fabrication d’ammoniac (Le procédé Haber)
.jpg)
Le cœur du procédé est la réaction entre l’hydrogène et l’azote dans un réacteur à lit fixe. Les gaz, en proportions stœchiométriques, sont chauffés et passés sous pression sur un catalyseur (figure 3).
.jpg)
Figure 3 Schéma illustrant un réacteur de synthèse classique (un convertisseur).
La proportion d’ammoniac dans le mélange d’équilibre augmente avec l’augmentation de la pression et avec la baisse de la température (principe de Le Chatelier). Les données quantitatives sont indiquées dans le tableau 1. Pour obtenir un rendement raisonnable et un taux favorable, on utilise des pressions élevées, des températures modérées et un catalyseur.
| Pression/atm | Pourcentage d’ammoniac présent à l’équilibre à une gamme de températures | 373 K | 473 K | 573 K | 673 K | 773 K | 973 K |
|---|---|---|---|---|---|---|
| 10 | – | 50.7 | 14,7 | 3,9 | 1.2 | 0,2 |
| 25 | 91,7 | 63,6 | 27.4 | 8,7 | 2,9 | – |
| 50 | 94.5 | 74,0 | 39,5 | 15,3 | 5.6 | 1,1 |
| 100 | 96.7 | 81,7 | 52,5 | 25,2 | 10.6 | 2,2 |
| 200 | 98,4 | 89.0 | 66,7 | 38,8 | 18.3 | – |
| 400 | 99.4 | 94,6 | 79,7 | 55.4 | 31,9 | – |
| 1000 | – | 98.3 | 92,6 | 79,8 | 57,5 | 12.9 |
Tableau 1 Pourcentage, en volume, d’ammoniac dans le mélange d’équilibre pour la réaction
entre l’azote et l’hydrogène dans une gamme de températures et de pressions.
Un large éventail de conditions est utilisé, selon la construction du réacteur. Les températures utilisées varient entre 600 et 700 K, et les pressions entre 100 et 200 atmosphères. De nombreux travaux sont menés pour améliorer l’efficacité du catalyseur afin de pouvoir utiliser des pressions aussi basses que 50 atmosphères.
Comme la réaction est exothermique, des réactifs froids (azote et hydrogène) sont ajoutés pour réduire la température des réacteurs (figure 3).
L’ammoniac est généralement stocké sur place (étape 7) et pompé vers une autre partie de l’usine où il est transformé en engrais (urée ou sel d’ammonium). Cependant, il est parfois transporté par mer (figure 4) ou par route, pour être utilisé dans une autre usine.
.jpg) |
Figure 4 Dans une usine d’Australie occidentale, l’ammoniac est transféré par pipeline jusqu’à un port voisin (figure 2, étape 8) et transporté par navire. Celui-ci transporte environ 40 000 tonnes d’ammoniac liquéfié. Avec l’aimable autorisation de Yara International ASA. |
Le catalyseur original utilisé par Haber était Fe3O4, qui était réduit en fer par le réactif, l’hydrogène. De nombreux travaux ont été réalisés pour améliorer le catalyseur et on a découvert qu’une petite quantité d’hydroxyde de potassium était efficace comme promoteur.
Récemment, la recherche s’est concentrée sur la découverte de catalyseurs encore plus efficaces pour permettre au processus d’avoir lieu à des pressions et des températures plus basses. Le ruthénium sur une surface de graphite est prometteur.
.jpg)
Figure 5 La production d’ammoniac.
Postscript
Le procédé Haber est d’une telle importance pour notre vie qu’il a figuré dans trois prix Nobel de chimie, tous attribués à des scientifiques allemands, sur une période de près de 90 ans, un record remarquable.
Le premier a été attribué en 1918, à Fritz Haber, le chimiste qui a développé le procédé en laboratoire. Le second a été attribué à Carl Bosch, dont les brillantes compétences en ingénierie ont rendu le procédé viable à grande échelle, mais qui a attendu 1931 pour recevoir son prix.
En 2007, Gerhard Ertl a reçu le prix pour ses travaux sur la catalyse des réactions gazeuses sur les solides. Parmi le large éventail de réactions qu’il a étudiées, il a obtenu la preuve de l’adsorption de molécules d’azote et de molécules d’hydrogène sur la surface du fer et que ces molécules adsorbées se dissocient en atomes. Ces atomes s’assemblent ensuite par étapes pour former la molécule d’ammoniac. Il faut se rappeler que les conditions utilisées dans ces études (à moins de 10-10 atm) sont très différentes des conditions utilisées dans l’industrie, environ 150 atm.
Résumé
L’ensemble du processus de production d’ammoniac à partir du méthane est résumé dans la figure 5. Si le charbon ou le naphta est la charge d’alimentation, des processus supplémentaires sont nécessaires. Le naphta est converti en méthane et en oxydes de carbone avant d’être envoyé dans le reformeur primaire, puis dans la réaction de conversion. Le charbon est également converti en hydrogène et en oxydes de carbone et ce mélange subit ensuite la réaction de décalage.