Le tableau périodique est un arrangement tabulaire des éléments chimiques, classés par numéro atomique, configurations électroniques et propriétés chimiques récurrentes. Cet ordre montre les tendances périodiques, comme les éléments ayant un comportement similaire dans la même colonne. En général, au sein d’une rangée (période), les éléments sont des métaux à gauche, et des non-métaux à droite.
Le tableau périodique est l’un des symboles les plus emblématiques de la science, il résume une grande partie des connaissances de la chimie. Dans toutes ses versions, il est présent dans les salles de classe et les laboratoires du monde entier. Aucune autre discipline ne dispose d’un document similaire.
Le système périodique, développé dans la seconde moitié du XIXe siècle, a fourni un arrangement systématique des éléments en groupes naturels. La portée de cet arrangement a permis de prédire avec une grande certitude les propriétés de certains éléments inconnus et les composés probables qu’ils forment. Les développements ultérieurs ont fourni la base théorique du tableau périodique actuel. Le grand nombre d’éléments connus et de substances synthétisées a créé un besoin urgent de les classer.
Un peu d’histoire sur le tableau périodique
Au début de 1812, le chimiste allemand John W. Döbereiner a tenté une première approximation en classant les éléments découverts en groupes de trois. Cette classification consistait à les regrouper par ordre croissant en fonction de leur masse atomique.
En 1860, le Français Alexandre Béguyer (géologue français) vérifie une certaine périodicité des éléments en comparant leurs tailles et leurs propriétés physiques. Dans ses études, il a vérifié une séquence logique entre les grandeurs et les propriétés observées dans les atomes et leurs tailles et abondances respectives.
En 1864, Julius Lothar Meyer a publié la première version du tableau périodique et plus tard, le chimiste russe Dmitri Ivanovitch Mendeleïev a énoncé et publié la loi périodique et le tableau périodique des éléments chimiques.

Dmitri Ivanovitch Mendeleev
La capacité de prédiction de Mendeleev était brillante ; Non seulement il a énoncé la loi de la périodicité chimique, mais il a également ordonné les éléments trouvés et gardé une place pour ceux qui n’avaient pas encore été découverts, prédisant même leurs propriétés physiques et chimiques.
Le tableau périodique aujourd’hui
Le comportement des atomes est déterminé par leur configuration électronique, la répartition des électrons dans le niveau le plus externe déterminant leur réactivité et leur nature chimique. Pour cette raison, les éléments qui possèdent une distribution électronique similaire présenteront des propriétés chimiques similaires.
Les propriétés des atomes se reproduisent périodiquement si les éléments chimiques sont ordonnés selon leur numéro atomique croissant (Z).
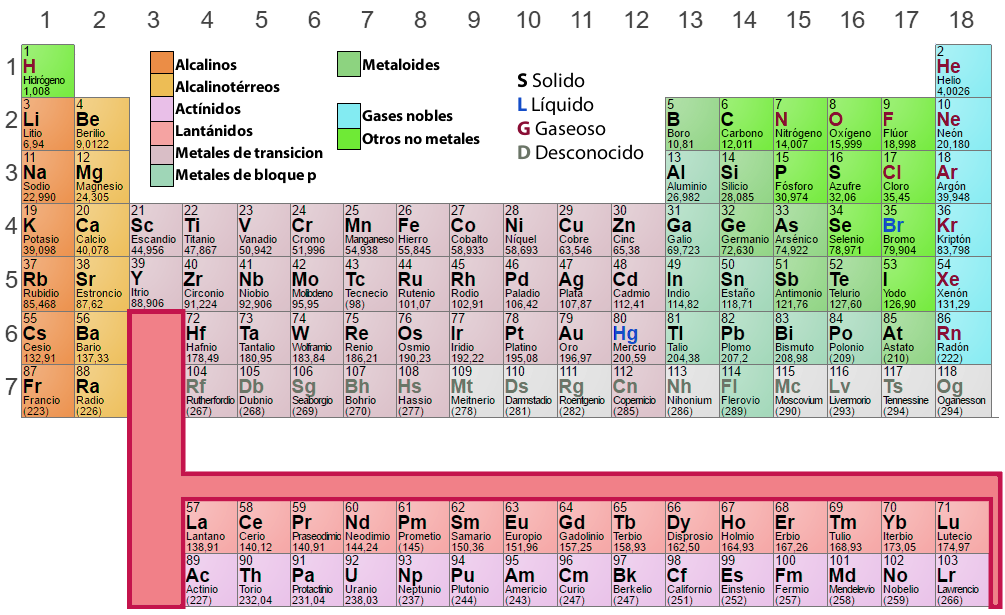
Analyse du tableau périodique
Dans le tableau périodique, les éléments qui ont une configuration électronique similaire dans la coquille externe sont disposés dans les mêmes colonnes (Groupes ou Familles). Les éléments qui ont des niveaux d’énergie identiques sont rangés sur les mêmes lignes (Périodes).
Groupes ou familles
C’est un classement vertical des éléments du tableau périodique, selon des propriétés chimiques similaires. La numérotation traditionnelle des dix-huit colonnes est I A, II A, III A, IV A, etc., comme nous le voyons dans le tableau périodique ci-dessus. Aujourd’hui, l’UICPA (Union internationale de chimie pure et appliquée) recommande une numérotation successive, à savoir : 1, 2, 3, 4, 5, etc. Il est important de considérer les éléments suivants :
- L’hydrogène (H), bien qu’apparaissant dans le groupe IA (1), n’est pas un métal alcalin. Au contraire, l’hydrogène
est si différent des autres éléments chimiques que certaines classifications préfèrent le placer en dehors du
tableau. - Les groupes A sont les plus importants du tableau, leurs éléments sont dits représentatifs.
- Les éléments des groupes III B, IV B, V B, VI B, VII B, VIII B, I B et II B constituent les éléments dits de transition
. Notez que le groupe VIII B est un groupe triple. - Une autre séparation importante que nous pouvons faire dans le tableau périodique est celle dans laquelle nous divisons les
éléments en métaux, non-métaux et gaz nobles.
Les éléments d’un même groupe possèdent des propriétés chimiques similaires et sont caractérisés par un nombre égal d’électrons dans le dernier niveau d’énergie. Chaque élément d’un groupe est placé dans des périodes différentes et pour les désigner on note avec des chiffres romains (I, II, III, IV, etc.) le nombre d’électrons dans le dernier niveau, suivi d’une lettre (A ou B) qui identifie sa nature et les types d’orbitales qu’il présente.
Périodes
Les sept lignes ou rangées horizontales qui apparaissent dans le tableau périodique sont appelées périodes, il est important de le noter :
- Dans la sixième période, la troisième grille enferme 15 éléments (du lanthane au lutécium) qui, pour des raisons de commodité, sont indiqués sur une ligne sous le tableau ; en commençant par le lanthane, ces éléments forment la série dite des lanthanides.
- Analogiquement, dans la septième période, la troisième grille renferme également 15 éléments chimiques (de l’actinium au laurentium), qui sont indiqués sur la deuxième ligne sous le tableau. En commençant par l’actinium, ils forment la série des actinides.
- Il faut noter que tous les éléments après l’uranium (U-92) n’existent pas dans la nature, devant être synthétisés artificiellement. Ils sont appelés éléments transuraniens. En dehors de ces éléments, le technétium (Tc-43), le prométhium (Pm-61) et l’astate (As-85) sont également synthétisés artificiellement.
Les éléments de même période ont le même nombre de niveaux d’énergie avec des électrons. Les périodes sont numérotées en tenant compte de la valeur du niveau d’énergie le plus éloigné. Chaque période commence par un métal alcalin et se termine par un gaz noble, à l’exception du premier niveau, où se trouve l’hydrogène.
Éléments du système périodique
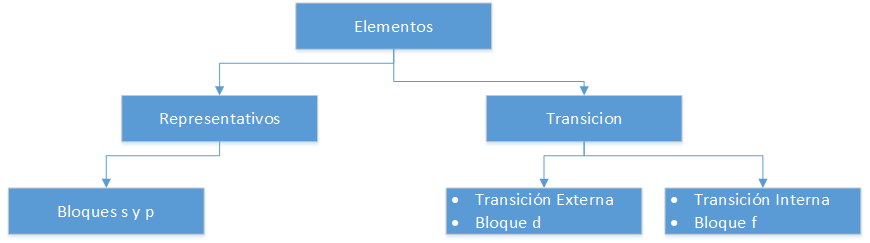
Éléments représentatifs
Ils correspondent aux groupes A du tableau périodique. Ils ne respectent pas la règle de l’octuor, c’est-à-dire que leur dernier niveau d’énergie est inférieur à 8 électrons. Ainsi par exemple, les atomes des éléments représentatifs appartenant au groupe III A, comme l’Aluminium (Al), ont 3 électrons de valence dans leur dernière coquille, c’est-à-dire qu’ils ont des orbitales p incomplètes (p1 à p6).
Les éléments des groupes IA à VA, ont tendance à céder des électrons pour atteindre la configuration de gaz rare la plus proche (ns2 np6). En revanche, les éléments des groupes VI A et VII A, capturent des électrons pour atteindre la configuration de gaz noble la plus proche.
| Groupe | Nom | Configuration électronique | |
|---|---|---|---|
| Alkaline | ns1 | ||
| IIA | A. | ns2np2 | VA | Nitrogène | ns2np3 | VIA | Calcogène | ns2np4 |
| VIA | Calcogène | ns2np4 | |
| VIIA | Halogènes | ns2np5 | 0 | Gaz nobles | ns2np6 |
Éléments de transition externes
Ils sont placés dans les groupes B du système périodique. Les éléments appartenant à cette classification possèdent des orbitales d (d1 à d10) dans leur dernier niveau d’énergie.
Les éléments de transition internes
Ils sont situés dans la partie inférieure du tableau périodique, ils sont aussi appelés terres rares. Leur principale caractéristique est qu’ils possèdent des orbitales f (f1 à f14) dans leur dernier niveau d’énergie.
Nature des éléments
Gaz nobles
- Colonne 18 du tableau périodique.
- Groupe VIII ou 0.
- Ils ont la particularité d’avoir tous leurs niveaux électroniques complets.
- Configuration électronique de type ns2p6, ns2 (Hélium).
- Dans des conditions normales, ils sont chimiquement inertes (très peu réactifs).
Éléments métalliques
- Ils sont presque tous solides (à température ambiante), à l’exception du Mercure, du Césium et du Rubidium.
- Ils sont de très bons conducteurs de courant électrique.
- Ils perdent facilement des électrons, devenant des cations stables.
- Ils ont un éclat métallique et sont de très bons conducteurs de chaleur.
- Ils sont ductiles, c’est-à-dire que sous l’action d’une force, ils peuvent se déformer sans se rompre.
- Ils sont malléables, c’est-à-dire que leur capacité à se déformer permet de les utiliser pour fabriquer des feuilles.
Éléments non métalliques
.