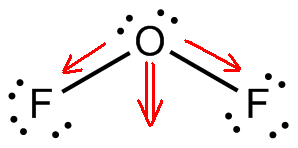
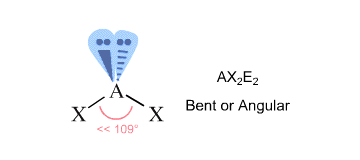Le difluorure d’oxygène, # »OF »_2#, est une molécule polaire parce qu’elle a une géométrie moléculaire courbée.
Cette géométrie moléculaire garantit que les moments dipolaires associés aux liaisons oxygène – fluorure ne s’annulent pas pour produire une molécule non polaire.
Pour voir pourquoi c’est le cas, dessinez la structure de Lewis de la molécule. La molécule aura un total de #20# électrons de valence
- 6# de l’atome d’oxygène
- 7# de chacun des deux atomes de fluor
L’atome d’oxygène jouera le rôle d’atome central, formant des liaisons simples avec les deux atomes de fluor. Ces liaisons représenteront #4# des #20# électrons de valence de la molécule.
Les #16# électrons résultants seront placés sous forme de paires solitaires
- trois paires solitaires sur chaque atome de fluor
- deux paires solitaires sur l’atome d’oxygène
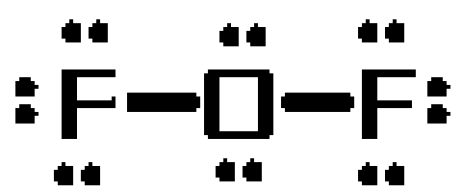
Maintenant, il est très important de réaliser que les structures de Lewis ne sont pas destinées à transmettre la géométrie moléculaire !
Pour trouver la géométrie de la molécule, vous comptez les régions de densité électronique qui entourent l’atome central – celles-ci vous donneront le nombre stérique de l’atome.
Les régions de densité électronique sont les liaisons avec d’autres atomes (ici, les liaisons simples, doubles ou triples comptent pour une seule région) et les paires d’électrons solitaires.
Dans votre cas, l’atome d’oxygène central est lié à deux autres atomes et est entouré de deux paires solitaires #-># il a un nombre stérique égal à #4#.
Selon la théorie VSEPR, cela correspond à une géométrie moléculaire # »AX »_2 « E »_2#, ce qui est caractéristique d’une molécule coudée.
Maintenant , la différence d’électronégativité entre le fluor et l’oxygène fait que les deux liaisons # »O »-« F « # sont polaires. La géométrie moléculaire courbée fera en sorte que les deux moments dipolaires s’ajoutent l’un à l’autre.
Le résultat sera la formation d’un moment dipolaire permanent, et donc une molécule polaire
.