Introduction
| Classe de salinité | S |
| Hyperhaline | > 65 |
| Métahaline | 45-65 |
| Euhaline | 30-35 |
| Polyhaline | 18-30 |
| Mésohaline | 5-18 |
| Oligohaline | 0.5-5 |
La salinité de l’eau de mer est définie comme la quantité totale en poids de sels dissous dans un kilogramme d’eau de mer. La salinité est exprimée dans l’unité g / kg, qui s’écrit souvent ppt (partie par mille) ou ‰ (permil). Les sels dissous dans l’eau de mer sont dissociés en leurs ions ; les ions prédominants sont le chlorure et le sodium ; les autres ions importants sont le magnésium, le sulfate, le calcium et le potassium. Au fil des ans, diverses méthodes ont été mises au point pour déterminer la salinité. La méthode la plus pratique actuellement utilisée est celle de la conductivité électrique. Comme il s’agit d’une méthode indirecte, une relation précise a été établie entre la conductivité et la salinité. La salinité déterminée de cette manière est une quantité sans dimension appelée salinité pratique. Selon l’échelle de salinité pratique, l’eau de mer « standard » typique a une salinité de 35. Afin d’obtenir une meilleure cohérence avec la thermodynamique de l’eau de mer, une nouvelle échelle de salinité a été introduite en 2010, appelée échelle de salinité absolue. La petite correction numérique de l’échelle de salinité pratique que cela implique n’a pas une grande importance pratique pour les eaux côtières, où elle est éclipsée par la forte variabilité de la salinité dans l’espace et le temps. En revanche, une grande précision est nécessaire pour l’océan, car de petites différences de salinité peuvent être très pertinentes pour la circulation océanique à grande échelle et la caractérisation des masses d’eau.
L’eau de mer est plus dense que l’eau douce en raison du poids supplémentaire des sels dissous ; la relation entre salinité et densité est traitée dans l’article Densité de l’eau de mer). Cet article donne un aperçu des différentes échelles de salinité. Les capteurs utilisés pour les mesures de conductivité sont abordés dans l’article Capteurs de salinité.
Mesures et définitions de la salinité à travers l’histoire
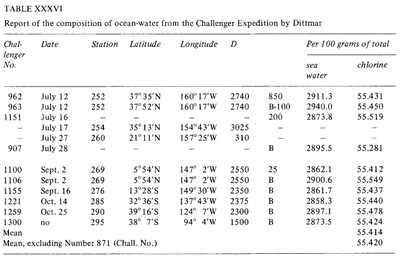
Constance de la composition de l’eau de mer (Dittmar, 1884)
Depuis l’époque de la Grèce antique, on a tenté de mesurer la « salinité » de l’eau de mer. Cependant, ces premières méthodes n’étaient pas très efficaces et leur sensibilité et leur répétabilité étaient très limitées. Au cours de l’histoire moderne, des méthodologies plus précises ont été développées : pesée après évaporation (Boyle, 1693 ; Birch, 1965), extraction par solvant (Lavoisier, 1772) et précipitation (Bergman, 1784). En 1865, Forchhammer a introduit le terme de salinité et s’est attaché à mesurer les composants individuels du sel marin plutôt que la salinité totale. Il a découvert que le rapport entre les principaux sels dans des échantillons d’eau de mer provenant de divers endroits était constant. Ce rapport constant est connu sous le nom de principe de Forchhammer, ou principe des proportions constantes. Vers la fin du XIXe siècle, William Dittmar, suivant les travaux de Forchhammer, a testé plusieurs méthodes pour analyser la salinité et la composition chimique de l’eau de mer. Les méthodes de Dittmar pour l’analyse chimique de l’eau de mer étaient extrêmement précises. Dittmar a analysé la teneur en chlore de l’eau de mer en utilisant la précipitation du chlorure par le nitrate d’argent, et l’a comparée à des échantillons d’eau de mer préparés synthétiquement pour évaluer la précision de la méthode. Il a ensuite analysé 77 échantillons prélevés dans le monde entier lors de l’expédition Challenger et a constaté la même constance de composition que celle observée par Forchhammer : « bien que la concentration des eaux soit très différente, la composition en pourcentage de la matière dissoute est presque la même dans tous les cas ». .
Définition de la salinité 1902
Avec des techniques plus précises pour mesurer la salinité, il était nécessaire d’avoir la même définition de la salinité et des méthodes de mesure dans toute la communauté scientifique. En 1889, Martin Knudsen a été nommé par le CIEM pour présider une commission chargée de traiter les questions de salinité. Il a formulé la définition suivante :
« La salinité est la quantité totale de matières solides, en grammes, dissoutes dans un kilogramme d’eau de mer lorsque tous les carbonates ont été convertis en oxyde, le brome et l’iode remplacés par le chlore et toutes les matières organiques complètement oxydées.
Bien que cette définition soit correcte et ait servi aux océanographes pendant les 65 années suivantes, la méthodologie est peu pratique et difficile à réaliser avec précision. Sachant que les ions majeurs restent dans des proportions constantes les uns par rapport aux autres et que le chlore pouvait être mesuré avec précision par un titrage volumétrique à l’argent, la commission a défini la » chlorinité » comme une mesure de la salinité. À l’origine, la salinité était calculée à partir de la teneur en Cl- (chlorinité). La chlorinité est mesurée comme la masse en g des halogénures qui peuvent être précipités à partir de 1 000 g d’eau de mer par Ag+ en utilisant une solution standard d’AgNO3. La réaction est :
AgNO3 (aq) + NaCl (aq) → AgCl(s) + NaNO3 (aq)
Après avoir analysé un grand nombre d’échantillons provenant de neuf endroits, Knudsen et ses collègues ont mis au point une équation permettant de calculer la salinité en fonction de la teneur en chlore :
S = 1,805 \, Cl^- + 0,03 \ ; g / kg , \qquad (1)
où la chlorinité Cl- est définie comme la masse d’argent nécessaire pour précipiter complètement les halogènes dans 0,3285234 kg de l’échantillon d’eau de mer :
Cl- = 328.5234 Ag+
Les mesures de salinité sont parfois exprimées dans l’échelle de chlorinité (g Cl- / kg) ou dans l’échelle de chlorosité (g Cl- / l).
Définition révisée de la salinité 1966
Comme on le voit dans la formule (1), cette méthode a ses limites et n’est pas tout à fait correcte : lorsque la chlorinité est de 0, la salinité est de 0,03. De plus, Carritt et Carpenter (1959) ont estimé que l’incertitude d’une valeur calculée de la salinité à partir d’une valeur mesurée de la chlorinité en utilisant cette relation peut atteindre 0,04 g / kg. Ceci est dû aux variations de la composition chimique de certains échantillons d’eau de mer (Baltique) et au fait que seulement 9 endroits différents ont été échantillonnés pour définir la chlorinité.Au début des années 60, avec le développement des ponts de conductivité, il est devenu possible de mesurer la salinité avec une grande précision (± 0,003 g / kg). Les ponts donnaient des rapports de conductivité entre l’échantillon et l’eau de mer standard utilisée pour calibrer les ponts. Cependant, l’eau de mer standard avait été développée pour les mesures de la chlorinité et non pour la conductivité. Une nouvelle norme de conductivité a donc été commandée au Joint Panel for Oceanographic Tables and Standards (JPOTS). Sur la base de nouvelles mesures de salinité, de température et de conductivité provenant d’échantillons du monde entier, la formule permanente de la chlorinité a été révisée pour devenir :
S = 1,80655 \, Cl^- . \qquad (2)
Échelle de salinité pratique-1978 / EOS-80
WHAT IS PSU ? par Frank J. Millero dans Oceanography Magazine, 1993
Après avoir reçu le dernier numéro d’Oceanography, j’ai été irrité par la publicité Sea-Bird sur la couverture intérieure. Elle montre un diagramme TS qui est étiqueté avec le terme PSU. Bien que je n’aie pas réussi à obtenir de la société qu’elle cesse d’utiliser ce terme, j’ai pensé que je devais écrire cette lettre pour exprimer mes préoccupations quant à son utilisation par les océanographes dans les articles publiés. En tant que membre du Groupe mixte sur les tables et les normes océanographiques, qui a joué un rôle déterminant dans l’élaboration de l’équation internationale de l’état de l’eau de mer et de l’échelle de salinité pratique, je suis étonné de la pratique qui semble avoir été adoptée par les océanographes en utilisant PSU. L’échelle de salinité pratique était définie comme un rapport de conductivité sans unité. Un échantillon d’eau de mer avec un rapport de conductivité de 1,0 à 15ºC avec une solution de KCl contenant une masse de 32,4356 g dans une masse totale de 1 kg de solution a une salinité de 35.000 (aucune unité ou ‰ n’est nécessaire). La dépendance de la salinité et de la température de ce rapport pour le poids de l’eau de mer évaporée ou diluée avec de l’eau a conduit à la définition complète de l’échelle pratique de salinité. Cette définition a été adoptée par toutes les organisations océanographiques nationales et internationales. Quelque part, les océanographes ont commencé à utiliser le terme PSU (practical salinity unit) pour indiquer que l’échelle de salinité pratique était utilisée pour déterminer la salinité de conductivité. Cela résulte apparemment de l’utilisation antérieure de ‰ pour représenter les parties pour mille, que certains océanographes considéraient comme une unité. En définitive, la salinité a toujours été un rapport et n’a pas d’unités physiques. L’utilisation du terme PSU ne devrait pas être autorisée sur le terrain et certainement pas utilisée dans les articles publiés. Chaque fois que l’échelle de salinité pratique est utilisée pour déterminer la salinité, cela doit être indiqué quelque part dans l’article. L’utilisation du terme PSS peut être utilisée pour indiquer que l’échelle de salinité pratique est utilisée. Il n’est certainement pas nécessaire d’utiliser le terme PSU sur toutes les figures montrant des données TS. Je dois également souligner que l’UNESCO (1985) a publié un rapport SUN qui décrit soigneusement l’utilisation des unités dans le domaine de l’océanographie. Ce rapport a également été adopté par toutes les sociétés océanographiques internationales mais n’est généralement pas utilisé par les océanographes et les revues publiant des données océanographiques. Si le domaine de l’océanographie doit devenir une science reconnue, il doit adopter les unités qui sont fondamentales dans les domaines de la chimie et de la physique. Il ne doit pas non plus adopter de nouvelles unités pour des variables qui sont sans unité.
Le rapport pondéral des différents sels dissous dans l’eau de mer est presque le même partout dans les océans du monde. Cela vaut également pour les eaux côtières, bien que les écarts par rapport à la composition standard deviennent plus importants à faible salinité dans la zone de transition sel-fraîcheur. En raison de la composition quasi universelle des sels dissous dans l’eau de mer, la salinité de l’eau de mer peut être dérivée du degré de dilution de l’eau de mer par l’eau douce. La méthode la plus pratique consiste à mesurer la conductivité C. L’échelle de salinité pratique (PSS) a été introduite pour établir une relation univoque entre la salinité et la conductivité. Cette relation est basée sur le rapport R entre la conductivité de l’eau de mer et la conductivité C(35,15) d’une solution standard de 1 kg contenant 32,4356 g de KCl à 15oC, qui a une salinité S=35.
La relation entre la salinité S(T) et le rapport de conductivité R=R(S,T) a été basée sur des déterminations précises de la chlorinité et du rapport de conductivité pour différentes températures T sur 135 échantillons d’eau de mer naturelle, tous collectés à moins de 100 m de la surface, et comprenant des échantillons de tous les océans et des mers Baltique, Noire, Méditerranée et Rouge. Après la conversion de la chlorinité en salinité, en utilisant la relation (2), le polynôme suivant a été calculé par les moindres carrés :
S(T) = S(15) + \Delta S(T) , \qquad R=\Large\frac{C(S,T)}{C(35,15)}\normalsize , \qquad (3)
S(15)=0,008-0.1692\,R^{1/2}+25.3851\,R+14.0941\,R{3/2}-7.0261\,R^2+2.7081\,R^{5/2} , \qquad (4)
Delta S(T)= \Large\frac{T-15}{1+0.0162(T-15)}\normalsize (0.0005-0.0056\,R^{1/2} \\ -0.0066\,R-0.0375\,R^{3/2}+0.0636\,R^2-0.0144\,R^{5/2}) , \qquad (5)
pour 2 \, \le S \le \, 42 et pour la pression atmosphérique,
S(15) \approx 0.586 \, C^{1.0876} , où C est exprimé en mS/cm.
Cependant, étant donné que la conductivité absolue ne peut pas être mesurée avec la précision requise pour des mesures précises de la salinité, il est conseillé d’utiliser la conductivité mesurée par rapport à celle de l’eau de mer standard et d’appliquer les relations salinité-conductivité (3-5).
L’échelle pratique de salinité a été adoptée en 1980 comme norme internationale pour l’océanographie par le groupe mixte UNESCO/SCOR/ICES/IAPSO sur les tables et les normes océanographiques et le groupe de travail 51 du SCOR (JPOTS). L’équation d’état de l’eau de mer correspondante (EOS-80) basée sur l’échelle de température IPTS-68 et sur l’échelle de salinité pratique 1978, PSS-78 (Lewis et Perkin, 1981) a été publiée par Millero et al. (1980).
TEOS-10
La COI de l’UNESCO a introduit en 2010 une nouvelle définition de la salinité, dite salinité absolue S_A. L’équation thermodynamique d’état (TEOS) a été mise à jour pour plusieurs raisons :
- Plusieurs des expressions polynomiales de l’Équation internationale d’état de l’eau de mer (EOS-80) ne sont pas totalement cohérentes entre elles car elles n’obéissent pas exactement aux relations de différenciation croisée thermodynamique de Maxwell. La nouvelle approche élimine ce problème.
- Depuis la fin des années 1970, une description thermodynamique plus précise de l’eau pure est apparue (IAPWS-95). De même, des mesures plus nombreuses et assez précises des propriétés de l’eau de mer (comme pour (i) la capacité thermique, (ii) la vitesse du son et (iii) la température de densité maximale) ont été effectuées et peuvent être intégrées dans une nouvelle description thermodynamique de l’eau de mer.
- L’impact sur la densité de l’eau de mer de la variation de la composition de l’eau de mer dans les différents bassins océaniques a été mieux compris.
- L’importance croissante accordée à l’océan en tant que partie intégrante du moteur thermique mondial souligne la nécessité de disposer d’expressions précises pour l’enthalpie et l’énergie interne de l’eau de mer afin de pouvoir déterminer plus précisément les flux de chaleur dans l’océan (l’enthalpie et l’énergie interne n’étaient pas disponibles à partir d’EOS-80).
- L’échelle de température a été révisée de l’ITS-68 à l’ITS-90 et les poids atomiques des éléments ont été révisés.
La salinité absolue S_A est définie comme la fraction massique de matière dissoute non H2O dans un échantillon d’eau de mer à sa température et à sa pression et exprimée en unités g / kg. C’est pourquoi elle est également appelée salinité de densité. La fraction massique de H2O dans un échantillon d’eau de mer est donc donnée par 1-0.001 S_A. Cette définition répond correctement à la question « qu’est-ce qui constitue l’eau et qu’est-ce qui constitue la matière dissoute » (par exemple, la dissolution d’une masse donnée de CO2 dans l’eau pure transforme essentiellement une partie de l’eau en matière dissoute car elle produit un mélange de CO2, H2CO3, HCO3-, CO32-, H+, OH- et H2O, les proportions relatives dépendant des constantes de dissociation qui dépendent de la température, de la pression et du pH.).
Les valeurs de la salinité absolue S_A ne diffèrent que légèrement des valeurs correspondantes de la salinité pratique S. Pour une eau de mer de composition standard de référence
S_A = \Large\frac{35,16504}{35}normalsize S \ ; g / kg \qquad (6).
En d’autres termes, pour un échantillon d’eau de mer de référence avec une salinité pratique 35, la salinité absolue est de 35,16504 g / kg. Pour l’eau de mer non standard recueillie à des endroits arbitraires de l’océan, la différence moyenne entre la salinité absolue S_A et l’équation (6) est d’environ 0,0107 g / kg. La valeur de la salinité absolue S_A exprimée en g / kg et la valeur correspondante de la salinité pratique S sont connues pour ne pas différer de plus d’environ 0,5%. L’utilisation de la salinité pratique présente l’avantage d’être (presque) directement déterminée à partir de mesures de conductivité, de température et de pression, alors que la salinité absolue est généralement dérivée d’une combinaison de ces mesures plus d’autres mesures et de corrélations qui ne sont souvent pas bien établies.
Impact biologique de la salinité

Osmose à travers une membrane semi-perméable qui laisse passer plus facilement les molécules d’eau (bleu) que les molécules de sel (rouge). Plus de molécules d’eau passent à travers la membrane vers le compartiment d’eau de mer que de molécules de sel vers le compartiment d’eau douce, jusqu’à ce que la concentration en sel soit égale des deux côtés de la membrane. Cela augmente la pression dans le compartiment d’eau de mer, appelée pression osmotique. Adapté de ZME Science.
Tous les organismes doivent maintenir un équilibre entre l’eau et les solutés dans leur corps pour garder leurs cellules en vie. C’est ce qu’on appelle l’homéostasie. Pour le réguler, ils peuvent importer et exporter des solutés à travers leurs membranes qui sont perméables aux substances dissoutes ou en suspension dans l’eau. Le mouvement aléatoire des substances dissoutes à travers une membrane perméable est appelé diffusion. La diffusion se produit jusqu’à ce que les concentrations soient égales des deux côtés de la membrane. Lorsqu’un soluté ne peut pas traverser la membrane, l’égalité de concentration des deux côtés est atteinte par le mouvement net de l’eau à travers la membrane. Le mouvement net de l’eau à travers une membrane semi-perméable en réponse à des différences de concentration de soluté est appelé « osmose ». Ce phénomène est essentiel à la survie des cellules. Si la concentration de sel est plus élevée à l’extérieur qu’à l’intérieur, la cellule perd de l’eau, se déshydrate et meurt. Dans le cas contraire, la cellule absorbe de l’eau, elle gonfle et peut éclater. C’est pourquoi les organismes investissent du temps et de l’énergie pour maintenir l’homéostasie.
Capteurs de salinité Densité de l’eau de mer Intrusion et mélange d’eau de mer dans les estuaires Circulation estuarienne Estuaires du biseau salé Échange de la mer de plateau avec l’océan
Veuillez noter que d’autres personnes peuvent également avoir édité le contenu de cet article.
- Pour d’autres articles de cet auteur, voir Category:Articles par Souza Dias, Francisco
- Pour d’autres articles de cet auteur, voir Category :Articles de TÖPKE, Katrien
- Pour un aperçu des contributions de cet auteur, voir Spécial:Contributions/Francisco Souza Dias
- Pour un aperçu des contributions de cet auteur, voir Spécial :Contributions/Ktopke
.