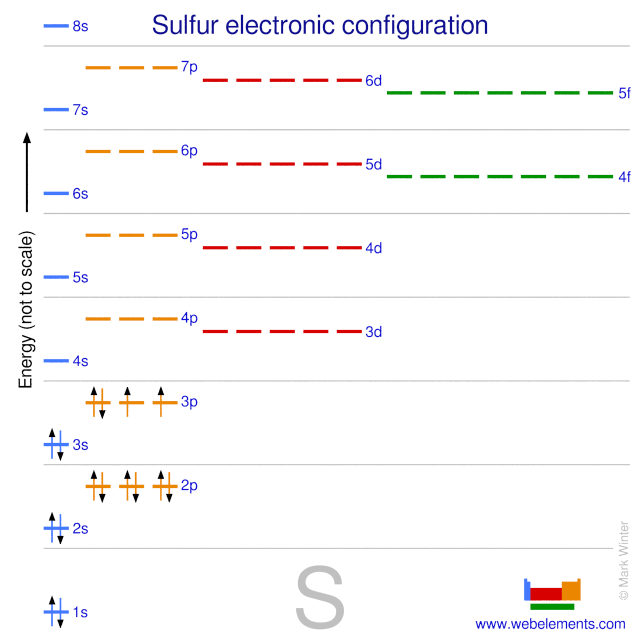
Les atomes de soufre possèdent 16 électrons et la structure de coque est 2.8.6.
La configuration électronique du soufre neutre gazeux à l’état fondamental est .3s2.3p4 et le symbole du terme est 3P2.

Spectre atomique
Représentation du spectre atomique du soufre.
Energies d’ionisation et affinité électronique
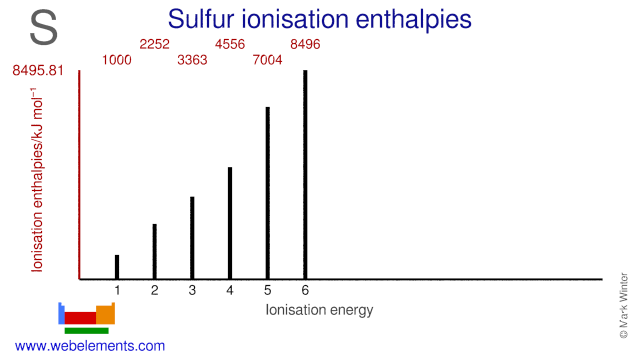
L’affinité électronique du soufre est de 200 kJ mol-1. Les énergies d’ionisation du soufre sont données ci-dessous.
| Ionisation numéro d’énergie | Enthalpie / kJ mol-1 |
|---|---|
| 1er | 999.59 |
| 2e | 2251,76 |
| 3e | 3363,48 |
| 4e | 4556.23 |
| 7004.30 | |
| 6ème | 8495.81 |
| 7ème | 27107.9 |
| 8e | 31724 | 9e | 36649 | 10e | 43196 |
| 11e | 48682 |
| 12e | 54457 (inféré) |
| 13e | 62905 | 14e | 68215 |
| 15ème | 311047 | 16ème | 337138 |
Charges nucléaires effectives
Les éléments suivants sont des charges nucléaires effectives « Clementi-Raimondi », Zeff. Suivez les hyperliens pour plus de détails et pour obtenir des graphiques sous différents formats.
| 1s | 15.5409 | ||||||
|---|---|---|---|---|---|---|---|
| 2s | 10,63 | 2p | 11,98 | ||||
| 3s | 6,37 | 3p | 5.48 | 3d | (pas de données) | 4s | (pas de données) | 4p | (pas de données) | 4d | (aucune donnée) | 4f | (aucune donnée) |
| 5s | (aucune donnée) | 5p | (aucune donnée) | 5d | (aucune données) | ||
| 6s | (pas de données) | 6p | (pas de données) | ||||
| 7s | |||||||
Ces charges nucléaires effectives, Zeff, sont adaptées des références suivantes :
- E. Clementi et D.L.Raimondi, J. Chem. Phys. 1963, 38, 2686.
- E. Clementi, D.L.Raimondi, et W.P. Reinhardt, J. Chem. Phys. 1967, 47, 1300.
Energies de liaison des électrons
| Label | Orbital | eV |
|---|---|---|
| K | 1s | 2472 | L I | 2s | 230.9 | L II | 2p1/2 | 163,6 | L III | 2p3/2 | 162.5 |
Notes
Je suis reconnaissant à Gwyn Williams (Jefferson Laboratory, Virginie, USA) qui a fourni les données d’énergie de liaison des électrons. Ces données sont adaptées des références 1-3. Elles sont tabulées ailleurs sur le WWW (référence 4) et sous forme de papier (référence 5).
- J. A. Bearden et A. F. Burr, « Reevaluation of X-Ray Atomic Energy Levels », Rev. Mod. Phys., 1967, 39, 125.
- M. Cardona et L. Ley, Eds., Photoemission in Solids I : General Principles (Springer-Verlag, Berlin) avec des corrections supplémentaires, 1978.
- Gwyn Williams WWW table of values
- D.R. Lide, (Ed.) in Chemical Rubber Company handbook of chemistry and physics, CRC Press, Boca Raton, Florida, USA, 81e édition, 2000.
- J. C. Fuggle et N. Mårtensson, « Core-Level Binding Energies in Metals », J. Electron Spectrosc. Relat. Phenom. 1980, 21, 275.