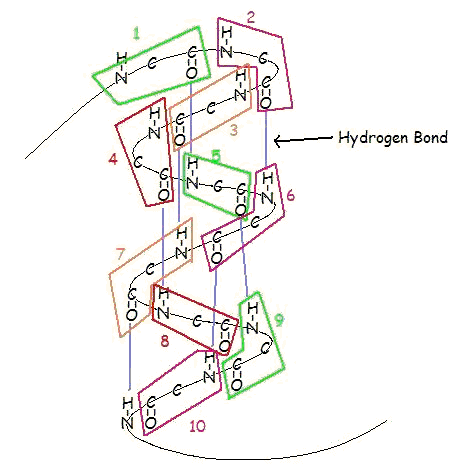
Une α-hélice est un enroulement à droite de résidus d’acides aminés sur une chaîne polypeptidique, généralement comprise entre 4 et 40 résidus. Cette bobine est maintenue ensemble par des liaisons hydrogène entre l’oxygène de C=O sur la bobine supérieure et l’hydrogène de N-H sur la bobine inférieure. Une telle liaison hydrogène est formée exactement tous les 4 résidus d’acides aminés, et chaque tour complet de l’hélice ne représente que 3,6 résidus d’acides aminés. Ce schéma régulier donne à l’hélice α des caractéristiques très définies en ce qui concerne l’épaisseur de la bobine et la longueur de chaque tour complet le long de l’axe de l’hélice.
L’intégrité structurelle d’une hélice α dépend en partie d’une configuration stérique correcte. Les acides aminés dont les groupes R sont trop grands (tryptophane, tyrosine) ou trop petits (glycine) déstabilisent les α-hélices. La proline déstabilise également les α-hélices en raison de sa géométrie irrégulière ; son groupe R se recolle à l’azote du groupe amide, ce qui provoque un encombrement stérique. De plus, l’absence d’hydrogène sur l’azote de la Proline l’empêche de participer à la liaison hydrogène.
Un autre facteur affectant la stabilité des hélices α est le moment dipolaire total de l’hélice entière dû aux dipôles individuels des groupes C=O impliqués dans la liaison hydrogène. Les α-hélices stables se terminent généralement par un acide aminé chargé pour neutraliser le moment dipolaire.
.