Croissance et prolifération tumorales
Dans des circonstances normales, mTOR est un régulateur majeur de la croissance et de la division cellulaire. Cependant, dans les cellules tumorales, mTOR anormalement activé envoie des signaux qui encouragent les cellules tumorales à se développer, à former des métastases et à envahir de nouveaux tissus sains . Parmi ceux-ci, la voie PI3K/phosphate et homologie fongique supprimée sur le chromosome 10 (PTEN)/AKT/TSC est le principal activateur de mTORC1, et les mutations génétiques dans cette voie peuvent entraîner des tumeurs malignes . En outre, l’expression de PTEN est souvent éliminée par des modifications épigénétiques, génétiques et post-transcriptionnelles pour réguler à la hausse la voie PI3K/Akt/mTOR dans la plupart des tumeurs malignes .
Hou et al. ont découvert que les mutations du gène PTEN entraînaient une activation anormale de la voie PI3K/PTEN dans le carcinome cellulaire hépatique (HCC). En outre, la délétion du gène PTEN induit l’expression de B7-H1, ce qui entraîne une immunosuppression et augmente la progression et l’invasion des tumeurs. Dans le cancer du foie, la voie PI3K/PTEN/Akt/mTOR activée est impliquée dans l’invasion tumorale et les métastases en régulant à la hausse la métallopeptidase 9 (MMP-9). De même, on a découvert que la voie de signalisation PI3K/Akt/mTOR contrôle la prolifération et la survie des cellules souches du cancer du côlon (CCSC). Dans le cancer du côlon sporadique, les CCSC peuvent être à l’origine de récidives et de métastases. Xie et al. ont découvert que la mutation du gène de la kinase B1 du foie (LKB1) ou le signal de croissance extracellulaire pouvaient activer mTORC1. MTORC1 inhibe l’activité de la protéine ring finger 168 (RNF168) et favorise sa dégradation en phosphorylant la 60e sérine de RNF168. Cela réduit considérablement la modification par ubiquitination de l’histone H2A et du membre X de la famille de l’histone H2A (H2AX) après un dommage à l’ADN, ce qui inhibe la réponse aux dommages à l’ADN et réduit la stabilité du génome, entraînant la promotion de la transformation des cellules malignes et du cancer. En outre, les recherches existantes montrent que Rheb est une GTPase qui se lie à mTORC1 et l’active lorsque le GTP est chargé. Deng et al. ont signalé que l’ubiquitination de Rheb était régulée par les signaux des facteurs de croissance. Rheb ubiquitiné inhibe l’activité de Rheb en favorisant la liaison de Rheb à TSC2, ce qui entraîne l’inhibition de l’expression de mTORC1. Outre la voie mTORC1, la voie mTORC2 est également impliquée dans la régulation de l’apparition et du développement des cellules tumorales. Wang et al. ont démontré que la désubiquitinase 7B de l’OTU (OTUD7B) réduit le niveau d’ubiquitination de GβL pour empêcher GβL d’interagir avec SIN1, ce qui entraîne l’activation de la voie de signalisation mTORC2/AKT et la régulation négative de l’expression de mTORC1. Cela active partiellement la signalisation oncogène AKT et favorise la tumorigenèse. Cependant, l’ubiquitine ligase TNF Receptor Associated Factor 2 (TRAF2) a l’effet inverse en augmentant le niveau d’ubiquitination de GβL. De même, Kovalski et al. ont prouvé que les mutations de Ras peuvent se lier à mTOR de mTORC2 et à la protéine 1 associée à la protéine kinase activée par des agents mitogènes (MAPKAP1) pour promouvoir l’activité de la kinase mTORC2, initiant ainsi des programmes de transcription du cycle cellulaire prolifératif en aval.
En résumé, mTOR est toujours stimulée dans les tumeurs pour maintenir la croissance, la survie et la prolifération des cellules tumorales, et joue un rôle clé dans la biologie des cellules tumorales (Fig. 1).
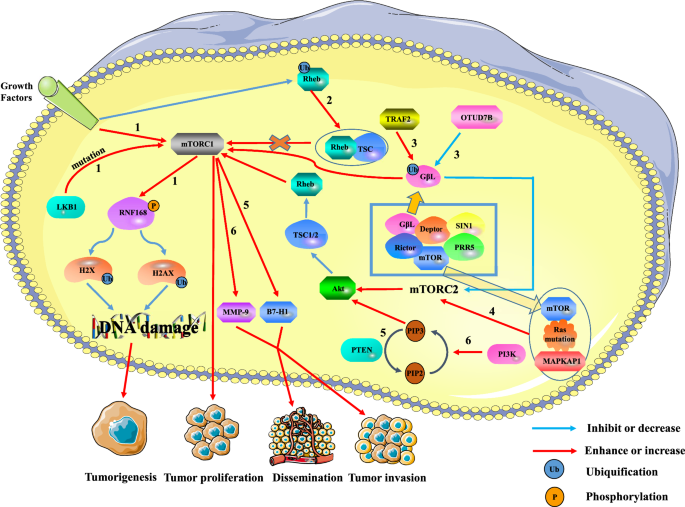
La relation entre mTOR et les tumeurs. La suractivation de mTORC1 peut favoriser la formation, la prolifération et les métastases des tumeurs, tandis que mTORC2 peut réguler l’expression de mTORC1 par la voie mTORC2/AKT/TSC/Rehb. Voie 1 : Les signaux de croissance extracellulaires et les mutations intracellulaires de LKB1 activent mTORC1, qui réduit l’ubiquitination de l’histone H2A et H2A après un dommage à l’ADN en phosphorylant RNF168. Cela peut entraîner des dommages à la réparation de l’ADN et favoriser la formation de tumeurs. Voie 2 : L’ubiquitination de Rheb réduit l’activité de Rheb en favorisant la liaison de Rheb à TSC2. La régulation négative de Rheb réduit l’activation de mTORC1, ce qui conduit à l’inhibition de la croissance tumorale. Voie 3 : TRAF2 et Otud7B régulent respectivement l’activité de mTORC1/2 en régulant à la hausse ou à la baisse le niveau d’ubiquitination de G beta L de mTORC2. TRAF2 augmente l’activité de mTORC1 et inhibe l’activité de mTORC2. Bien que la régulation négative de l’expression de mTORC2 inactive la voie AKT/TSC/Rehb/mTORC1, l’activité globale de mTORC1 est renforcée. Cependant, Otud7B a l’effet inverse sur TRAF2. Voie 4 : Ras muté se lie à mTOR et à MAPKAP1 de mTORC2 pour promouvoir l’expression de mTORC2. La régulation à la hausse de mTORC2 favorise la prolifération tumorale par la voie AKT/TSC/Rehb/mTORC1. Voie 5 : La délétion du gène PTEN induit l’expression de B7-H1 pour augmenter la progression et l’invasion tumorale. Voie 6 : La voie PI3K/PTEN/AKT/mTOR est impliquée dans l’invasion et les métastases du cancer du foie en régulant à la hausse la MMP-9
Métabolisme tumoral
mTOR est activé lorsque les nutriments sont suffisants, ce qui favorise l’anabolisme et le stockage et l’utilisation de l’énergie. Lorsque les nutriments sont relativement rares, l’organisme doit inhiber l’activation de mTOR pour maintenir la matière cellulaire et l’énergie stables. Les cellules tumorales ont besoin de grandes quantités de protéines, de lipides et de nucléotides pour répondre à leurs besoins de croissance et de division . Par conséquent, une activité anormale de la voie mTOR se produit souvent dans les tumeurs, car mTOR joue un rôle central dans la régulation du métabolisme.
Dans les cellules cancéreuses du sein, la voie PI3K/AKT/mTORC1/sterol regulatory element-binding protein (SREBP) est le principal mécanisme pour induire une nouvelle synthèse des lipides et promouvoir la prolifération tumorale . La pyruvate kinase (PK) est impliquée dans le métabolisme des sucres, tandis que l’acide gras synthase (FASN) participe à la synthèse des acides gras (AG). Tao et al. ont découvert que la régulation négative de l’expression de la pyruvate kinase M2 (PKM2) désactive la voie de signalisation AKT/mTOR, réduisant ainsi l’expression de SREBP-1c. Le niveau d’expression réduit de SREBP-1c inhibe la génération d’AF en inhibant la transcription du gène FASN, ce qui entraîne une inhibition de la croissance des cellules tumorales. En outre, Di Malta et al. ont signalé que le gène du facteur de transcription enhancer (TFE) régulé à la hausse peut activer la voie Rag GTPase/mTORC1. Dans les cellules normales, cette voie est activée afin que les cellules puissent mieux absorber les nutriments pour maintenir les fonctions physiologiques. Dans les cellules tumorales, cette voie est souvent suractivée pour répondre aux besoins nutritionnels des cellules tumorales en croissance rapide. Or, Guri et al. ont exploré que mTORC2 favorisait la production de sphingomyéline et de cardiolipine dans le CHC. D’une part, la sphingomyéline et les phospholipides cardiaques sont tous deux des composants structurels des biofilms cellulaires. D’autre part, le métabolisme et le transport des phospholipides cardiaques contribuent au bon fonctionnement des mitochondries, ils doivent donc être fournis en grande quantité dans les cellules tumorales en prolifération rapide. Ces résultats suggèrent que la voie de signalisation mTORC2 favorise la prolifération du CHC et la production de lipides liés à l’énergie.
Comme mentionné ci-dessus, les métabolismes des cellules tumorales peuvent être régulés par la voie mTOR pour répondre à leurs besoins prolifératifs et nutritionnels. À l’inverse, le métabolisme des cellules tumorales peut également favoriser la croissance tumorale par la voie mTOR. Ericksen et al. ont démontré que la réduction de la décomposition des acides aminés à chaîne ramifiée (BCAA) pouvait favoriser l’apparition et le développement de tumeurs en augmentant l’activité de mTORC1. Ils ont également conclu que l’activité de l’enzyme clé dans le processus de catabolisme des BCAA était fortement corrélée à l’invasion tumorale. Par conséquent, l’accumulation des BCAA causée par l’inhibition du catabolisme des BCAA dans les tissus des tumeurs hépatiques peut être le principal mécanisme d’activation chronique de mTORC1 des tumeurs. De même, Shi et al. ont montré que l’expression du récepteur A2a de l’adénosine (A2aR) dans les tissus du cancer gastrique (GC) était accrue, et que l’expression de l’A2aR était positivement corrélée au stade du GC. Ces résultats suggèrent que l’adénosine active la voie de signalisation PI3K/AKT/mTOR en se liant à A2aR, ce qui favorise finalement la progression du CG. Madak-Erdogan et al ont constaté que les acides gras libres (AGL) activaient les voies du récepteur des œstrogènes α (ERα) et de mTOR, ce qui était corrélé avec une prolifération et une invasivité plus élevées des cellules de cancer du sein ER (+).
Ces études indiquent que la voie de signalisation mTOR est étroitement liée au métabolisme tumoral, et apportent un soutien théorique à l’application combinée des inhibiteurs de mTOR et de certains médicaments qui interfèrent avec le métabolisme tumoral (Fig. 2).
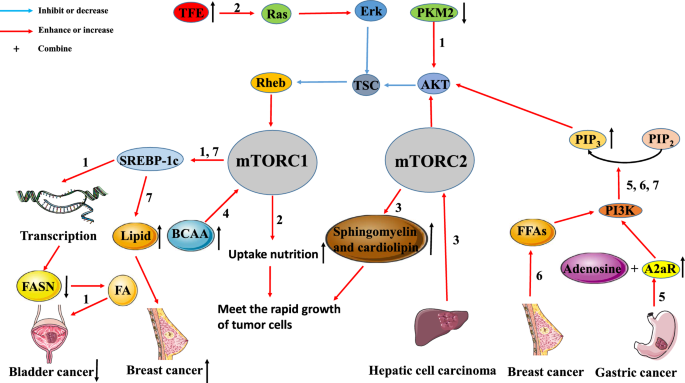
Interaction entre le métabolisme tumoral et la voie de signalisation mTOR. La voie mTOR est étroitement liée au métabolisme tumoral. Voie 1 : Dans le cancer de la vessie, la régulation négative de l’expression de PKM2 réduit l’expression de SREBP-1 par la voie AKT/TSC/Rehb/mTORC1 inactivée. La régulation négative de SREBP-1c inhibe la génération d’AF par l’inhibition de la transcription de FASN, conduisant à l’inhibition de la croissance tumorale). Voie 2 : La régulation à la hausse de TEF dans les tumeurs active la voie Ras/Erk/TSC/Rehb/mTORC1. L’activation de cette voie va favoriser l’absorption de nutriments par les cellules tumorales pour répondre aux besoins de la croissance rapide des tumeurs. Voie 3 : Le CHC peut augmenter la production de sphingomyéline et de cardiolipine en activant mTORC2. De grandes quantités de sphingomyéline et de cardiolipine sont utilisées pour assembler les membranes cellulaires, ce qui répond également aux besoins de la prolifération rapide des tumeurs. Voie 4 : L’accumulation de BCAA peut favoriser l’apparition et le développement de tumeurs en activant mTORC1. Voie 5 : A2aR, qui est fortement exprimé dans le cancer gastrique, se lie à l’adénosine pour activer la voie PI3K/AKT/mTORC1. Voie 6 : Dans le cancer du sein, les AGF favorisent la prolifération tumorale et les métastases en activant la voie PI3K/AKT/mTORC1. Voie 7 : La voie PI3K/AKT/mTORC1/SREBP favorise la prolifération du cancer du sein en induisant la synthèse de nouveaux lipides
Cellules immunitaires
Les tumeurs peuvent développer une tolérance immunitaire en supprimant la capacité du système immunitaire à reconnaître et à tuer les cellules tumorales. L’immunothérapie des tumeurs est un sujet de recherche brûlant ces dernières années , et diverses preuves montrent que la voie mTOR, qui est souvent anormalement activée dans les tumeurs, peut réguler la différenciation et la fonction des cellules immunitaires.
Cellules T
Les cellules progénitrices T de la moelle osseuse entrent dans le thymus, où elles se différencient en deux types de cellules : les cellules T αβ et les cellules T γδ. Grâce à l’expérience de knockout de gènes, Yang et al ont prouvé que la délétion de RAPTOR dans mTORC1 briserait le processus de remodelage du métabolisme oxydatif et du métabolisme du glucose pendant la différenciation des cellules T. Cela déclenche la production d’espèces réactives de l’oxygène (ROS), ce qui perturbe la différenciation des cellules T αβ et augmente la différenciation des cellules T γδ. En outre, Essig et al. ont montré que la roquin pouvait réguler à la baisse l’expression de la voie PI3K/mTOR. La régulation à la baisse de la voie PI3K/mTOR inhibe non seulement la différenciation et l’activation des cellules T traditionnelles, mais limite également la spécialisation des cellules Treg. Pollizzi et al. ont découvert dans des modèles de souris que l’activation de mTORC1 favorisait la production d’un cluster de différenciation (CD) 8+ de cellules T effectrices avec une glycolyse élevée. Ces cellules T conservent le phénotype effecteur mais ne se convertissent pas en phénotype mémoire. En revanche, les cellules T dont l’activité de mTORC1 est réduite présentent les caractéristiques des cellules mémoire mais ne peuvent pas se différencier en cellules effectrices et ne peuvent pas produire de réponse immunitaire mémoire en raison d’une fonction métabolique défectueuse. D’autres études ont montré que mTORC1 pouvait affecter la fonction effectrice des cellules T CD8+, tandis que l’activité de mTORC2 régulait la capacité de mémoire des cellules T CD8+.
En général, la voie de signalisation mTOR peut affecter la différenciation et la fonction des cellules T. Ces études élargissent notre compréhension actuelle de la biologie des cellules T.
Cellules tueuses naturelles et cellules dendritiques
La voie de signalisation mTOR ne régule pas seulement les cellules T, mais est étroitement liée à la différenciation et aux fonctions des cellules dendritiques (DC) et des cellules tueuses naturelles (NK). Les CD ont une forte capacité de présentation de l’antigène et les cellules NK sont des cellules immunitaires importantes dans l’organisme. Wang et al. ont prouvé que mTORC1 et mTORC2 régulent les effets des cellules NK d’une manière unique. Ils ont découvert que mTORC2 régule négativement la fonction des cellules NK principalement en inhibant l’axe transducteur et activateur de signal de la transcription 5 (STAT5)/solute carrier family 7 member 5 (SLC7A5). Alors que mTORC1 régule positivement l’activité de mTORC2 en maintenant la voie de signalisation de l’interleukine (IL)-15 médiée par CD122. Outre les cellules NK, on pense depuis quelques années que les cellules DC sont également liées à la voie de signalisation mTOR. Chen et al. ont conclu que l’apoptose des DC dérivées des cellules mononucléaires de la moelle osseuse (BMM) était réduite après traitement par des inhibiteurs de mTOR. Ils ont également constaté que les DC dérivées des cellules de la moelle osseuse avaient de meilleures capacités de présentation de l’antigène et que les lymphocytes T CD8+ cytotoxiques spécifiques de l’e7 activés par ces DC avaient une plus grande activité anti-tumorale. Par conséquent, les inhibiteurs de mTOR peuvent renforcer l’efficacité de l’immunothérapie des tumeurs en prolongeant la durée de vie des DC et en améliorant leur capacité de présentation et de traitement des antigènes. Ces études fournissent des idées pour cibler les cellules NK et DC pour la thérapie anti-tumorale.
Macrophages
Les macrophages de type M1 peuvent tuer les cellules tumorales de multiples façons, tandis que les macrophages de type M2 favorisent l’apparition, l’invasion et les métastases des tumeurs. Zhihua et al. ont rapporté que l’expression du microARN (miRNA)-30c était significativement réduite dans le GC. D’autres études ont montré que le facteur inductible de l’hypoxie-1α (HIF-1α) inhibait l’expression du miRNA-30c. La régulation négative du miRNA-30c réduira l’activité de mTOR et la glycolyse dans les macrophages liés aux tumeurs. Cela finira par favoriser la croissance et les métastases des GC en inhibant la différenciation et la fonction des macrophages de type M1.
En général, la voie mTOR, qui est souvent activée dans les tumeurs, favorise la croissance tumorale en régulant la différenciation et la fonction des cellules immunitaires. Cela jouera un rôle positif dans l’exploration d’une nouvelle immunothérapie et l’amélioration du traitement des tumeurs.
Résistance des tumeurs aux médicaments
Cibler les voies moléculaires des cellules tumorales est la façon dont nous traitons divers cancers, mais les tumeurs développent inévitablement une résistance aux médicaments . Une fois que la tumeur devient résistante, les effets secondaires du traitement augmentent tandis que l’efficacité du médicament diminue de manière significative.
Les tumeurs du système digestif
Des études ont démontré que la protéine de découplage mitochondriale 2 (UCP2) entraîne une résistance tumorale à de multiples médicaments anticancéreux en réduisant les ROS générés par le métabolisme mitochondrial. Dando et al. ont prouvé que la combinaison de la génipine et de l’évérolimus pouvait inhiber de manière synergique la croissance des cellules d’adénocarcinome pancréatique (PAAD) et induire l’autophagie des cellules tumorales. Cela s’explique par le fait que l’inhibition de l’UCP2 dans les cellules du PAAD active la voie Akt/mTOR par un mécanisme dépendant des ROS, ce qui réduit l’effet anti-prolifération de la génipine, un inhibiteur de l’UCP2. La voie hedgehog médiée par la protéine à doigt de zinc GLI1 joue un rôle majeur dans la GC. Cependant, Yao et al. ont démontré que la voie AKT/mTOR peut activer GLI1. En outre, les expressions de GLI1 et de p-AKT ont été corrélées avec les métastases des cellules tumorales et la résistance aux médicaments, et le niveau d’expression a été négativement corrélé avec le pronostic des patients atteints de GC.
Tumeurs respiratoires
L’inhibiteur de wee1 AZD1775, qui cible la réparation de l’ADN et les points de contrôle du cycle cellulaire, s’est avéré efficace chez certains patients atteints de cancer du poumon, mais la résistance aux médicaments est également fréquente . À cet égard, Sen et al. ont constaté que l’expression de la tyrosine kinase du récepteur AXL (ARK) était régulée à la hausse dans le cancer du poumon à petites cellules (CPPC) résistant à l’AZD1775. L’ARK peut directement ou par l’intermédiaire de mTOR activer la voie des protéines kinases régulées extracellulaires (ERK) pour recruter et activer la checkpoint kinase 1 (CHK1). Ces résultats suggèrent que l’ARK peut améliorer la réparation des dommages à l’ADN en activant CHK1, ce qui invalide finalement l’inhibiteur Wee1. De même, Ye et al. ont démontré que dans le cancer du poumon non à petites cellules (NSCLC), le membre-1 de la famille transmembrane-4 L-six (TM4SF1) régule la sensibilité des tumeurs aux médicaments de chimiothérapie en régulant l’expression du récepteur à domaine discoïde 1 (DDR1)/la voie Akt/ERK/mTOR.
Cancer du rein et cancer de la peau
Les inhibiteurs de la tyrosine kinase (TKI) peuvent être utilisés pour traiter le carcinome des cellules rénales (RCC), mais certains patients RCC développeront une résistance aux médicaments . Ishibashi et al. ont signalé que le traitement combiné d’un inhibiteur du récepteur de l’interleukine-6 (IL-6R) et d’un inhibiteur de la TKI à faible dose était plus efficace pour inhiber la croissance et l’angiogenèse du CCR in vivo que l’utilisation de l’inhibiteur de la TKI seul. Cela s’explique par le fait que de faibles doses d’inhibiteurs de TKI induisent des niveaux élevés d’IL-6, qui activent la voie AKT/mTOR. Ces résultats suggèrent que le mécanisme d’échec des inhibiteurs TKI chez certains patients atteints de CCR est lié à l’activation élevée de la voie de signalisation mTOR par l’IL-6.
Les mutations du proto-oncogène B-Raf (BRAF) sont présentes dans les cancers de la peau sans mélanome (NMSC), mais les inhibiteurs BRAF n’ont pas été utilisés dans ces tumeurs. La raison principale est que les NMSC mutés BRAF présentent une résistance primaire ou secondaire aux inhibiteurs BRAF. Sen et al. ont trouvé une forte corrélation entre la voie de signalisation PI3K/mTOR et la résistance aux inhibiteurs BRAF. Cela suggère que l’activation de la voie mTOR peut conduire à la résistance des NMSC mutés BRAF aux inhibiteurs BRAF. En outre, Obenauf et al. ont découvert que les inhibiteurs de BRAF, de la tyrosine kinase du récepteur anaplasique (ALK) et du récepteur du facteur de croissance épidermique (EGFR) induisaient certains signaux de sécrétion dans les cellules cancéreuses, ce qui conduisait à la prolifération et aux métastases des cellules tumorales résistantes aux médicaments. D’autres études ont révélé que dans les cellules de mélanome traitées par un inhibiteur de BRAF, la régulation négative du facteur de transcription FOS related antigen-1 (FRA1) active de multiples voies de signalisation, parmi lesquelles la voie PI3K/AKT/mTOR joue un rôle majeur. Lorsque les voies de signalisation BRAF et PI3K/AKT/mTOR sont simultanément inhibées, la croissance des cellules de mélanome humain muté BRAF résistantes aux médicaments peut être inhibée.
Les études ci-dessus suggèrent que les cellules tumorales peuvent échapper à la mort cellulaire induite par les médicaments antitumoraux en activant la voie de signalisation mTOR intracellulaire, de sorte que l’activation de la voie de signalisation mTOR peut être l’un des mécanismes de résistance aux médicaments dans les tumeurs. Des combinaisons de médicaments ciblant la voie de signalisation mTOR peuvent être utilisées pour traiter les tumeurs qui ont développé une résistance.
Autophagie et apoptose du cancer
D’une part, l’autophagie peut maintenir le génome stable en éliminant les organelles endommagées et les protéines mal repliées, elle peut donc inhiber la croissance des cellules cancéreuses . D’autre part, l’autophagie fournit à la tumeur plus de nutriments, ce qui renforce la capacité de la tumeur à faire face à des environnements extrêmes . En outre, la prolifération illimitée des tumeurs est en partie due à l’inhibition de l’apoptose des cellules tumorales.
Sun et al. ont conclu que mTOR inhibe l’expression de la glycogène synthase kinase-3 (GSK-3) dans les cellules cancéreuses de la prostate. La régulation à la baisse de la GSK-3 va inhiber la voie de signalisation de la caspase-3, conduisant à la réduction de la production de ROS. La diminution des ROS inhibe l’apoptose des cellules tumorales et protège les cellules cancéreuses de la prostate. Cependant, Zou et al. ont signalé que mTORC2 empêchait l’inhibiteur cancéreux de la protéine phosphatase 2A (CIP2A) de se lier à la protéine phosphatase 2A (PP2A) afin de restaurer l’activité de la PP2A. PP2A réduit la transcription de miR-9-3p et régule à la hausse l’expression du facteur de transcription E2F 1 (E2F1) en favorisant la dégradation de c-Myc, de sorte qu’il inhibe l’apoptose des cellules tumorales. De plus, Yang et al. ont rapporté que l’expression de p-AKT, p-mTOR, P62 et du lymphome à cellules B (BCL-2) était significativement diminuée dans les cellules de carcinome épidermoïde oral (OSCC) avec un knockdown de l’ARN non codant long (lncRNA) CASC9, alors que l’expression du X associé à BCL2 (BAX) était augmentée. Ces résultats suggèrent que le lncRNA CASC9 inhibe l’apoptose médiée par l’autophagie via la voie AKT/mTOR, ce qui favorise la prolifération des cellules OSCC.
En résumé, les études ci-dessus indiquent que la voie de signalisation mTOR peut favoriser l’apparition et la progression des tumeurs en régulant l’autophagie et l’apoptose des cellules tumorales. En outre, les recherches ci-dessus fournissent également un soutien théorique à la recherche clinique sur les médicaments ciblés anticancéreux, ce qui est d’une grande importance.