はじめに
| 塩分濃度クラス | S |
| ハイパーハライン | > 65 |
| メタハリン | 45-?65 |
| Euhaline | 30-35 |
| Polyhaline | 18-?30 |
| Mesohaline | 5-18 |
| Oligohaline | 0.5-5 |
海水の塩分濃度は、1キログラムの海水に含まれる溶存塩の重量総量として定義されています。 塩分濃度はg / kgという単位で表され、ppt(part per thousand)や‰(permil)と表記されることもあります。 海水に溶けている塩類はイオンに解離しており、主なイオンは塩化物とナトリウムで、その他にマグネシウム、硫酸塩、カルシウム、カリウムなどがあります。 塩分濃度を測定する方法は、長年にわたってさまざまな方法が開発されてきた。 現在、最も実用的な方法は電気伝導度によるものである。 これは間接的な方法ですが、導電率と塩分濃度の間には正確な関係が確立されています。 このようにして求められた塩分濃度は、実用塩分濃度と呼ばれる無次元の量となります。 この塩分濃度スケールによると、一般的な「標準」海水の塩分濃度は35である。 海水の熱力学との整合性を高めるために、2010年に新しい塩分濃度スケール、いわゆる絶対塩分濃度スケールが導入されました。 沿岸域では、塩分濃度の空間的・時間的な変動が大きいため、実用的な塩分濃度の数値補正はそれほど重要ではありません。 しかし、海洋では、わずかな塩分の違いが大規模な海洋循環や水塊の特徴に大きく関係するため、大きな精度が必要となります。
海水は淡水に比べて、溶解した塩分の重量が加わるため密度が高く、塩分と密度の関係は「海水の密度」の項で説明しています。) 塩分濃度と密度の関係については、「海水の密度」の項で説明しています。この項では、塩分濃度のスケールの違いについて説明します。 導電率の測定に使用されるセンサーについては、「塩分センサー」の項で説明しています。
歴史上の塩分濃度の測定と定義
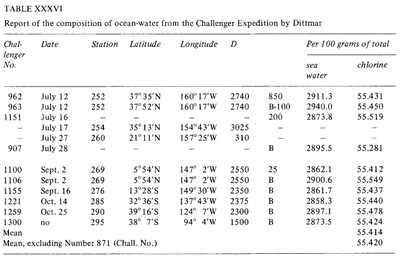
海水の一定の組成(Dittmar, 1884)
古くは古代ギリシャ時代から、海水の「塩分」を測定する試みがなされてきました。 しかし、これらの初期の方法はあまり効率的ではなく、感度や再現性も非常に限られていました。 近代になって、より正確な方法が開発されました。蒸発後の計量(Boyle, 1693; Birch, 1965)、溶媒抽出(Lavoisier, 1772)、沈殿(Bergman, 1784)などです。 1865 年、Forchhammer は塩分という言葉を導入し、総塩分量ではなく、海塩の個々の成分を測定することに専念しました。 彼は、様々な場所から採取した海水サンプルの主要な塩の比率が一定であることを発見しました。 この一定の比率は「フォルヒャマーの原理」と呼ばれています。 19世紀末、ウィリアム・ディトマーは、フォルヒハンマーの研究に倣い、海水の塩分と化学組成を分析するいくつかの方法を試しました。 ディトマーの海水の化学分析法は非常に精密なものだった。 Dittmarは、塩化物を硝酸銀で沈殿させて海水中の塩素含有量を分析し、合成した海水サンプルと比較して、この方法の精度を評価した。 その後、彼はチャレンジャー遠征中に採取された世界中の77のサンプルを分析し、フォーチュンマーが観察したのと同じ組成の恒常性に気づいた。 “水の濃度は非常に異なっているが、溶解物質のパーセンテージ組成はすべてのケースでほぼ同じである」。 .
塩分の定義 1902年
塩分を測定する技術がより正確になったことで、科学界全体で塩分の定義や測定方法を統一する必要が出てきました。 1889年、マーティン・クヌードセンは、ICESから塩分問題を扱う委員会の議長に指名されました。
「塩分とは、1キログラムの海水に溶けている固体物質の総量(グラム)であり、すべての炭酸塩が酸化物に変わり、臭素とヨウ素が塩素に変わり、すべての有機物が完全に酸化された状態である」
この定義は正しく、その後65年間にわたって海洋学者に貢献してきましたが、その方法は実用的ではなく、正確に実行することは困難です。 しかし、この定義は正しく、その後の65年間、海洋学者たちを支えてきました。 もともと塩分濃度は、Cl-含有量(クロリニティ)から算出されていた。 塩分濃度は、標準的なAgNO3溶液を用いて、Ag+によって1,000gの海水から析出することができるハロゲン化物の質量(g)として測定されます。 反応は次のとおりです。
AgNO3(aq)+NaCl(aq)→AgCl(s)+NaNO3(aq)
Knudsen氏らは、9か所から採取した大量のサンプルを分析した結果、塩素含有量から塩分濃度を算出する式を開発しました。
S = 1.805 ″Cl^-″ + 0.03 ″g / kg″ ″qquad″ (1)
ここで、塩素度Cl-は、海水試料0.3285234kg中のハロゲンを完全に析出させるのに必要な銀の質量として定義されます:
Cl- = 328.
Revised salinity definition 1966
式(1)からわかるように、この方法には限界があり、完全に正しいわけではありません: 塩分濃度が0のとき、塩分濃度は0.03です。 さらに、CarrittとCarpenter(1959)は、この関係を用いて塩素度の測定値から塩分濃度の計算値の不確かさは、0.04g / kgにもなると推定しています。 これは、いくつかの海水サンプル(バルト海)の化学組成にばらつきがあることと、塩素度を定義するために9つの異なる場所でしかサンプリングされなかったことに起因しています。60年代初頭、導電率ブリッジの開発により、塩分濃度を非常に高い精度(± 0.003 g / kg)で測定できるようになりました。 ブリッジでは、試料とブリッジの校正に用いる標準海水との導電率の比が得られる。 しかし、標準海水は塩素濃度の測定用に開発されたもので、導電率の測定用には開発されていなかったため、新たに導電率の標準をJoint Panel for Oceanographic Tables and Standards (JPOTS)に委託した。 世界各地の塩分、温度、導電率の新たな測定結果をもとに、塩素度の常用公式は次のように改訂されました:
S = 1.80655 ˶, Cl^- .
Practical Salinity Scale-1978 / EOS-80
WHAT IS PSU? by Frank J. Millero in Oceanography Magazine, 1993
『Oceanography』の最新号を手にした私は、中表紙のSea-Birdの広告に苛立ちを覚えました。 PSUと書かれたTS図が掲載されているのだ。 この用語の使用を中止するように会社に働きかけることはできませんでしたが、海洋学者が出版物にこの用語を使用することについて懸念を表明するために、この手紙を書くべきだと思いました。 この用語は、Practical Salinity Scaleの使用を示すもので、Practical Salinity Unitの略です。国際的な海水の状態の方程式とPractical Salinity Scaleの開発に貢献したJoint Panel on Oceanographic Tables and Standardsのメンバーとして、私はPSUを使用するという海洋学者が採用していると思われる慣習に驚いています。 実用塩分濃度計は、単位のない導電率比と定義されていました。 15℃で導電率が1.0の海水試料に、32.4356gの質量を持つKCl水溶液を1kg入れた場合、塩分濃度は35.000となります(単位や‰は必要ありません)。 蒸発または水で希釈された海水の重量に対するこの比率の塩分と温度依存性により、実用的な塩分濃度目盛の完全な定義が導き出されました。 この定義は、すべての国内および国際的な海洋学組織によって採用されました。 いつの頃からか、海洋学者は、実用塩分目盛が導電率塩分の測定に使用されていることを示すために、PSU(practical salinity unit)という用語を使うようになりました。 これは、それまで1000分の1を表すのに‰を使っていたため、海洋学者の中にはこれを単位と感じる人がいたからだと考えられます。 要するに、塩分は常に比率であり、物理的な単位は持っていないということです。 PSUという言葉を現場で使うことは許されるべきではありませんし、発表された論文の中でも使われるべきではありません。 塩分濃度の測定に実用的な塩分濃度計を使用する場合は、論文のどこかにその旨を記載する必要があります。 PSSという用語の使用は、Practical Salinity Scaleを使用していることを示すために使用できます。 TSデータを示すすべての図にPSUという用語を使用する必要はありません。 また、UNESCO(1985年)は、海洋学の分野での単位の使い方を丁寧にまとめたSUNレポートを発表していることも指摘しておきます。 この報告書は、すべての国際海洋学会でも採用されていますが、海洋学者や海洋データを掲載する雑誌では一般的に使用されていません。 海洋学の分野が科学として認められるためには、化学や物理学の分野で基本となっている単位を採用しなければなりません。
海水中のさまざまな溶存塩の重量比は、世界中のどこの海でもほぼ同じです。
海水中のさまざまな溶存塩の重量比は、世界の海のどこでもほぼ同じです。これは沿岸海域でも同様ですが、塩淡境界域の低塩分では標準組成からのずれが大きくなります。 海水中の溶存塩の組成はほぼ同じであるため、海水の塩分濃度は、海水が淡水で希釈されている度合いから求めることができる。 塩分濃度と導電率の関係を明確にするため、PSS(Practical Salinity Scale)が導入された。 この関係は、塩分濃度S=35の15℃で32.4356gのKClを含む1kgの標準溶液の導電率C(35,15)と海水の導電率の比Rに基づいています。
塩分濃度S(T)と導電率R=R(S,T)の関係は、すべての海とバルト海、黒海、地中海、紅海から採取した表層100m以内の天然海水135試料について、異なる温度Tにおける塩素濃度と導電率を精密に測定したものです。 塩分濃度を塩分濃度に変換した後、(2)の関係を用いて、最小二乗法により以下の多項式を算出しました。
S(T)=S(15)+\Delta S(T),\qquad R=Largefrac{C(S,T)}{C(35,15)}normalsize,\qquad (3)
S(15)=0.008-0.1692,R^{1/2}+25.3851\,R+14.0941\,R{3/2}-7.0261\,R^2+2.7081\,R^{5/2} , ˶ˆ꒳ˆ˵ )
Delta S(T)= ˶ˆ꒳ˆ˵ )
Delta S(T)= ˶ˆ꒳ˆ˵ )
Delta S(T)= ˶ˆ꒳ˆ˵ )
T-15}{1+0.0162(T-15)}\normalsize (0.0005-0.0056\,R^{1/2} \\ -0.0066\,R-0.0375\,R^{3/2}+0.0636\,R^2-0.0144\\ (5)
for 2 \\, 42 and atmospheric pressure,
S(15) ♪approx 0.586 ♪, C^{1.0876},
S(15) ♪approx 0.586 ♪, C^{1.0876}.
ただし、塩分濃度を正確に測定するためには、絶対的な導電率を正確に測定することができないため、標準海水に対する導電率を測定し、塩分-導電率関係(3-5)を適用することが望ましい。
実用塩分濃度目盛は、1980年にUNESCO/SCOR/ICES/IAPSOの「海洋学の表と標準に関する合同パネル」とSCORのワーキンググループ51(JPOTS)によって海洋学の国際標準として採用された。 また、温度スケールIPTS-68とPSS-78(Lewis and Perkin, 1981)に基づいたEOS-80(Equation Of State of Seawater)がMilleroら(1980)によって発表されています。
- International Equation of State of Seawater (EOS-80)の多項式表現のいくつかは、熱力学的なMaxwellの相互微分関係に正確に従っていないため、完全には一致しません。
- 1970年代後半から、純水のより正確な熱力学的記述が登場しました(IAPWS-95)。
- 異なる海洋盆地における海水の組成の変化が海水の密度に与える影響がよりよく理解されるようになりました。
- 海洋が地球の熱機関の重要な一部であることが強調されるようになったため、海洋における熱流束をより正確に決定できるように、海水のエンタルピーと内部エネルギーの正確な表現が必要になった(エンタルピーと内部エネルギーはEOS-80からは入手できなかった)。
- 温度スケールがITS-68からITS-90に改訂され、元素の原子量が改訂されました。
絶対塩分濃度S_Aは、その温度と圧力における海水サンプル中の溶解した非H2O物質の質量分率として定義され、単位はg / kgで表されます。 したがって、密度塩分とも呼ばれます。 海水試料中のH2Oの質量分率は、1-0.001 S_Aで表されます。 この定義は、「何が水を構成し、何が溶解物質を構成するか」という問題に正しく対応しています(例えば、ある質量のCO2を純水に溶解すると、CO2、H2CO3、HCO3-、CO32-、H+、OH-、H2Oの混合物が生成され、その相対的な割合は、温度、圧力、pHに依存する解離定数に依存するため、本質的に水の一部が溶解物質に変化します。
絶対塩分濃度S_Aの値は、実用塩分濃度Sの値とわずかに異なります。標準的な組成の海水の場合、S_A = ˶ˆ꒳ˆ˵ )
S_A = ˶ˆ꒳ˆ˵ )
絶対塩分濃度S_Aは、実用塩分濃度Sの値とわずかに異なります。
つまり、実用塩分35の基準海水試料の場合、絶対塩分は35.16504g / kgとなります。 海中の任意の場所で採取された非標準海水の場合、絶対塩分濃度S_Aと式(6)の差は平均で約0.0107g / kgとなります。 絶対塩分濃度S_Aをg / kgで表した値と、それに対応する実用塩分濃度Sの値は、約0.5%以下の差であることが知られています。 実用塩分を用いると、導電率、温度、圧力の測定値から(ほぼ)直接求められるという利点がありますが、絶対塩分は一般的に、これらの測定値に加えて、よく確立されていないことが多い他の測定値や相関関係の組み合わせから導き出されます。
塩分の生物学的影響

水分子(青)が塩分子(赤)よりも通過しやすい半透膜を介して浸透していきます。 塩分濃度が膜の両側で等しくなるまで、塩分分子よりも水分分子の方が膜を通過して海水の区画に入ります。 これにより、海水コンパートメントの圧力(いわゆる浸透圧)が上昇する。 Adapted from ZME Science.
すべての生物は、細胞を維持するために、体内の水と溶質のバランスを保っています。 これをホメオスタシスといいます。 これを調節するために、水に溶けたり浮いたりしている物質に対して透過性のある膜を介して、溶質を輸出入することができます。 溶解した物質が透過性のある膜をランダムに移動することを拡散という。 拡散は、膜の両側の濃度が等しくなるまで起こる。 溶質が膜を通過できない場合は、膜を通過する水の正味の動きによって両側の濃度が等しくなります。 溶質の濃度差に応じて半透膜を介して水が正味で移動することを「浸透」と呼ぶ。 これは細胞の生存に不可欠である。 外側の塩分濃度が内側よりも高い場合、細胞は水分を失い、脱水状態になり、死に至ります。 逆の場合は、細胞は水を吸収して膨らみ、場合によっては破裂する。 このような理由から、生物は時間とエネルギーをかけて恒常性を維持するのです。
塩分センサー 海水密度 河口における海水の侵入と混合 河口の循環 ソルトウェッジ河口 棚の海との交換
他の方もこの記事の内容を編集している可能性がありますので、ご了承ください。
- この著者による他の記事はCategory:Souza Dias, Franciscoの記事を参照
- この著者による他の記事はCategory.Souza Dias, Franciscoの記事を参照。TÖPKE, Katrienの記事
- この著者による寄稿の概要については、Special:Contributions/Francisco Souza Dias
- この著者による寄稿の概要については、Special: