海水に溶けている塩やイオンはすべて、その全体の塩分濃度に影響を与えます。 海水の塩分濃度は、通常、海水1キログラム(1000g)あたりの塩のグラム数で表されます。 平均して、1kgの海水には約35gの塩が含まれているので、海の塩分濃度の平均は35ppm(ppt)と言います。 なお、35pptは3.5%(parts per hundred)に相当します。 なお、塩分濃度の値を表すのに、実用塩分単位(PSU)を用いている資料もあり、1PSU=1pptとなっています。
海にはさまざまな物質が溶け込んでいますが、海水に溶け込んでいるイオンの約99.4%は6つのイオンで占められています。 その6つの主要なイオンとは(表5.3.1):
表5.3.1 海水中の6大イオン
| g/kg in 海水 | 重量%のイオン | |
|---|---|---|
| 塩化物Cl-? | 19.35 | 55.07% |
| ナトリウムNa+ | 10.76 | 30.6% |
| 硫酸塩SO42- | 2.71 | 7.72% |
| マグネシウムMg2+ | 1.29 | 3.68% |
| カルシウムCa2+ | 0.41 | 1.17% |
| カリウムK+ | 0.39 | 1.1% |
| 99.36% |
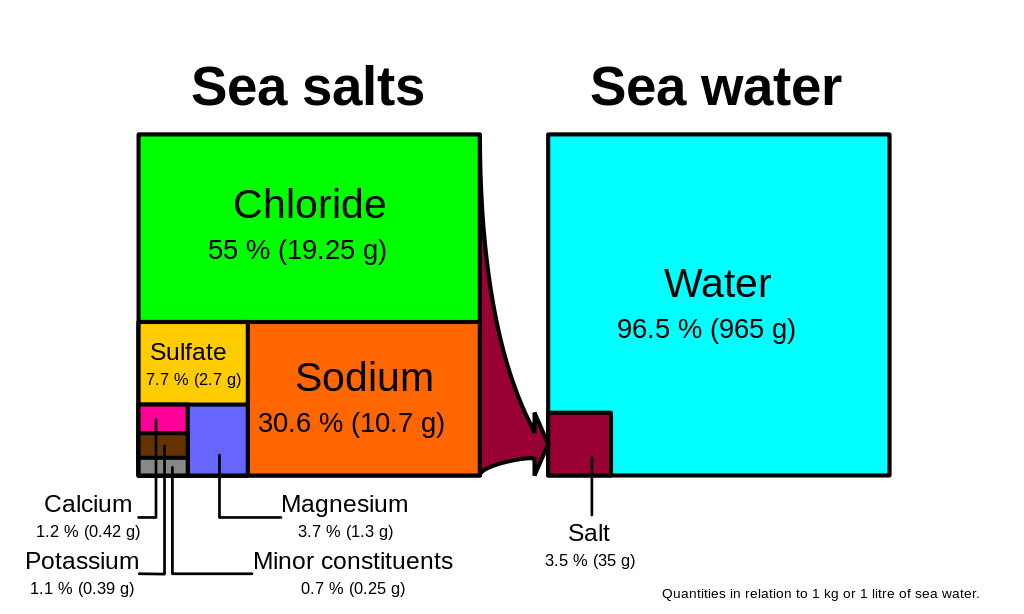
食卓塩(塩化ナトリウムNaCl)の成分である塩化物とナトリウムは、海中のイオンの85%以上を占めており、海水が塩辛く感じるのはそのためです(図5.3.1)。 主要成分に加えて、放射性核種、有機化合物、金属などの多数の微量成分があります。 これらの微量成分は、はるかに多い主要イオン(ppt)とは異なり、ppm(parts per million)またはppb(parts per billion)の濃度で存在します(表5.3.2)。 ちなみに、1ppmは1mg/kgで、小さじ1杯の砂糖を14,000本のソーダ缶に溶かした量に相当します。 1ppb=1μg/kg、つまり小さじ1杯の物質がオリンピックサイズのプール5個分に溶けていることになります。 これらの微量成分は、数多くの物質を表していますが、合わせても海水中のイオンの1%にも満たないのです。 これらの中には、生物に不可欠なミネラルや微量元素として重要なものもありますが、全体の塩分濃度にはあまり影響しません。 しかし、広大な海では、微量にしか存在しない物質であっても、かなり大きな貯留層を形成しています。 例えば、金は海水中に1兆分の1の濃度で存在する微量元素ですが、たった1km3の海水に含まれる金をすべて取り出すことができれば、その価値は約2,000万ドルにもなります!
表5.3.2 海水中のいくつかのマイナーな元素の濃度
| g/kg in 海水 | g/kg in the seawater | ||
|---|---|---|---|
| カーボン | 0.0.028 | 鉄 | 2 x 10-6 |
| 窒素 | 0.0115 | マンガン | 2 x 10-7 |
| 酸素 | 0.006 | 銅 | 1 x 10-7 |
| シリコン | 0.002 | 水銀 | 3 x 10-8 |
| リン | 6 x 10-5 | 金 | 4 x 10-9 |
| ウラン | 3.2×10-6 | 鉛 | 5×10-10 |
| アルミニウム | 2×10-6 | ラドン | 6×10-。 |
海水中の6大イオンは全塩分の99%以上を占めています。 海水中の6つの主要イオンは塩分濃度の99%以上を占めているため、微量成分の存在量の変化は全体の塩分濃度にほとんど影響を与えません。 さらに、「一定割合の法則」とは、海水の絶対的な塩分濃度が場所によって異なっていても、海水中の6大イオンの相対的な割合は常に一定であるというものです。 例えば、海水の塩分濃度がどの程度であっても、その55%は塩化物、30%はナトリウムというように、塩分濃度は一定です。
このように一定の割合であることから、全塩分濃度を計算するには、主要なイオンのうち1つだけの濃度を測定し、その値を使って残りを計算すればよいことになります。 伝統的には、最も多く存在し、正確に測定するのが最も簡単な塩化物が測定されてきました。 塩化物の濃度に1.8をかけると、全塩分濃度が算出されます。 例えば、図 5.3.1 を見ると、19.25 g/kg (ppt) の塩化物 x 1.8 = 35 ppt となります。
水の塩分濃度を測定するには、いくつかの方法があります。 最も正確な測定方法は、実験室で海水を直接化学分析することですが、フィールドですぐに塩分濃度を測定する方法もいくつかあります。

この機器は、光線が液体を通過する際に曲がる度合い、すなわち屈折を測定します。 サンプルに含まれる溶存塩の量が多いほど、光の屈折の度合いは大きくなります。 観察者は青いスクリーンに水滴を写し、接眼レンズを覗きます。
より正確に測定するために、海洋学者の多くは電気伝導度を測定する装置を使用しています。 水に浸した2つの電極の間に電流を流すのですが、塩分濃度が高いほど電流が流れやすくなります(海水中のイオンが電流を流す)。 導電率プローブは、CTD(Conductive, Temperature, and Depthの略)と呼ばれる機器に組み込まれていることが多いが、これは最も一般的に測定されるパラメータである。 最近のCTDには、光、濁度(水の透明度)、溶存ガスなどのパラメータを測定するプローブが多数搭載されている。

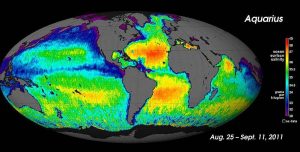
大規模な塩分濃度の測定には、海洋学者は人工衛星を使用することができます。例えば、Aquarius衛星は7日ごとに海面をマッピングし、0.2PSUという小さな塩分濃度差を測定することができました(下図)。
大部分の海では一定の割合のルールが適用されますが、沿岸部では河川の放流が多いためにこの割合がわずかに変化する場合があることを認識することが重要です。 さらに、一定の割合の法則は、主要なイオンにのみ適用されることを覚えておく必要があります。 マイナーイオンの割合は変動するかもしれませんが、塩分濃度全体に占める割合は非常に小さいことを覚えておいてください。
なぜ、主要なイオンは一定の割合で存在するのでしょうか? 河川の流出などで常にイオンが入力されていますが、通常は海中とは全く異なる割合で入力されています。 では、なぜ海の中の割合は変わらないのでしょうか? 河川から流出するイオンの多くは、生物学的プロセスで使用されるため、海水中のイオンに比べて滞留時間(5.2項参照)がかなり短くなっています。 このように滞留時間が短いため、イオンが蓄積されて塩分濃度が変化することはありません。 また、世界の海の混合時間は約1000年であり、数千万年にも及ぶ主要なイオンの滞留時間に比べて非常に短い。
塩分濃度の変化
外洋の全塩分濃度は平均して33〜37pptですが、場所によっては大きく異なります。 しかし、主要なイオンの割合は一定なので、地域による塩分濃度の違いは、イオンの添加や除去というよりも、水の投入や除去によるものと考えられます。 淡水の投入は、降水、陸地からの流出、氷の融解などのプロセスによって行われます。 淡水の除去は、主に蒸発と凍結によるものです(海水が凍結すると、できあがった氷はほとんどが淡水で、塩分が除かれるため、残った水はさらに塩分濃度が高くなります)。 そのため、降水量、蒸発量、河川流量、氷の生成量などの違いが、地域ごとの塩分濃度の変化に大きく影響します。 例えば、バルト海の表面塩分濃度は10ppt程度と非常に低いのですが、これはバルト海がほとんど密閉された水域であり、河川からの流入が多いためです。
地球上で最も塩分濃度の高い大きな水域の1つが、イスラエルとヨルダンの間にある死海です。 死海の塩分濃度は約330pptで、海の約10倍の塩分濃度があると言われています。 このように塩分濃度が非常に高いのは、中東の高温多湿な環境下で蒸発量が多いことに起因します。 また、1950年代にヨルダン川の流れが死海から逸れたため、死海への真水の流入がなくなった。 淡水が入ってこない上に蒸発量が多いため、死海の水位は年間約1メートルの割合で後退しています。 死海は塩分濃度が高いため、水の密度が高く、そのため浮力が働き、人は簡単に水面に浮くことができます。 しかし、塩分濃度が高いということは、ほとんどの生物にとっては塩分濃度が高すぎるということでもあり、微生物しか生息できないため、死海と呼ばれています。 しかし、死海は塩分濃度が高いとはいえ、地球上で最も塩分濃度の高い水域ではない。
緯度による変化
塩分濃度のパターンを決定するには、地域的な条件が重要ですが、さらに調査が必要なグローバルなパターンもあります。 気温は赤道付近で最も高く、極地付近で最も低いため、赤道付近では蒸発量が多く、塩分濃度が高くなると考えられます(図5.3.2)。 しかし、下の図では、赤道付近の塩分濃度が高緯度の地域よりも少し低くなっているように見えます。 これは、赤道地域では定期的に大量の雨が降るため、赤道沿いの表層水が希釈されるためです。 つまり、塩分濃度が高いのは、蒸発量が多く、降水量が少ない亜熱帯の温暖な緯度の地域なのです。 極地では蒸発が少ないため、氷や雪の融解と相まって、表面の塩分濃度は比較的低くなります。 下の図は、地中海の塩分濃度が高いことを示しています。これは、蒸発量の多い温暖な地域に位置しており、北大西洋の他の水との混合からほとんど隔離されているため、塩分濃度が高くなっています。
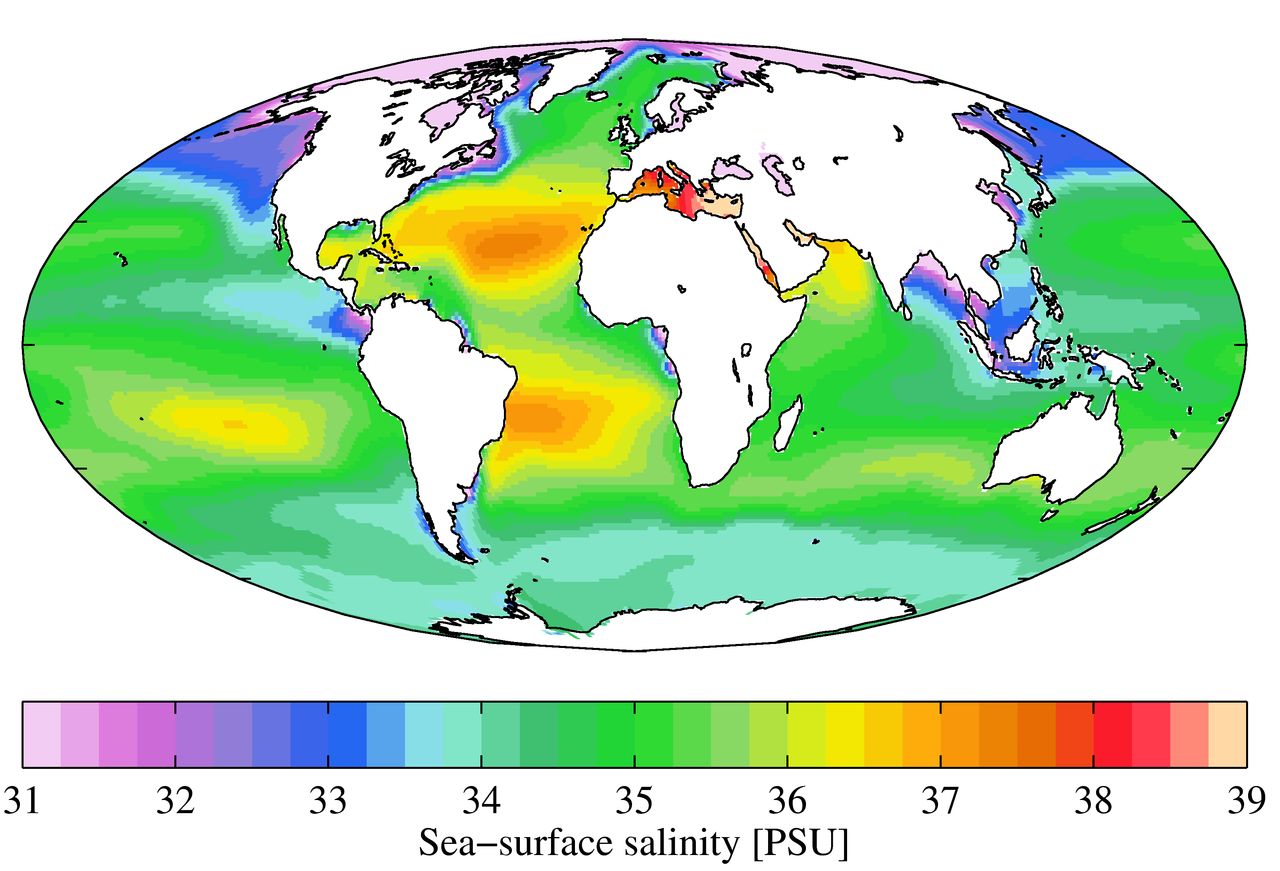
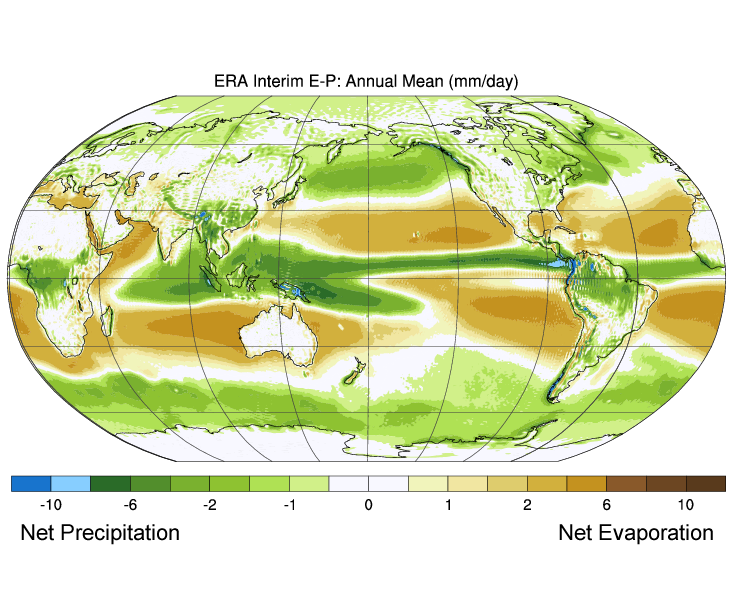
図5.3.3は、蒸発量と降水量の差(蒸発量-降水量)の世界平均を示したものです。 緑色は降水量が蒸発量を上回っている地域、茶色は蒸発量が降水量を上回っている地域を表しています。 図5.3.2に見られるように、降水量、蒸発量、表面塩分の相関関係にも注目してください。
垂直方向の変化
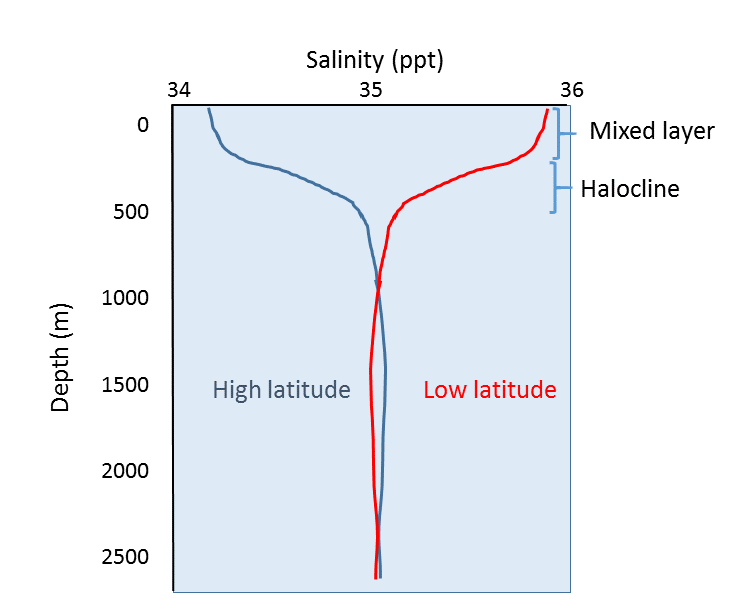
塩分濃度の地理的な変化に加えて、深さによる塩分濃度の変化もあります。 これまで見てきたように、塩分濃度の違いのほとんどは、蒸発、降水、流出、氷結などの変化によるものです。 これらのプロセスはすべて深海ではなく海面で起こるので、塩分濃度の違いが最も顕著に現れるのは表層水であるはずです。 深海の塩分濃度は、これらの表層のプロセスの影響を受けないため、比較的均一です。 代表的な塩分濃度分布を図 5.3.4 に示します。 表層では、上位 200m 程度は混合層と呼ばれ、比較的均一な塩分濃度を示します。 風、波、表層流が表層水をかき混ぜることで、この層では多くの混合が起こり、塩分濃度がかなり均一になります。 混合層の下には、わずかな深さの変化で塩分濃度が急激に変化する領域があります。 この急激な変化の領域は「ハロクライン」と呼ばれ、混合層と深海の間の移行点となっています。 ハロクラインの下では、塩分濃度に影響を与える表層のプロセスから離れているため、塩分濃度は海底までほとんど変化しません。 下の図では、上述したように、高緯度では表層の塩分濃度が低く、低緯度では表層の塩分濃度が高いことに注目してください。
電子を得たり失ったりして、電荷を帯びた原子や分子(5.1)
水中の溶存イオンの濃度(5.3)
塩分濃度を表す1000分の1という単位のない尺度(5.3)
海中のイオンの99%以上を構成する6つのイオン(塩化物、ナトリウム、硫酸塩、マグネシウム、カルシウム、カリウム)(5.3)
海水中の主要なイオンは、全体の塩分濃度にかかわらず、常に同じ割合で含まれている(5.3)
全体の塩分濃度に関わらず、その割合が同じであるイオン;海水中の主要なイオン(5.3)
塩分濃度の変化により、その割合が変動する海水中のイオン(5.
地表を横切るか、一連の水路の中で斜面を下る水の流れ (12.2)
ある元素が除去されるまでに海にとどまる平均時間 (5.2)
parts per thousand
赤道からの角度として測定された赤道の北または南の距離(2.
海の最上層で、風、波、海流が水を混ぜ合わせて条件が比較的一定になるところ;約100mの深さ(5.3)
わずかな深さの変化で塩分濃度に劇的な変化があるところ(5.3)
div