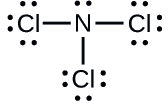形式電荷の計算
分子内の原子の形式電荷とは、結合中の電子を原子間で均等に再分配できた場合に、原子が持つであろう仮想的な電荷のことである。 別の言い方をすると、中性原子の価電子の数を取り、非結合電子を差し引き、さらにルイス構造でその原子に結合している結合の数を差し引くと、形式電荷が生じるということです。
従って、形式電荷は次のように計算します:
形式電荷=(「自由な」元素の価電子)-(非共有電子)-(結合)
形式電荷の計算をダブルチェックするには、構造全体の形式電荷の和を求めます。 分子内のすべての原子の形式電荷の合計はゼロでなければならず、イオンの形式電荷の合計はイオンの電荷と等しくなければなりません。
原子について計算された形式電荷は、分子内の原子の実際の電荷ではないことを忘れてはなりません。
ルイス構造から形式電荷を計算する
ハロゲン間イオン\(ICl4-}\)の各原子に形式電荷を割り当てます。
解答
すべての\{I-Cl}\の結合について、結合電子対を均等に分けます
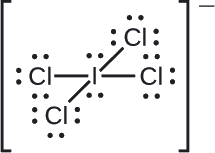
それぞれの原子に孤立電子対を割り当てます。
この数を中性原子の価電子の数から引きます。
- I: 7 – 8 = -1
- Cl: 7 – 7 = 0
すべての原子の形式電荷の合計は-1になり、これはイオンの電荷(-1)と同じです。
Exercise ̶̶̶̶̶̶̶̶̶̶̶̶̶̶̶̶̶̶̶̶̶̶̶̶̶̶̶̶̶̶̶̶̶̶̶̶̶ : 一酸化炭素分子の各原子の形式電荷を計算してください

答え
C -1, O +1
Calculating Formal Charge from Lewis Structures
ハロゲン間分子\{BrCl3}\の各原子に形式電荷を割り当てます。
解答
各Br-Cl結合の電子のうち1つをBr原子に、1つをCl原子に割り当てます。
この数を中性原子の価電子の数から引きます。 この数を中性原子の価電子の数から引くと、形式電荷が得られます:
- Br:
- Br: 7 – 7 = 0
- Cl: 7 – 7 = 0
中性分子と同じように、\\のすべての原子の形式電荷は0であり、形式電荷の合計は0になります。
Exercise ˶‾᷅˵‾᷅˵
\{NCl3}\の各原子の形式電荷を決定してください。
Answer
N: 0; 3つのCl原子。 0