- 現代の原子理論を述べる
- 原子がどのように構成されているかを学ぶ
元素の同一性を維持する最小の部分を原子と呼びます。 個々の原子は非常に小さいものです。 1cmの長さの線を作るには、約5,000万個の原子が並んでいなければなりません。 印刷された文章の最後にあるピリオドには、数百万個の原子が含まれています。
化学において原子が基本的な役割を果たしているという考え方は、1808年にイギリスの科学者ジョン・ダルトンが発表した近代的な原子論によって形式化されました。
- すべての物質は原子で構成されている。
- 同じ元素の原子は同じで、異なる元素の原子は異なる。
- 原子は整数の比率で結合して化合物を作る。
これらの概念が化学の基礎となっています。
原子の語源はギリシャ語で「不可分」を意味しますが、原子自体は素粒子と呼ばれる小さな部品から構成されていることがわかっています。 最初に発見されたのは電子で、負の電荷を持つ小さな素粒子です。 電子はよくe-と表現され、右の上付き文字が負の電荷を表しています。 その後、2つの大きな粒子が発見されました。 陽子はプラスの電荷を持つ、より巨大な(しかしまだ小さい)素粒子で、p+と表されます。 中性子は、陽子とほぼ同じ質量を持つが電荷を持たない素粒子である。 中性子は、陽子とほぼ同じ質量を持つが電荷を持たない素粒子で、nまたはn0と表される。 このように、すべての元素の原子は、電子、陽子、そして(1つの例外を除いて)中性子で構成されていることがわかっています。 この3つの素粒子の性質をまとめたのが表3.1「3つの素粒子の性質」です
表3.1 三つの素粒子の性質
| 名前 | 記号 | 質量(約.; kg) | 電荷 |
|---|---|---|---|
| 陽子 | p+ | 1.6 × 10-27 | 1+ |
| 中性子 | n, n0 | 1.6 × 10-27 | none |
| 電子 | e | 9.1×10-31 | 1- |
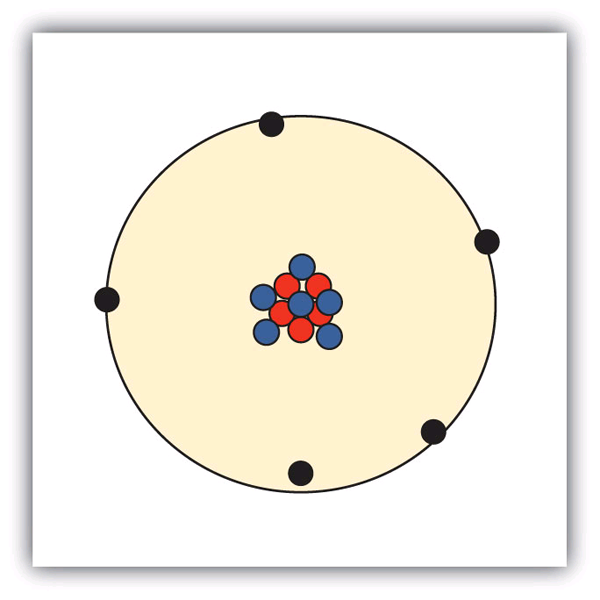
これらの粒子は、原子の中でどのように配置されているのでしょうか。 ランダムに並んでいるわけではありません。 1910年代にイギリスで行われたアーネスト・ラザフォードの実験により、原子のモデルは「核」であることが判明しました。 比較的質量の大きい陽子と中性子は、原子の中心にある原子核(複数の核)と呼ばれる領域に集まっています。 電子は原子核の外側にあって、原子核の周りの空間を回って過ごしています。
図3.1 原子の構造
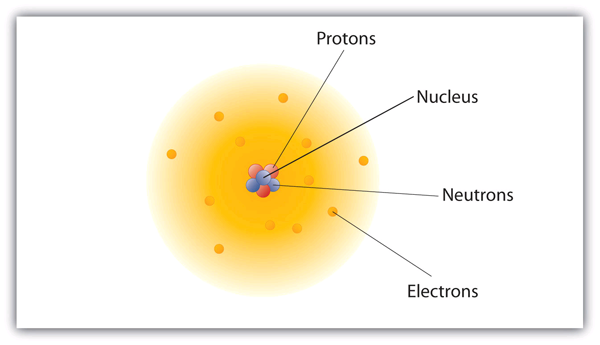
原子は、陽子と中性子が中心にあって原子核を作り、電子が原子核の周りを回っています。
現代の原子論では、ある元素の原子は同じで、異なる元素の原子は異なるとされています。 異なる元素の原子は何が違うのでしょうか。 同じ元素のすべての原子に共通する基本的な特徴は、陽子の数です。 水素原子の陽子は1個だけ、鉄原子の陽子は26個です。 この陽子の数は、原子の正体を知る上で非常に重要であり、元素の原子番号と呼ばれている。 つまり、水素の原子番号は1、鉄の原子番号は26である。
しかし、同じ元素の原子でも、中性子の数が異なる場合があります。
しかし、同じ元素の原子でも中性子の数が異なることがあり、同じ元素(陽子の数が同じ)でも中性子の数が異なる原子を同位体といいます。 自然界に存在するほとんどの元素は同位体として存在する。 例えば、ほとんどの水素原子は、原子核内に1個の陽子を持っています。 しかし、ごく少数(100万個に1個程度)の水素原子は、陽子と中性子を持っています。 このような水素の同位体を重水素といいます。 また、ごくまれに陽子1個と中性子2個を持つ水素があり、これはトリチウムと呼ばれています。
中性原子は、陽子と同じ数の電子を持っているので、全体の電荷はゼロです。
例題1
- 最も一般的な炭素原子は、原子核に6個の陽子と6個の中性子を持っています。
- ウランの同位体の原子番号は92、質量数は235です。
解答
- 炭素原子の原子核に6個の陽子があれば、原子番号は6です。 中性子も6個あれば、質量数は6+6の12となります。
Test Yourself
スズ原子の原子核に含まれる陽子の数は50、中性子の数は68です。
答え
原子番号=50、質量数=118
原子を指すとき、私たちは単に元素の名前を使います。 しかし、常に元素名を使用するのは扱いにくいものです。 その代わり、化学では元素ごとに記号を定めています。 原子記号は、元素の名前を1文字または2文字で省略したものです。 慣習的に、元素の記号の最初の文字は常に大文字で、2番目の文字(ある場合)は小文字である。 したがって、水素の記号はH、ナトリウムの記号はNa、ニッケルの記号はNiとなります。 ほとんどの記号は元素の英語名に由来するが、一部の記号は元素のラテン語名に由来する。 表3.2「一般元素の名称と記号」に、一般的な元素とその記号を示します。 表3.2「一般元素の名前と記号」の記号は、化学の世界ではこのようにして元素を表現することになりますので、覚えておいてください。2 一般的な元素の名前と記号
要素 NameSymbol
| 要素 名前 | シンボル | ||||
|---|---|---|---|---|---|
| アルミニウム | アル | td | 水銀 | Hg | |
| アルゴン | Ar | モリブデン | Mo | ||
| ヒ素 | As | A | ネオン | ||
| バリウム | ニッケル | ニ | |||
| ベリリウム | Be | 窒素 | N | ||
| ビスマス | Bi | 酸素 | O | ||
| Boron | B | Palladium | Pd | ||
| 臭素 | Br | リン | P | ||
| カルシウム | Ca | 白金 | Pt | ||
| 炭素 | C | カリウム | K | ||
| 塩素 | Cl | ラジウム | Ra | ||
| クロム | ラドン | Rn | |||
| コバルト | コ | ルビジウム | Rb | ||
| 銅 | Cu | スカンジウム | Sc | ||
| フッ素 | F | セレン | Se | ||
| ガリウム | Ga | シリコン | Si | ||
| ゲルマニウム | Ge | 銀 | Ag | ||
| 金 | Au | Sodium | Na | ||
| Helium | He | Strontium | Sr | ||
| Hydrogen | H | 硫黄 | S | ||
| ヨウ素 | I | タンタル | Ta | ||
| イリジウム | Ir | 錫 | Sn | ||
| 鉄 | チタン | Ti | |||
| クリプトン | Kr | タングステン | W | ||
| Lead | Pb | Uranium | U | ||
| Lithium | Li | Xenon | Xe | ||
| マグネシウム | 亜鉛 | 亜鉛 | |||
| マンガン | マンガン | ジルコニウム | Zr |
元素は周期表と呼ばれる特別な表にまとめられています。 簡単な周期表は図3.2「A Simple Periodic Table」に、より詳細な周期表は第17章「付録。 第17章「付録:元素の周期表」には、より詳細な周期表が掲載されています。 周期表の元素は、原子番号の昇順に並んでいます。 周期表は特殊な形をしていますが、これは原子の中の電子の構成を考えるときに重要になってきます(第8章「電子構造」参照)。 周期表をすぐに使えるのは、金属と非金属の識別です。 非金属は、周期表の右上にあり、周期表の右部分を分割している太い線の片側にあります。 それ以外の元素はすべて金属です。
図3.2 簡単な周期表
原子記号を使って同位体を表現する簡単な方法があります。
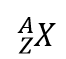
ここで、Xは元素の記号、Aは質量数、Zは原子番号です。
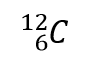
ここでCは元素の記号、6は原子番号、12は質量数を表しています。
例題2
- 原子番号92、質量数235のウランの同位体の記号は何ですか。
- 26Feの陽子と中性子の数は?
解答
- この同位体の記号は
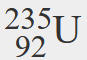
- この鉄原子の陽子は26個、中性子は56 – 26 = 30個です。
Test Yourself
11Nの陽子は何個ですか
Ans
11個の陽子
また、同位体を示すために元素名の後に質量数を記載することもよくあります。
重要なポイント
- 化学は、すべての物質が原子で構成されているという現代の原子論に基づいています
- 原子自体は陽子、中性子、電子で構成されています。
- 元素は原子番号を持ち、原子番号は原子核内の陽子の数に等しい。
- 元素の同位体は中性子の数が異なる。
- 元素は原子記号で表される。
- すべての元素を整理した表が周期表である。
Exercises
現代の原子理論を構成する3つの記述を挙げなさい
原子がどのように構成されているかを説明しなさい。
陽子と電子ではどちらが大きいですか
中性子と電子ではどちらが大きいですか
3つの素粒子のそれぞれの電荷は何ですか
3つの素粒子のそれぞれの電荷は何ですか。
原子の質量のほとんどはどこにあるのですか
原子核に陽子が5個、中性子が6個あるホウ素原子の図を描いてみてください。
原子核に2個の陽子と2個の中性子を持つヘリウム原子の図を描いてみましょう
原子番号を定義してください。 ホウ素原子の原子番号は何番ですか。
ヘリウムの原子番号は何番ですか。
同位体を定義し、例を挙げてください。
重水素とトリチウムの違いは何ですか。
アイソトープを表すペアはどれですか
a) ![]()
b) 26Fと25M
c) 14Sと15P
14.
a)20Cと19K
b)26Fと26F
c)92Uと92U
15.
a)陽子8個、中性子8個の酸素原子
b)陽子19個、中性子20個のカリウム原子
c)陽子3個、中性子4個のリチウム原子
16.
a)陽子が12個、中性子が12個のマグネシウム原子
b)陽子が12個、中性子が13個のマグネシウム原子
c)陽子が54個、中性子が77個のキセノン原子
17. アメリシウム241は、煙探知機に使われる同位体です。 この同位体の完全な記号は何ですか
18. 炭素14は、過去に生きていた物質の放射性年代測定テストを行うために使用される同位体です。 この同位体の完全な記号は何ですか?
19. 各元素の原子記号を述べよ。
a)ナトリウム
b)アルゴン
c)窒素
d)ラドン
20. 各元素の原子記号をあげてください。
a)銀
b)金
c)水銀
d)ヨウ素
21. 元素の名前を教えてください。
a)Si
b)Mn
c)Fe
d)Cr
22.
a)F
b)Cl
c)Br
d)I
答え
すべての物質は原子で構成されており、同じ元素の原子は同じで、異なる元素の原子は異なり、原子は整数比で結合して化合物を形成します。
陽子は電子よりも大きい。
原子番号とは、原子核に含まれる陽子の数です。
同位体とは、同じ元素でも中性子の数が異なる原子のことです。 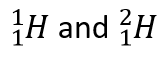 がその例です。
がその例です。
a) 同位体
b) 同位体ではない
c) 同位体ではない
a) ![]()
b) 19K
c) ![]()
95A
a)Na
b)Ar
c)N
d)Rn
a)シリコン
b)マンガン
c)鉄
d)クロム
です。