グリコーゲン分解(グリコーゲンの分解)は、必要なときにグルコースを放出するものです。
- 夜間断食などの絶食状態で、
- 食事と食事の間に、
- 高強度の運動をしているときに、
- 分解が行われます。
肝細胞では、グリコーゲン分解はグルカゴンやアドレナリンによって刺激され、インスリンによって抑制され、グルコースによってもネガティブアロステリックな制御を受けます(後述)。
筋肉では、グリコーゲンは筋活動のエネルギー源であるため、グリコーゲンの分解は収縮時に行われ、活動に関与する筋肉でのみ行われます。
筋肉細胞では、グリコーゲン分解はアドレナリンによって刺激され、AMPとカルシウムイオン(Ca2+)、ATPとグルコース6-リン酸という正負のアロステリックエフェクターによってそれぞれ制御されています(下図)。
CONTENTS
- グリコーゲン分解のステップ
- 筋肉と肝臓におけるグルコース1-リン酸の代謝運命
- 筋肉と肝臓におけるグリコーゲン分解の共有結合制御
- β-?アドレナリン受容体
- 刺激性Gタンパク質
- アデニルシクラーゼ
- プロテインキナーゼA
- ホスホリラーゼキナーゼ
- 筋肉および肝臓におけるグリコーゲン分解のアロステリック制御
- 筋肉ホスホリラーゼキナーゼ
- 肝臓ホスホリラーゼキナーゼ
- 筋肉ホスホリラーゼキナーゼ
- 肝 ホスホリラーゼキナーゼ
- 筋グリコーゲンホスホリラーゼ
- PP1のアロステリック制御
- 肝グリコーゲンホスホリラーゼ
グリコーゲン分解のステップ
グリコーゲン分解は、グリコーゲンホスホリラーゼ(EC 2.4.1.1)の作用で始まる。この酵素の活性には、ピリドキシンまたはビタミンB6の誘導体であるピリドキサール-5-リン酸の存在が必要である。 この酵素は、α-(1,4)グリコシド結合のリン酸化による切断を触媒し、グルコース分子を外枝の非還元末端(4′-OH基が遊離している末端)から一度に1つずつ遊離させる。
グリコーゲン(n個のグルコース残基)+Pi→グルコース1-リン酸+グリコーゲン(n-1個のグルコース残基)
注:小腸では、膵臓のα-アミラーゼ(EC 3.2.1.1)がデンプンのα-(1,4)グリコシド結合の加水分解を触媒し、グルコース分子を生成する。
生体内では、グリコーゲンホスホリラーゼが不可逆的なリン酸化を触媒し、骨格筋や心臓にとって特に有利な反応となる(後述)。 この反応の不可逆性は、通常100以上の比率/によって保証されている。
グリコーゲンホスホリラーゼは、分岐の非還元末端で繰り返し作用し、分岐点から4残基離れたグルコースユニットに到達すると停止します。これが限界デキストリンの外郭です。 この時点で、同じポリペプチド鎖上に存在する2つの酵素活性がグリコーゲンの分解を完了する。α-(1,4)-グルカン-6-グリコシルトランスフェラーゼ(EC 2.4.1.24)とアミロ-α-(1,6)-グルコシダーゼまたはデブランチングエンザイム(EC 3.2.1.33)である。 第一の酵素活性は、残りの4つのグルコースユニットのうち3つを枝から別の枝の非還元末端に移し、第一の鎖にはα-(1,6)-グリコシド結合で鎖に結合している1つのグルコースユニットだけを残す。
枝がなければ、グリコーゲンホスホリラーゼは次の限界デキストリンに到達するまでグルコースユニットを除去し続けることができます。
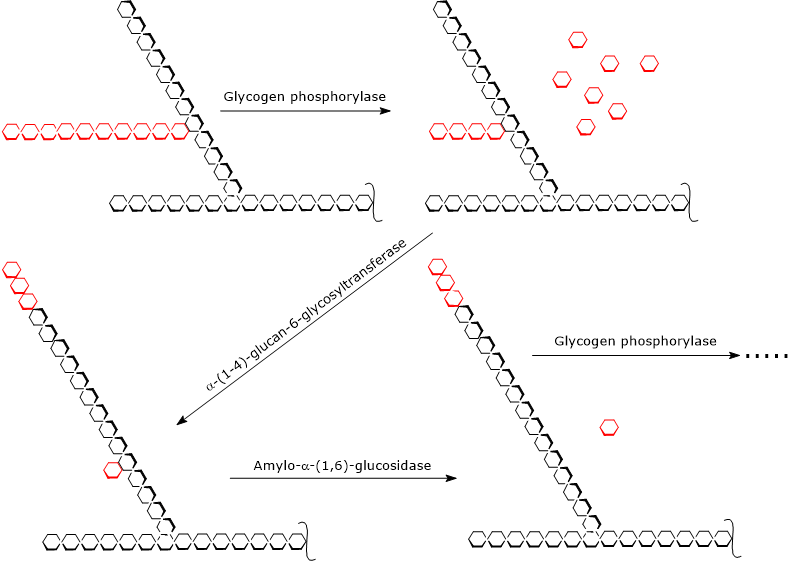
従って、3つの酵素活性によって触媒される反応の生成物は以下の通りです。
- グルコース1リン酸(放出されたグルコース分子の約90%);
- 少量の遊離グルコース(残りの10%);
- 小さくて分岐していないグリコーゲン分子。
筋肉と肝臓におけるグルコース1リン酸の代謝運命
グルコース1リン酸は電荷を帯びた分子であるため、細胞内に捕捉されます。
グルコース6-リン酸への変換は、ホスホグルコムターゼ(EC 5.4.2.2)が触媒する反応で行われます。 この酵素は、2つの分子の相対的な濃度によって方向が決まる可逆的な反応を触媒し、この場合はリン酸基をC1からC6へと移動させます。
グルコース1-リン酸 ⇄ グルコース6-リン酸
筋肉や他のほとんどの臓器・組織では、グリコーゲン分解で得られたグルコースは、ヘキソキナーゼが触媒する活性化ステップをバイパスして、グルコース6-リン酸として解糖に入ります。 したがって、グリコーゲンホスホリラーゼは、すでに活性化されたグルコース分子を放出することで、ATPを節約することができる。
このようにして、グリコーゲン合成に必要な活性化エネルギーの一部が保存されます。
Glycogen(n glucose residues) + 3 ADP + 3 Pi → Glycogen(n-1 glucose residues) + 2 Lactate + 3 ATP
肝臓では、グリコーゲンからのグルコース6リン酸がグルコース6リン酸分解酵素(EC 3.1.3.9)によって脱リン酸され、血流に放出されます。 以上が、肝グリコーゲン分解によるリン酸化されたグルコースの形でのグルコースユニットの除去のステップである。
グリコーゲン(n個のグルコース残基)+Pi → グルコース1-リン酸+グリコーゲン(n-1個のグルコース残基)
グルコース1-phosphate → glucose-6-phosphate
glucose-6-phosphate + H2O → glucose + Pi
全体の式は以下の通りです。
グリコーゲン(n個のグルコース残基)+H2O → グリコーゲン(n-1個のグルコース残基)+グルコース
筋肉と肝臓におけるグリコーゲン分解の共有結合制御
グリコーゲンの分解は、ホスホリラーゼキナーゼ(EC 2.7.11.19)などのいくつかの重要なタンパク質の共有結合および/またはアロステリック修飾によって、細かく制御されています。7.11.19)、グリコーゲンホスホリラーゼ、プロテインホスファターゼ1などの主要なタンパク質の共有結合やアロステリック修飾によって制御されています。
- 副腎から分泌されるアドレナリン(エピネフリンとも呼ばれる)は、筋肉や肝臓、脂肪細胞などに作用します。
これらのホルモンは、膜の受容体に結合すると、細胞内で同一のカスケードを引き起こし、そのシグナルを数桁増幅させて、グリコーゲン分解を促進し、グリコーゲン合成を抑制する。
注意すべきは、アセチルコリンでさえも。
アセチルコリンも、神経筋接合部にある受容体に結合することで、アドレナリンやグルカゴンの活性化と同じカスケードを引き起こすことができます。
β-アドレナリン受容体
アドレナリンやグルカゴンの受容体は、膜貫通型のα-へリックスを7つ持つ膜タンパク質で、
「アドレナリン」という言葉はアドレナリンに由来します。
「アドレナリン」という言葉はアドレナリンに由来していますが、アドレナリン受容体には4つのサブタイプがあります。 α1、α2、β1、β2です。
- 筋肉や肝細胞におけるグリコーゲンの分解の増加
- 脂肪組織におけるトリグリセリドの分解(脂肪分解)の増加
- など、エネルギー代謝の変化を引き起こします。
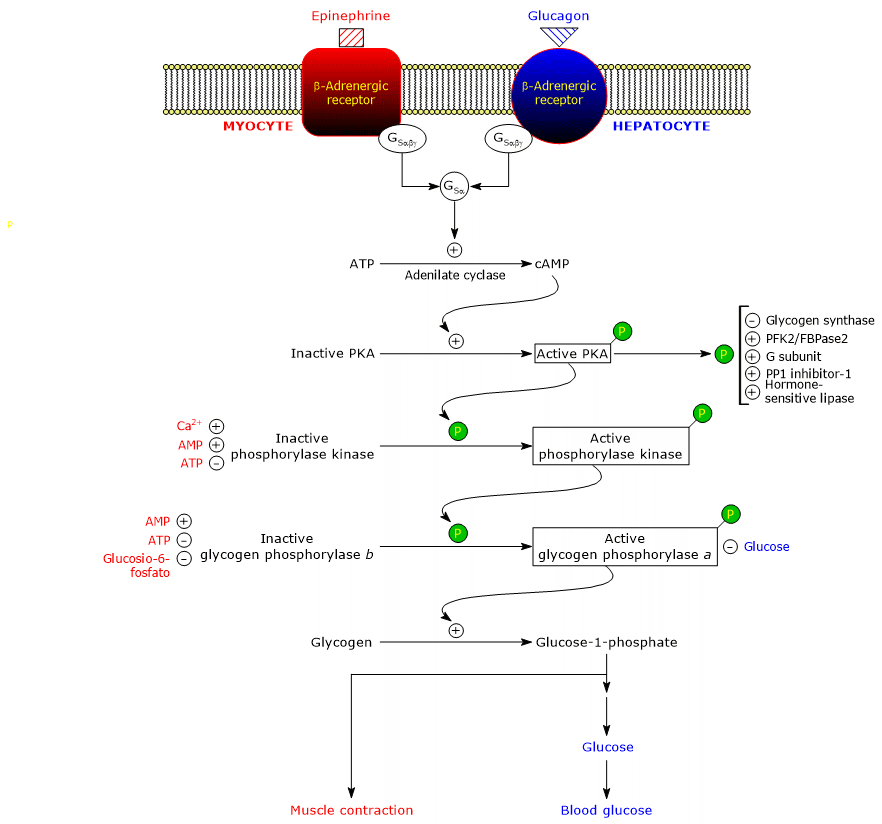
刺激性Gタンパク質
ホルモンが受容体に結合すると、受容体の細胞質部分に構造変化が起こり、それによってカスケードの2番目のタンパク質である刺激性グアニンヌクレオチド結合タンパク質、より単純には刺激性Gタンパク質(GS)との相互作用が変化する。 刺激性Gタンパク質は、α(ヌクレオチド結合部位を含む)、β、γの3つのサブユニットからなるヘテロ三量体で、不活性型のGSαβγ-GDPでは、βアドレナリン受容体と結合します。
受容体の構造変化により、GSαβγ複合体のαサブユニットでGDPがGTPに置き換わる現象が触媒されます。
その結果、三量体が解離して不活性な二量体βγになり、GSα-GTP複合体は共有結合したパルミトイル基で固定された細胞膜の内表面の平面に沿って移動し、アデニル酸シクラーゼ(EC 4.6.
アデニルシクラーゼ
アデニルシクラーゼは、細胞膜側に活性部位を持つ膜貫通型の酵素である。 GSαとアデニルシクラーゼの相互作用により、アデニルシクラーゼが活性化され、ATPからcAMPの合成が触媒される。
GSαはGPTasiといって、結合しているGTPを加水分解してGDPに変えてしまうため、その活性は自分で制限されてしまい、自分では止めることができません。 不活性型では、GSαはアデニルシクラーゼから解離し、Gβγ二量体と再結合します。
プロテインキナーゼA
cAMPはcAMP依存性プロテインキナーゼ(プロテインキナーゼAまたはPKA)(EC 2.7.11.11)に結合して活性化する。 不活性型の酵素は、2つの触媒サブユニットと2つの制御サブユニットからなる4量体である。 2つの制御サブユニットは、それぞれ自己抑制ドメイン、すなわち、各触媒サブユニットの基質の結合部位を占める領域を持っている。 2つのcAMP分子がそれぞれのレギュラトリーサブユニットの2つの部位に結合すると、構造が変化して4量体から解離し、2つの触媒サブユニットが活性型酵素として放出される。
- グリコーゲン合成酵素(EC 2.4.1.
- グリコーゲン合成酵素(EC 2.4.1.11)、阻害;
- ホルモン感受性リパーゼ(EC 3.1.1.79)、活性化;
- ホスホフルクトキナーゼ2/フルクトース-2,6-ビスホスファターゼ(それぞれEC 2.7.1.105とEC 3.1.3.46)、活性化。
cAMPの半減期は非常に短く、サイクリックヌクレオチドホスホジエステラーゼ(EC 3.1.4.53)が触媒する反応で、セカンドメッセンジャー活性を持たないAMPに加水分解されます。
ホスホリラーゼキナーゼ
カスケードの次のステップは、ホスホリラーゼキナーゼによって触媒されます。
このタンパク質は4種類のサブユニットからなり、それぞれが4コピーずつ存在して(αβγδ)4と呼ばれる複合体を形成しています。 αサブユニットとβサブユニットは、酵素が不活性状態から活性状態に切り替わるときにリン酸化されます。 δサブユニットはカルモジュリンとも呼ばれ、カルシウムイオンを結合する調節タンパク質である。 このタンパク質は、他の多くの酵素にも存在している。 カルシウムセンサーとして機能する。つまり、細胞内のカルシウム濃度の変化に反応し、相互作用するタンパク質の活性に影響を与える(後述)。 ホスホリラーゼキナーゼには、肝臓と骨格筋、心筋に発現する2つのアイソフォームがあり、それぞれ異なる遺伝子にコードされたαサブユニットとγサブユニットを持っています。
ホスホリラーゼキナーゼの標的タンパク質の1つがグリコーゲンホスホリラーゼです。この酵素は、さまざまな組織にアイソザイムとして存在し、動的平衡状態にある2つの構造状態で、以下のように呼ばれています:- T(tenseまたはtaut)は活性が低く、
- R(relax)は活性が高く、グリコーゲンに結合することができ、リン酸化された状態でもある(下記参照)。
キナーゼは、グリコーゲンホスホリラーゼの2つのサブユニットのうち、1つのセリン残基(Ser-14)をリン酸化して活性型に変え、逆にほとんどがR型になることでグリコーゲンの分解を促します。
リン酸化された酵素はより活性の高い形で、グリコーゲンホスホリラーゼaと呼ばれ、リン酸化されていない酵素は活性の低い形で、グリコーゲンホスホリラーゼbと呼ばれています。
筋肉の中では、グリコーゲン分解によってグルコース1リン酸が放出され、これが筋肉の中で代謝されて筋肉を収縮させるためのエネルギーとなります。
ストレスのかかる状況が終わると、ホスホリラーズ・キナーゼとグリコーゲンホスホリラーズ・aからリン酸基を除去して不活性型に変えるホスホリラーズ・aホスファターゼ(EC 3.1.3.17)が触媒となります(この酵素はグリコーゲンシンターゼからもリン酸基を除去しています)。 PP1は、触媒効率とグリコーゲンへの親和性が低い触媒サブユニットと、前述のGサブユニットから構成されています。Gサブユニットは、グリコーゲンターゲティングタンパク質と呼ばれる、他のタンパク質をグリコーゲンに結合させるタンパク質のファミリーに属しています(ホスホリラーゼキナーゼ、グリコーゲンホスホリラーゼ、グリコーゲン合成酵素も、このファミリーのタンパク質によってグリコーゲン粒子に結合します)。
PP1は、PP1のインヒビター1と呼ばれる別のタンパク質によっても阻害されます。
先に見たように、PKAはリン酸化します。- Gサブユニットがリン酸化されると、PP1の触媒サブユニットと結合できなくなるため、PP1はグリコーゲンに関連したターゲットを満たすことができません(逆に、インスリン刺激によって誘導されるGサブユニットのリン酸化は、様々なアミノ酸残基に影響を与え、PP1の触媒サブユニットとの結合を可能にします)。
- インヒビター-1は、リン酸化された形でPP1の活性を阻害することができるものである。
従って、ホルモンがその受容体に結合すると、特にPP1の活性を阻害するカスケード反応が引き起こされます。 PP1はグリコーゲンホスホリラーゼとグリコーゲンシンターゼの両方をリン酸化し、グリコーゲンホスホリラーゼは活性化され、グリコーゲンシンターゼは抑制されます。
筋肉と肝臓におけるグリコーゲン分解のアロステリック制御
グリコーゲン分解は、ポジティブおよびネガティブのアロステリックエフェクターによっても制御されている。
筋肉のホスホリラーゼキナーゼ
酵素活性は2つの正のアロステリックエフェクターであるカルシウムイオンとAMP、1つの負のアロステリックエフェクターであるATPによって制御されています。
細胞内のカルシウムイオン濃度の上昇が筋収縮のシグナルとなり、筋小胞体から放出されたカルシウムは酵素のδサブユニット(カルモジュリン)に結合して活性化されます。
AMPは、激しい収縮時にATPが消費されることで筋肉内に蓄積され、酵素に結合して活性化されます。 逆に、ATP濃度が高いとき、つまり筋肉が収縮していないときには、AMPのアロステリックサイトに結合してキナーゼを不活性化します。肝臓のホスホリラーゼキナーゼ
ホルモンの中には、標的タンパク質の共有結合による修飾と、小胞体からのカルシウムイオンの放出の両方に作用するものがあります。
肝臓では、カルシウムイオンの放出を引き起こすホルモンによって、ホスホリラーゼキナーゼが制御されています。 肝臓のホスホリラーゼキナーゼは、カルシウムイオンを放出させるホルモンによって制御されています。その例として、バソプレシンや、α1受容体に結合したアドレナリンがあります。 アドレナリンの場合、α1受容体に結合するとGタンパク質が活性化され、ホスホリパーゼC-βが刺激されて、ホスファチジルイノシトール-4,5-二リン酸がイノシトール1,4,5-三リン酸(IP3)とジアシルグリセロールに変換される。 イノシトール1,4,5-三リン酸は、小胞体からカルシウムイオンの放出を引き起こす。筋グリコーゲンホスホリラーゼ
筋グリコーゲンホスホリラーゼbは、高濃度のAMPの存在下で活性化される。AMPは、特定のヌクレオチド結合部位に結合することで酵素の四次構造を変化させ、アロステリック平衡をb型の活性R状態にシフトさせる。
筋肉のグリコーゲンホスホリラーゼaは、AMP、ATP、グルコース-6-リン酸の量に関係なく活性化します。
安静時の筋肉では、ほぼすべてのグリコーゲンホスホリラーゼが不活性なb型になっています。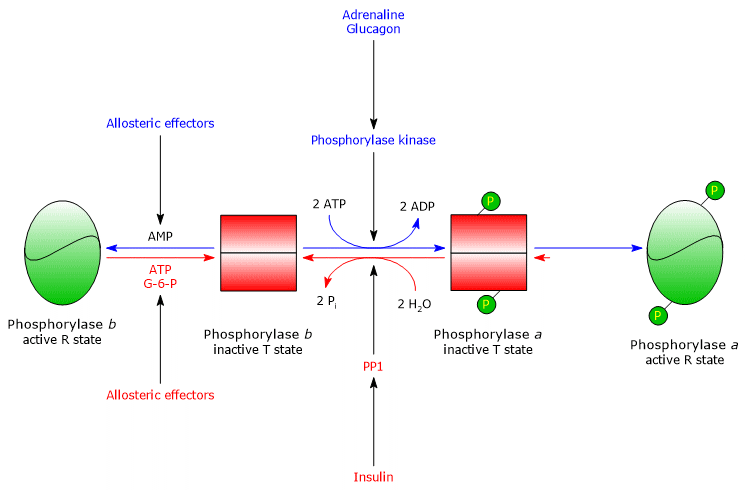
Regulation of Muscle Glycogen Phosphorylase 実際には、筋肉のグリコーゲンホスホリラーゼには、共有結合とアロステリック制御があります。 酵素の共有結合とアロステリックな制御により、細胞内のグルコースレベルが細かく制御されています。
- 十分なエネルギーがある細胞が、活性化のカスケードを引き起こすホルモンシグナルを受け取った場合、グリコーゲンホスホリラーゼbは、ATPとグルコース-6-リン酸によって阻害され、エネルギーが高くなるまでT状態を維持します。
- 細胞のエネルギーが低い場合、グリコーゲンホスホリラーゼbは、AMPによって活性化され、活性型aフォームへの変換を誘導するホルモン刺激がなくても、グリコーゲンの分解を開始します。
PP1のアロステリックな制御
PP1はグルコース-6-リン酸によってアロステリックに活性化されるため、細胞のエネルギーチャージが低いときに活性化されます。
肝グリコーゲンホスホリラーゼ
肝臓では、酵素のアロステリック制御は異なるメカニズムで行われます。
- 第一の違いは、AMPに対する反応に関するもので、肝グリコーゲンホスホリラーゼbはAMPでは活性化されません。
- 2つ目の違いはグリコーゲンホスホリラーゼaに関するもので、この酵素は競合阻害剤であるグルコースによって阻害されます(単糖類はアロステリック平衡をa型の不活性なT状態にシフトさせます)。
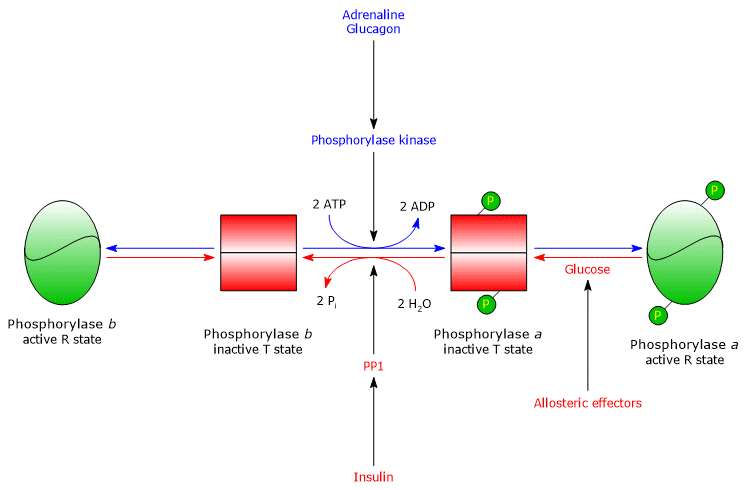
Regulation of Hepatic Glycogen Phosphorylase 肝臓では。 グリコーゲン分解の目的は、血糖値が低いときに他の組織にブドウ糖を供給することです。 血糖値が正常に戻ると、肝細胞内の濃度が上昇し、グリコーゲンホスホリラーゼaと結合して構造変化を誘発し、リン酸化されたセリン残基がPP1活性にさらされ、脱リン酸化により酵素が不活性化されるという。 したがって、肝グリコーゲンホスホリラーゼのグルコースに対するアロステリックサイトは、この酵素が血糖値の変化に適切に反応する血糖値センサーとして機能することを可能にする。 最終的には、肝アイソザイムはAMPではなくグルコースにのみ反応し、すなわち細胞のエネルギーチャージに反応する。このことは、グルコースではなく脂肪酸が肝臓の主要なエネルギー源であることからも注目される。
Berg J.M., Tymoczko J.L., and Stryer L. Biochemistry. 5th edition. W. H. Freeman and Company, 2002
Nelson D.L., M. Cox M.M. Lehninger. 生化学の原理. 4th Ed. W.H.Freeman and Company, 2004
Rawn J.D. Biochimica. Mc Graw-Hill, Neil Patterson Publishers, 1990
Roach P.J., Depaoli-Roach A.A., Hurley T.D., Tagliabracci V.S. Glycogen and its metabolism: some new developments and old themes. Biochem J 2012:441;763-87. doi:10.1042/BJ20111416
Rosenthal M.D., Glew R.H. Medical Biochemistry – Human Metabolism in Health and Disease. John Wiley J. & Sons, Inc., Publication, 2009
となっています。