腫瘍の成長と増殖
正常な状態では、mTORは細胞の成長と分裂の主要な制御因子である。 しかし、腫瘍細胞では、異常に活性化されたmTORが、腫瘍細胞の成長、転移、新しい健康な組織への侵入を促すシグナルを送る。 その中でも、PI3K/phosphate and fungi homology deleted on chromosome 10 (PTEN)/AKT/TSC経路は、mTORC1の主な活性化因子であり、この経路の遺伝子変異は悪性腫瘍を引き起こす可能性がある . さらに、PTENの発現は、エピジェネティック、遺伝子、転写後の修飾によって排除され、ほとんどの悪性腫瘍でPI3K/Akt/mTOR経路をアップレギュレートすることが多い。
Houらは、肝細胞癌(HCC)においてPTEN遺伝子の変異がPI3K/PTEN経路の異常な活性化をもたらすことを発見した。 さらに、PTEN遺伝子を欠損させると、B7-H1の発現が誘導され、これが免疫抑制につながり、腫瘍の進行と浸潤を増大させる . 肝癌では、PI3K/PTEN/Akt/mTOR経路が活性化されると、マトリックスメタロペプチダーゼ9(MMP-9)の発現が上昇し、腫瘍の浸潤と転移に関与する。 同様に、PI3K/Akt/mTORシグナル伝達経路は、大腸がん幹細胞(CCSC)の増殖と生存を制御していることがわかっている。 散発的な大腸癌では、CCSCは再発や転移の原因となる可能性がある。 Xieらは、レバーキナーゼB1(LKB1)遺伝子の変異や細胞外の成長シグナルがmTORC1を活性化することを発見した。 MTORC1は、RNF168の60番目のセリンをリン酸化することで、RNF168(ring finger protein 168)タンパク質の活性を阻害し、その分解を促進する。 これにより、DNA損傷後のヒストンH2AおよびH2AヒストンファミリーメンバーX(H2AX)のユビキチン化修飾が著しく低下し、DNA損傷に対する反応が阻害され、ゲノムの安定性が低下することで、悪性細胞の形質転換やがんの発生が促進されることになる。 また、既存の研究では、RhebはGTPが負荷されるとmTORC1に結合して活性化するGTPaseであることがわかっている。 Dengらは、成長因子のシグナルによってRhebのユビキチン化が制御されることを報告している。 ユビキチン化されたRhebは、TSC2へのRhebの結合を促進することでRhebの活性を阻害し、mTORC1の発現を抑制することにつながる。 mTORC1経路に加えて、mTORC2経路も腫瘍細胞の発生・発達の制御に関与している。 Wangらは、OTU deubiquitinase 7B (OTUD7B)がGβLのユビキチン化レベルを低下させてGβLがSIN1と相互作用するのを防ぎ、mTORC2/AKTシグナル経路の活性化とmTORC1発現のダウンレギュレーションをもたらすことを明らかにした。 これにより、AKTの発がんシグナルが部分的に活性化され、腫瘍化が促進される。 しかし、ユビキチンリガーゼであるTNF受容体関連因子2(TRAF2)は、GβLのユビキチン化レベルを上昇させることで逆の効果をもたらす。 同様に、Kovalskiらは、Rasの変異がmTORC2のmTORとmitogen-activated protein kinase-associated protein 1 (MAPKAP1)に結合してmTORC2キナーゼの活性を促進し、下流の増殖性細胞周期の転写プログラムを開始させることを証明した。
まとめますと、mTORは腫瘍において常に刺激され、腫瘍細胞の成長、生存、増殖を維持し、腫瘍細胞の生物学において重要な役割を果たしています(図1)。 1)
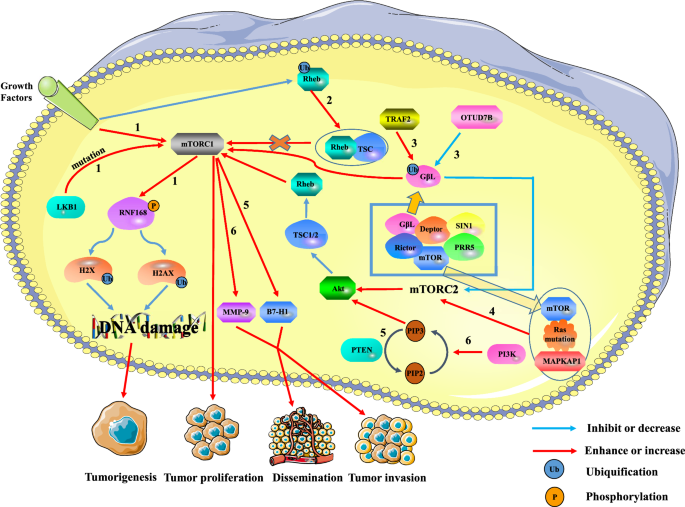
mTORと腫瘍の関係について。 mTORC1の過剰活性化は腫瘍の形成、増殖、転移を促進し、mTORC2はmTORC2/AKT/TSC/Rehb経路を通じてmTORC1の発現を制御することができます。 経路1:細胞外の成長シグナルと細胞内のLKB1変異によりmTORC1が活性化され、RNF168をリン酸化することでDNA損傷後のヒストンH2AとH2Aのユビキチン化を低下させる。 これにより、DNA修復が損なわれ、腫瘍の形成が促進されます。 経路2:Rhebのユビキチン化は、RhebのTSC2への結合を促進することでRhebの活性を低下させる。 Rhebのダウンレギュレーションにより、mTORC1の活性化が抑えられ、腫瘍の成長が抑制されます。 経路3:TRAF2とOtud7Bはそれぞれ、mTORC2のGβLのユビキチン化レベルを上昇または下降させることで、mTORC1/2の活性を制御する。 TRAF2は、mTORC1の活性を高め、mTORC2の活性を抑制した。 mTORC2の発現を低下させると、AKT/TSC/Rehb/mTORC1経路が不活性化されるものの、全体としてはmTORC1の活性が増強される。 しかし、Otud7BはTRAF2に対しては逆の効果を持つ。 経路4:変異したRasがmTORC2のmTORとMAPKAP1に結合し、mTORC2の発現を促進する。 mTORC2のアップレギュレーションは、AKT/TSC/Rehb/mtORC1経路を介して腫瘍の増殖を促進する。 経路5:PTEN遺伝子の欠失は、B7-H1の発現を誘導し、腫瘍の進行と浸潤を増加させる。 経路6:PI3K/PTEN/AKT/mTOR経路は、MMP-9をアップレギュレートすることで、肝がんの浸潤・転移に関与している
腫瘍の代謝
mTORは、栄養素が十分にあるときに活性化され、同化とエネルギーの貯蔵・利用を促進します。 栄養素が比較的不足しているときは、mTORの活性化を抑制して、細胞の物質やエネルギーを安定させる必要があります。 腫瘍細胞は、成長と分裂のニーズに応えるために、大量のタンパク質、脂質、ヌクレオチドを必要とする。
乳がん細胞では、PI3K/AKT/mTORC1/ステロール制御エレメント結合タンパク質(SREBP)経路が、新たな脂質合成を誘導し、腫瘍の増殖を促進する主なメカニズムとなっています。 ピルビン酸キナーゼ(PK)は糖代謝に関与し、脂肪酸合成酵素(FASN)は脂肪酸(FA)の合成に関与しています。 Taoらは、ピルビン酸キナーゼM2(PKM2)の発現を低下させると、AKT/mTORシグナル伝達経路が不活性化され、SREBP-1cの発現が低下することを発見した。 SREBP-1cの発現量が減少すると、FASN遺伝子の転写が阻害されてFAの生成が抑制され、その結果、腫瘍細胞の増殖が抑制される。 さらに、Di Maltaらは、アップレギュレーションされた転写因子エンハンサー(TFE)遺伝子が、Rag GTPase/mtORC1経路を活性化することを報告している。 正常な細胞では、この経路が活性化されることで、細胞が栄養を吸収しやすくなり、生理的な機能を維持することができる。 しかし、腫瘍細胞では、急速に成長する腫瘍細胞の栄養ニーズを満たすために、この経路が過剰に活性化されることが多い。 しかし、Guriらは、肝細胞においてmTORC2がスフィンゴミエリンとカルジオリピンの産生を促進することを明らかにした。 一方、スフィンゴミエリンと心臓リン脂質は、ともに細胞のバイオフィルムの構造成分である。 一方、心臓リン脂質の代謝と輸送はミトコンドリアの正常な機能に寄与しているため、急速に増殖する腫瘍細胞では大量に供給されなければならない。
上述のように、腫瘍細胞の代謝はmTOR経路によって制御され、増殖や栄養の必要性を満たすことができます。 逆に、腫瘍細胞の代謝は、mTOR経路を通じて腫瘍の成長を促進することもできます。 Ericksenらは、分岐鎖アミノ酸(BCAA)分解の低下がmTORC1の活性を高めることで、腫瘍の発生・発達を促進する可能性があることを実証しました。 また、BCAA分解過程の鍵となる酵素の活性は、腫瘍の浸潤と高い相関関係があると結論づけている。 したがって、肝腫瘍組織におけるBCAA異化作用の阻害によるBCAAの蓄積は、腫瘍のmTORC1の慢性的な活性化の主要なメカニズムであると考えられる。 同様に、Shiらは、胃癌(GC)組織におけるアデノシンA2a受容体(A2aR)の発現が増加しており、A2aRの発現はGCのステージと正の相関があることを示した。 この結果は、アデノシンがA2aRに結合することでPI3K/AKT/mTORシグナル経路を活性化し、最終的にGCの進行を促進することを示唆している。 Madak-Erdoganらは、遊離脂肪酸(FFA)がエストロゲン受容体α(ERα)とmTOR経路を活性化し、ER(+)乳がん細胞の高い増殖性と浸潤性に相関していることを明らかにした。
これらの研究は、mTORシグナル伝達経路が腫瘍の代謝と密接に関係していることを示しており、mTOR阻害剤と腫瘍の代謝を阻害するいくつかの薬剤の併用が理論的に支持されることになります(図2)。
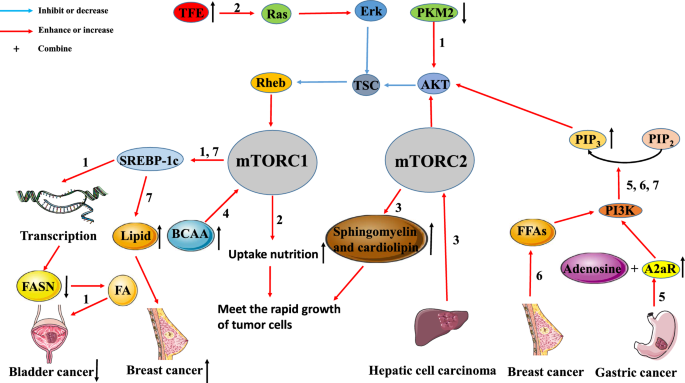
腫瘍の代謝とmTORシグナル伝達経路の相互関係。 mTOR経路は、腫瘍の代謝と密接に関係しています。 経路1:膀胱がんでは、PKM2の発現をダウンレギュレーションすると、不活性化されたAKT/TSC/Rehb/mTORC1経路を介してSREBP-1の発現が低下します。 SREBP-1cのダウンレギュレーションは、FASNの転写を阻害することでFAの生成を抑制し、腫瘍の成長を抑制することにつながる)。 経路2:腫瘍におけるTEFのアップレギュレーションは、Ras/Erk/TSC/Rehb/mtORC1経路を活性化します。 この経路の活性化により、腫瘍細胞による栄養分の取り込みが促進され、腫瘍の急速な成長のニーズを満たすことができる。 経路3:HCCはmTORC2を活性化することにより、スフィンゴミエリンとカルジオリピンの産生を増加させることができる。 大量のスフィンゴミエリンとカルジオリピンは、細胞膜を組み立てるために使用され、これもまた急速な腫瘍増殖のニーズを満たすものである。 経路4:BCAAの蓄積は、mTORC1を活性化することで、腫瘍の発生・発達を促進する。 経路5:胃がんで高発現しているA2aRは、アデノシンと結合してPI3K/AKT/mtORC1経路を活性化する。 経路6:乳がんでは、FFAがPI3K/AKT/mtORC1経路を活性化することで、腫瘍の増殖や転移を促進する。 経路7:PI3K/AKT/mtORC1/SREBP経路は、新たな脂質合成を誘導することで乳がんの増殖を促進する
免疫細胞
腫瘍は、腫瘍細胞を認識して殺す免疫システムの能力を抑制することで、免疫寛容を獲得することができる。
T細胞
骨髄から出てきたT前駆細胞は胸腺に入り、そこでαβT細胞とγδT細胞の2種類の細胞に分化していきます。 Yangらは、遺伝子ノックアウト実験により、mTORC1のRAPTORが欠損すると、T細胞が分化する際の酸化代謝や糖代謝のリモデリングプロセスが壊れることを証明した。 これにより、活性酸素種(ROS)の産生が誘発され、αβT細胞の分化が阻害され、γδT細胞の分化が促進される。 さらに、Essigらは、ロクインがPI3K/mTOR経路の発現をダウンレギュレートすることを明らかにした。 PI3K/mTOR経路のダウンレギュレーションは、従来のT細胞の分化・活性化を阻害するだけでなく、Treg細胞の特殊化を制限する。 Pollizziらは、マウスモデルにおいて、mTORC1の活性化が、高い糖化能を有するCD(cluster of differentiation)8+エフェクターT細胞の産生を促進することを見出した。 これらのT細胞は、エフェクター表現型を保持しているが、メモリー表現型には変換しない。 一方、mTORC1の活性が低下したT細胞は、メモリー細胞の特徴を持つが、エフェクター細胞に分化できず、代謝機能が欠損しているため、免疫記憶反応を起こすことができない。 さらに、mTORC1はCD8+ T細胞のエフェクター機能に影響を与え、mTORC2の活性はCD8+ T細胞のメモリー能力を制御することが明らかになりました。
一般的に、mTORシグナル経路はT細胞の分化と機能に影響を与えます。
ナチュラルキラー細胞と樹状細胞
mTORシグナル伝達経路は、T細胞を制御するだけでなく、樹状細胞(DC)やナチュラルキラー(NK)細胞の分化や機能にも密接に関係しています。 樹状細胞は強力な抗原提示能力を持ち、NK細胞は生体内で重要な免疫細胞である。 Wangらは、mTORC1とmTORC2がユニークな方法でNK細胞の作用を制御していることを証明した。 mTORC2は、主にSTAT5(Signal Transducer and Activator of Transcription 5)/SLC7A5(solute carrier family 7 member 5)軸を阻害することで、NK細胞の機能を負に制御していることがわかった。 一方、mTORC1は、CD122を介したインターロイキン(IL)-15のシグナル伝達経路を維持することで、mTORC2の活性を正に制御している。 近年では、NK細胞に加えて、DCもmTORシグナル伝達経路に関係していると考えられている。 Chenらは、骨髄単核(BMM)細胞由来のDCのアポトーシスが、mTOR阻害剤で処理すると減少すると結論づけている。 また、BMM細胞由来のDCは抗原提示能力が高く、これらのDCで活性化されたe7特異的細胞傷害性CD8+Tリンパ球は抗腫瘍活性が高いこともわかった。 したがって、mTOR阻害剤は、DCの寿命を延ばし、抗原提示能力や抗原処理能力を向上させることで、腫瘍免疫療法の効果を高めることができる。
マクロファージ
M1型マクロファージは複数の方法で腫瘍細胞を殺すことができるが、M2型マクロファージは腫瘍の発生、浸潤、転移を促進する。 Zhihuaらは、GCではマイクロRNA(miRNA)-30cの発現が著しく低下していることを報告しています。 さらに、低酸素誘導因子-1α(HIF-1α)がmiRNA-30cの発現を抑制することも明らかになった。 miRNA-30cのダウンレギュレーションは、腫瘍関連マクロファージのmTOR活性と解糖作用を低下させる。 これは最終的に、M1型マクロファージの分化と機能を阻害することで、GCの成長と転移を促進するだろう。
一般的に、腫瘍でしばしば活性化されるmTOR経路は、免疫細胞の分化と機能を調節することで腫瘍の成長を促進する。
腫瘍の薬剤耐性
腫瘍細胞の分子経路を標的にすることは、さまざまながんを治療する方法ですが、腫瘍は必然的に薬剤耐性を獲得します。
消化器系の腫瘍
ミトコンドリアの非結合タンパク質2(UCP2)が、ミトコンドリアの代謝によって発生する活性酸素を減少させることで、複数の抗がん剤に対する腫瘍の抵抗性をもたらすという研究結果が発表されました。 Dandoらは、ゲニピンとエベロリムスを併用することで、膵臓腺癌(PAAD)細胞の増殖を相乗的に抑制し、腫瘍細胞のオートファジーを誘導できることを証明した。 これは、PADD細胞のUCP2を阻害すると、活性酸素依存的なメカニズムでAkt/mTOR経路が活性化され、UCP2阻害剤であるゲニピンの抗増殖効果が低下するためであると考えられる。 GCでは、ジンクフィンガータンパク質GLI1を介したヘッジホッグ経路が主要な役割を果たしている。 しかし、Yaoらは、AKT/mTOR経路がGLI1を活性化することを明らかにした。
呼吸器系腫瘍
DNA修復や細胞周期チェックポイントを標的としたwee1阻害剤AZD1775は、一部の肺がん患者に有効であることが示されているが、薬剤耐性もよく見られる。 この点についてSenらは、AZD1775耐性の小細胞肺がん(SCLC)ではAXL受容体チロシンキナーゼ(ARK)の発現が上昇していることを明らかにした。 ARKは、直接またはmTORを介して、細胞外制御タンパク質キナーゼ(ERK)経路を活性化し、チェックポイントキナーゼ1(CHK1)をリクルートして活性化することができる。 これらの結果は、ARKがCHK1を活性化することでDNA損傷修復を促進し、最終的にWee1の阻害効果を無効にすることを示唆している。 同様に、Yeらは、非小細胞肺がん(NSCLC)において、transmembrane-4 L-six family member-1(TM4SF1)が、discoid domain receptor 1(DDR1)/Akt/ERK/mTOR経路の発現を調節することで、化学療法剤に対する腫瘍の感受性を制御していることを明らかにしました。
腎臓がん、皮膚がん
チロシンキナーゼ阻害剤(TKI)は、腎細胞がん(RCC)の治療に用いられますが、一部のRCC患者は薬剤耐性を獲得します。 Ishibashiらは、インターロイキン6受容体(IL-6R)阻害剤と低用量のTKI阻害剤を併用することで、TKI阻害剤を単独で使用した場合と比較して、in vivoでのRCCの成長と血管新生の抑制に効果があると報告している。 これは、低用量のTKI阻害剤が高レベルのIL-6を誘導し、AKT/mTOR経路を活性化するためである。 これらの結果は、一部のRCC患者におけるTKI阻害剤の失敗のメカニズムが、mTORシグナル伝達経路を活性化するIL-6の上昇に関係していることを示唆しています。
B-Rafプロトオンコジーン(BRAF)の変異は、非黒色腫皮膚がん(NMSC)で発生しますが、BRAF阻害剤はこのような腫瘍には使用されていません。 その主な理由は、BRAF変異のあるNMSCには、BRAF阻害剤に対する一次耐性または二次耐性があるからです。 Sen氏らは、PI3K/mTORシグナル経路とBRAF阻害剤耐性に強い相関関係があることを発見しました。 このことから、mTOR経路の活性化がBRAF変異NMSCのBRAF阻害剤への耐性につながる可能性が示唆された。 さらに、Obenauf氏らは、BRAF、未分化受容体チロシンキナーゼ(ALK)、上皮成長因子受容体(EGFR)の各阻害剤が、がん細胞にいくつかの分泌シグナルを誘導し、それが薬剤耐性のある腫瘍細胞の増殖や転移につながっていることを発見した。 さらに研究を進めると、BRAF阻害剤を投与したメラノーマ細胞では、転写因子FOS関連抗原-1(FRA1)のダウンレギュレーションによって複数のシグナル伝達経路が活性化され、その中でもPI3K/AKT/mTOR経路が主要な役割を果たしていることがわかった。 BRAFとPI3K/AKT/mTORのシグナル伝達経路を同時に阻害すると、薬剤耐性を持つBRAF変異ヒトメラノーマ細胞の増殖を抑制することができる。
以上の研究から、腫瘍細胞は細胞内のmTORシグナル伝達経路を活性化することで抗腫瘍剤による細胞死を回避できることが示唆されており、mTORシグナル伝達経路の活性化は腫瘍における薬剤耐性のメカニズムの一つであると考えられる。
オートファジーとがんのアポトーシス
オートファジーは、損傷した小器官やミスフォールドしたタンパク質を除去することでゲノムを安定に保つことができるため、がん細胞の成長を抑制する効果があります。 一方で、オートファジーは腫瘍に多くの栄養分を供給し、過酷な環境に対処する能力を強化します。
Sunらは、mTORが前立腺がん細胞のグリコーゲンシンターゼキナーゼ-3(GSK-3)の発現を阻害すると結論づけています。 GSK-3のダウンレギュレーションは、カスパーゼ-3のシグナル伝達経路を阻害し、ROSの生成を減少させることにつながる。 活性酸素の減少は、腫瘍細胞のアポトーシスを阻害し、前立腺がん細胞を保護する。 しかし、Zouらは、mTORC2が、がんの阻害剤であるプロテインホスファターゼ2A(CIP2A)がプロテインホスファターゼ2A(PP2A)に結合するのを防ぎ、PP2Aの活性を回復させることを報告した。 PP2Aは、miR-9-3pの転写を低下させ、c-Mycの分解を促進することでE2F転写因子1(E2F1)の発現を上昇させるため、腫瘍細胞のアポトーシスを阻害するのだという。 また、Yangらは、長鎖非コードRNA(lncRNA)CASC9をノックダウンした口腔扁平上皮癌(OSCC)細胞では、p-AKT、p-mTOR、P62およびB細胞リンパ腫-2(BCL-2)の発現が有意に減少し、BCL2関連X(BAX)の発現が増加したと報告している。 これらの結果から、lncRNA CASC9は、AKT/mTOR経路を介してオートファジーを介したアポトーシスを阻害し、OSCC細胞の増殖を促進することが示唆されました。
以上の研究から、mTORシグナル経路は、腫瘍細胞のオートファジーとアポトーシスを制御することで、腫瘍の発生と進行を促進することが明らかになりました。 また、上記の研究は、抗がん剤の標的薬剤の臨床研究にも理論的な裏付けを与えるものであり、大きな意義があると考えられます。