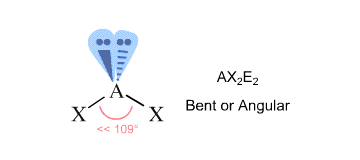二フッ化酸素(#”OF”_2#)は、分子構造が曲がっているため、極性分子です。
この分子構造により、酸素-フッ化物結合に関連する双極子モーメントが互いに打ち消し合って無極性分子になることはありません。
この理由を知るために、この分子のルイス構造を描いてみましょう。
- 酸素原子からの#6#
- 2つのフッ素原子それぞれからの#7#
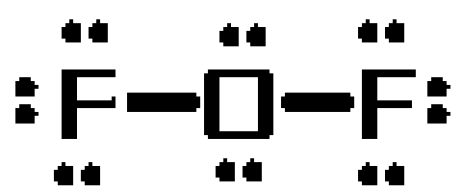
酸素原子は中心原子の役割を果たし、2つのフッ化物原子と単結合を形成します。 この結合は、分子の#20#個の価電子のうち#4#個を占めることになります。
その結果、#16#個の電子がローンペアとして配置されます
- 各フッ素原子上に3つのローンペア
i フッ素原子に3個のローンペア
- 酸素原子に2個のローンペア
さて。 ルイス構造は、分子の形状を伝えるためのものではないことを認識することが非常に重要です。
分子の形状を見つけるためには、中心となる原子を囲む電子密度の領域を数えます。
電子密度の領域は、他の原子との結合(ここでは、単結合、二重結合、三重結合を1つの領域として数えます)と、孤立電子のペアです。
あなたの場合、中心の酸素原子は他の2つの原子と結合しており、2つのローン・ペアに囲まれています#->#それは#4#に等しい立体数を持っています。
VSEPR理論によると、これは#”AX”_2 “E”_2#の分子形状に相当し、曲がりくねった分子に特徴的である。
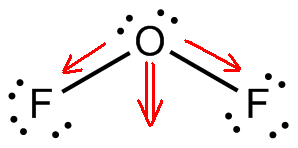
さて。 フッ素と酸素の電気陰性度の違いにより、2つの#”O”-“F “#結合は極性を持つことになります。 屈曲した分子構造により、2つの双極子モーメントがお互いに加算されます。
その結果、永久双極子モーメントが形成されることになります。
iv