- 最初の説明
- どのような人が顕微鏡的多発血管炎になるのか(「典型的な」患者)?
- 顕微鏡的ポリアンジア炎の典型的な症状
- 顕微鏡的ポリアンジア炎に類似した血管炎の形態
- 顕微鏡的ポリアンジア炎の原因は何か
- 顕微鏡的ポリアンジア炎の診断方法は?
- 顕微鏡的多発血管炎の治療と経過
最初の記述
現在、顕微鏡的多発血管炎(MPA)として知られている病気の患者の最初の記述は、1920年代にヨーロッパの文献に登場しました。 しかし、この病気が結節性多発動脈炎(PAN)や他の血管炎とは別の疾患であるという概念が医学的に定着し始めたのは、1940年代後半になってからである。 現在でも、MPAを表す用語の中には、紛らわしいもの(例えば、「顕微鏡的多発血管炎」ではなく「結節性多発動脈炎」)が医学文献に残っています。 この疾患の適切な命名法に関する混乱により、長年にわたり「顕微鏡的多発動脈炎」や「過敏性血管炎」と呼ばれていました。 1994年、Chapel Hill Consensus Conferenceは、MPAを独自の疾患として認識し、PAN、多発血管炎を伴う顆粒腫症(GPA、旧ウェゲナー病)、皮膚白血球破砕性血管炎(CLA)、およびMPAが長年にわたって混同されてきた他の疾患と明確に区別して分類を行いました。
MPAを他の血管炎と区別することが困難な理由の多くは、MPAが他の疾患と重複している部分が多いことにあります。 MPA、PAN、GPA、CLAなどの疾患は、様々な特徴を共有していますが、別々の分類を正当化するに足る十分な違いを持っています。
どのような人が顕微鏡的多発血管炎になるのか? 典型的な患者
MPAは、あらゆる民族、あらゆる年齢層の人が罹患する可能性があります。 米国では、典型的なMPA患者は、中年の白人男性または女性ですが、これには多くの例外があります。
顕微鏡的多発血管炎の典型的な症状
MPAには多くの徴候や症状が関連しています。 この病気は、腎臓、神経系(特に脳や脊髄ではなく末梢神経)、皮膚、肺など、体の多くの器官に影響を与えます(ただし、これらに限定されません)。
MPAの最も一般的な5つの臨床症状は以下の通りです。
- 腎臓の炎症(患者の約80%)
- 体重減少(> 70%)。
- 皮膚の病変(> 60%)。
- 神経の損傷(60%)。
- 発熱(55%)。
腎臓の炎症
糸球体腎炎として知られている腎臓の炎症は、尿中に血液やタンパク質を排出します。 このプロセスは、病気の経過の中で、ゆっくりと、または非常に急速に起こります。
以下の画像は、腎臓に炎症がある患者さんの尿検査結果です。 MPAが活性化すると、赤血球は炎症を起こした腎臓の尿細管内で「鋳型」と呼ばれる塊を形成します(白で括った部分)。
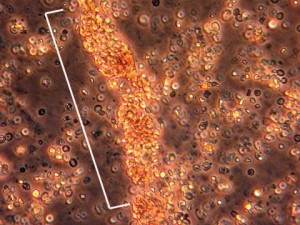
体質的症状
体重減少、発熱、疲労感、倦怠感などは、「体質的」症状と呼ばれる不定愁訴の一部である。
皮膚の病変
MPAの皮膚の病変は、皮膚を侵す他の血管炎と同様に、体の様々な部位に生じる可能性があります。 病変は、身体の「依存性」の部位、特に足、下肢、寝たきりの患者では臀部に好発する傾向がある。
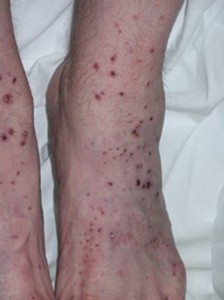
これらの部位の大きさは、直径数mmのものから、さらに大きな合体した病変まで様々です。 また、MPAの皮膚所見には、小さな肉色の隆起(丘疹)、小~中サイズの水疱(小水疱性病変)、あるいは、爪の下に小さな出血部位ができ、それが破片のように見える(下図)ことから、破片出血と呼ばれています。
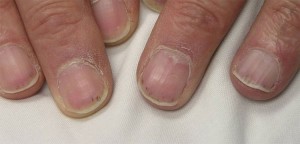
末梢神経系
末梢神経(すなわち、手足の神経。 末梢神経(手足、腕、脚の神経)の損傷は、神経に栄養を供給する血管の炎症に起因します。 この血管の炎症により、神経が栄養を奪われ、神経梗塞(組織死)を起こします。 血管炎に特徴的な多発性の神経病変を「多発性単神経炎」といいます。 この症状は、手首や足の脱落を伴うことが多く、手首で手を後ろに伸ばすことができなかったり、足関節で足を頭の方に上げることができなかったりします。
末梢神経の障害による神経学的症状としては、腕、手、脚、足のしびれなどがあります。
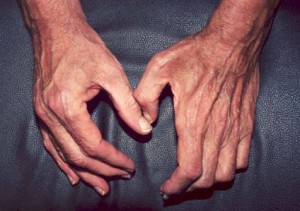
Pictured:
左の手(患者の右手)は正常で、指の間の部分の筋肉が正常に盛り上がっています。 一方、右手(患者の左手)は、親指と第1指の間のウェブスペースの筋肉が衰え、その部分がくぼんでお椀のようになっています。
肺
肺の病変は、MPAの劇的な症状であり、生命を脅かすこともあります。 肺疾患が肺胞出血(肺の微細な気嚢に接している小さな毛細血管からの出血)という形で現れると、患者の呼吸状態(つまり患者の命)を一気に脅かすことになります。 肺胞出血(下図)は、血を吐くことが多く、MPA患者の約12%に発生します。
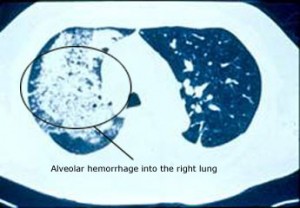
MPAのもう一つの一般的な肺症状は、非特異的な炎症性浸潤の発生で、肺のX線やCTスキャンで確認することができます。
目、筋肉、関節
MPAを語る上で重要な器官として、目、筋肉、関節が挙げられます。 結膜炎や上強膜炎による断続的な眼の炎症(「結膜炎」に似ている)は、病気の初期症状または病気の再燃の兆候である可能性があります。 また、MPAでは他の種類の炎症(ブドウ膜炎など)が見られることもあります。 筋肉痛や関節痛(臨床家の間では、それぞれ「筋肉痛」や「関節痛」と呼ばれています)は、MPAの一般的な症状であり、一般的に上述のような体質的な症状を伴います。 また、関節炎(腫れを伴う関節の炎症)が認められることもあります。
顕微鏡的多発血管炎に類似した血管炎
MPA、GPA、PANの共通点と相違点を以下の表に示します。
| MPA | GPA | PAN | ||
| BLOOD VESSEL SIZE | Small to Medium | Medium | ||
| BLOOD VESSEL TYPE | Arterioles to venules | 動脈から静脈へ。 そして時には動脈と静脈 | 動脈から静脈へ。 | |
| GRANULOMATOUS INFLAMMATION | NO | YES | NO | |
| LUNG SYMPTOMS | YES1 | YES1 | NO | |
| GLOMERULONEPHRITIS | YES | YES | NO | |
| RENAL HYPERTENSION | NO | YES | NO | YES |
| MONONEURITIS MULTIPLEX | COMMON | OCCASIONAL | COMMON | |
| SKIN LESIONS | YES2 | YES2 | YES2 | |
| GI SYMPTOMS | NO | YES3 | ||
| EYE SYMPTOMS | YES4 | YES4 | NO | |
| ANCA-。POSITIVITY | 75% | 65-td90% | NO | |
| CONSTITUTIONALSYMPTOMS | YES5 | YES5 | YES5 | |
| YES | NECROTIZING TISSUE | YES | YES | |
| MICROANEURYSMS | RARELY | RARELY | TYPICAL |
1 MPAでは肺毛細血管炎、WGでは結節や空洞性病変が見られます
2MPAでは上記のような小血管の皮膚病変が見られます。
3食後の胃痛
4MPAの眼合併症はGPAのそれよりも一般的に軽い。
壊死性強膜炎などの重篤な眼障害が起こることもあります
5体質的な症状としては、体重減少、発熱、関節痛、筋肉痛、倦怠感などがあります。
顕微鏡的多発血管炎の原因は何か
MPAの原因は分かっていません。 しかし、いくつかのタイプの血管炎については十分にわかっているので、MPAがどのように体に影響を与えるかを一般的に説明することができます。 MPAは明らかに免疫系を介した疾患です。しかし、免疫系の機能障害(亢進)につながる正確な事象はまだ明らかになっていません。
MPAは、白血球の特定の成分に対する抗体である抗好中球細胞質抗体(ANCA)と関連することが多いため、この疾患はしばしば「ANCA関連血管炎」(AAV)と呼ばれています。 1982年に発見されたANCAは、白血球の仲間である好中球やマクロファージに存在する体内の特定の(そして自然に存在する)酵素に対して作用します。 ANCAが標的タンパク質と相互作用した結果、疾患部位でのWBCの破壊が進み、血管壁内で白血球の酵素が放出され、血管に損傷を与える。
顕微鏡的多発血管炎の診断方法
MPAが疑われる場合には、血液を採取してANCAの値を検出します。 また、通常、赤血球沈降速度(ESR)とC反応性タンパク質(CRP)の測定も行います。 これらの検査は、様々な種類の炎症で上昇し、MPAや特定の疾患に特異的なものではありません。 ESRとCRPは、「急性期反応」として知られており、活動性疾患の存在を示す感度の高い指標となります。
腎臓病の発症や進行に注意するために、初診時(およびフォローアップ時)に注意深く分析した尿を採取する必要があります。
肺病変の有無を確認するために、胸部CTスキャンを行うこともあります。
MPAの診断には、組織生検が必要な場合があり、その時に病変があると思われる臓器から採取されます。 生検を行う部位を特定するために、あるいは多発性単孔球症と一致する所見を検出するために、筋電図/神経伝導(EMG/NCV)検査を行う必要がある場合もあります(上記の古典的症状の項を参照)。
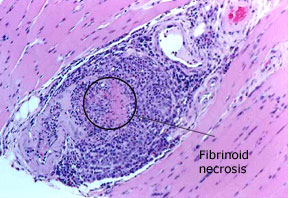
写真:顕微鏡的多発血管炎を発症した69歳の男性に行われた腓腹筋の生検。
顕微鏡的多発血管炎の治療と経過
ステロイド(通常はプレドニゾン)とシクロホスファミド(CYC)またはリツキシマブの併用が、一般的に最初に処方される薬の組み合わせとなります。 疾患をコントロールした後、通常は4~6ヶ月間の治療を経て、疾患を寛解状態に保つために維持療法が行われます。 これは患者さんによって異なります。 プレドニゾンは、約6ヵ月後に中止することができます
。