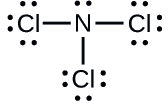Obliczanie ładunków formalnych
Ładunek formalny atomu w cząsteczce jest hipotetycznym ładunkiem, który atom miałby, gdybyśmy mogli redystrybuować elektrony w wiązaniach równomiernie między atomami. Innym sposobem powiedzenia tego jest to, że ładunek formalny powstaje, gdy weźmiemy liczbę elektronów walencyjnych atomu neutralnego, odejmiemy elektrony niewiążące, a następnie odejmiemy liczbę wiązań połączonych z tym atomem w strukturze Lewisa.
W ten sposób obliczamy ładunek formalny w następujący sposób:
Ładunek formalny = (elektrony walencyjne „wolnego” pierwiastka) – (elektrony niewspółdzielone) – (wiązania).
Obliczenia ładunku formalnego możemy dwukrotnie sprawdzić wyznaczając sumę ładunków formalnych dla całej struktury. Suma ładunków formalnych wszystkich atomów w cząsteczce musi być równa zero; suma ładunków formalnych w jonie powinna być równa ładunkowi jonu.
Musimy pamiętać, że ładunek formalny obliczony dla atomu nie jest rzeczywistym ładunkiem atomu w cząsteczce. Ładunek formalny jest tylko przydatną procedurą księgową; nie świadczy o obecności ładunków rzeczywistych.
Obliczanie ładunku formalnego ze struktur Lewisa
Przypisz ładunki formalne każdemu atomowi w jonie interhalogenowym.
Rozwiązanie
Dzielimy pary elektronów wiązania po równo dla wszystkich wiązań _Cl:
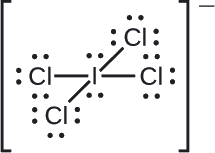
Przypisujemy samotne pary elektronów do ich atomów. Każdy atom Cl ma teraz przypisanych siedem elektronów, a atom I – osiem.
Odejmij tę liczbę od liczby elektronów walencyjnych dla atomu obojętnego:
- I: 7 – 8 = -1
- Cl: 7 – 7 = 0
Suma ładunków formalnych wszystkich atomów równa się -1, co jest identyczne z ładunkiem jonu (-1).
Ćwiczenie
Oblicz ładunek formalny dla każdego atomu w cząsteczce tlenku węgla:

Odpowiedź
C -1, O +1
Obliczanie ładunku formalnego ze struktur Lewisa
Przypisać ładunki formalne do każdego atomu w cząsteczce interhalogenu.
Rozwiązanie
Przypisać jeden z elektronów w każdym wiązaniu Br-Cl do atomu Br i jeden do atomu Cl w tym wiązaniu:
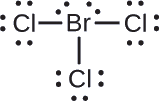
Przypisać samotne pary do ich atomów. Teraz każdy atom Cl ma siedem elektronów, a atom Br ma siedem elektronów.
Odejmij tę liczbę od liczby elektronów walencyjnych dla obojętnego atomu. To daje ładunek formalny:
- Br: 7 – 7 = 0
- Cl: 7 – 7 = 0
Wszystkie atomy w \(\ce{BrCl3}) mają ładunek formalny równy zero, a suma ładunków formalnych wynosi zero, tak jak to musi być w cząsteczce obojętnej.
Ćwiczenie nr 2
Określ ładunek formalny dla każdego atomu w cząsteczce ®NCl3}}.
Odpowiedź
N: 0; wszystkie trzy atomy Cl: 0