Bazotan magnezu reprezentowany przez wzór chemiczny Mg(NO3)2 lub MgN2O6, który nosi nazwę IUPAC dinitrate magnezu jest biały krystaliczny proszek higroskopijny, który jest rozpuszczalny w wodzie i alkoholu. Jest to sól magnezu i zawiera wiązania chemiczne, które są jonowe w naturze.

Zazotan magnezu
Identyfikacja azotanu magnezu |
|
| Numer CAS | 10377-60-3 |
| PubChem CID | 25212 |
| ChemSpider ID | 23415 |
| Numer WE | 233-826-7 |
Skład i synteza
Zazotan magnezu może być przygotowany przez połączenie siarczanu magnezu z azotanem wapnia.
MgSO4 + Ca(NO3)2 = Mg(NO3)2 + CaSO4
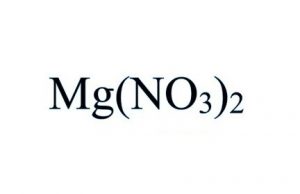
Wzór azotanu magnezu
Właściwości i cechy charakterystyczne azotanu magnezu azotan magnezu
Właściwości ogólne |
Właściwości | ||||
| Masa molowa/masa cząsteczkowa | 148.313 g/mol | ||||
Właściwości fizyczne |
|||||
| Kolor/widok | Białe kryształy | ||||
| Punkt topnienia/kropla zamarzania | 89°C, 192.2°F | ||||
| Punkt wrzenia | 330°C, 626°F | ||||
| Gęstość | 1.46 g cm-.3 | ||||
| Stan skupienia w temperaturze pokojowej (faza normalna) | Solid | ||||
Właściwości chemiczne Właściwości |
|||||
| Rozpuszczalność w wodzie | 42 g/100 ml (w 20oC) | ||||
| PH | 5-7 (kwaśny) | ||||
Właściwości atomowe |
|||||
| Struktura krystaliczna | Struktura krystaliczna struktura | Kubiczna | |||
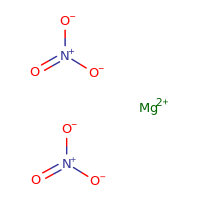
Sztuka azotanu magnezu
Prominentne reakcje Mg(NO3)2
Reakcja chemiczna pomiędzy azotanem magnezu i węglanem sodu prowadzi do powstania węglanu magnezu i azotanu sodu.
Mg(NO3)2 + Na2CO3 = MgCO3 + 2NaNO3
Bazotan magnezu rozkłada się w wodzie tworząc wodorotlenek magnezu, amoniak i tlen.
Mg(NO3)2 + 4H2O = Mg(OH)2 + 2NH3 + 4O2
Po podgrzaniu Mg(NO3)2 rozkłada się na tlenek magnezu, dwutlenek azotu i tlen .
2Mg(NO3)2 = 2MgO + 4NO2 + O2
Reaguje z wodorotlenkiem sodu dając wodorotlenek magnezu i azotan sodu .
Mg(NO3)2 + 2NaOH = Mg(OH)2 + 2NaNO3
Zastosowanie azotanu magnezu
- Jako bezpieczne źródło jonów azotanowych
- W produkcji nawozów azotowych
- W pirotechnice i produkcji stężonego kwasu azotowego .
- Pomaga w prillingu i powlekaniu przy produkcji azotanu amonu i jest składnikiem kosmetyków i szamponów
Czy jest niebezpieczny
Jako silny utleniacz, może powodować zagrożenie pożarowe. Może również powodować zagrożenie wybuchem w kontakcie z substancjami organicznymi. Należy unikać kontaktu z oczami, skórą i wdychania, gdyż powoduje podrażnienia, kaszel i duszności. Spożycie dużych ilości powoduje bóle brzucha, zawroty głowy, krwawą biegunkę, wymioty, drgawki, osłabienie i zapaść .
- Magnesium Nitrate – Pubchem.ncbi.nlm.nih.gov
- Magnesium Nitrate – Chemspider.com
- Magnesium Nitrate – Americanelements.com
- Magnesium Nitrate – Sciencemadness.org
- Magnesium Nitrate Hexahydrate – Sigmaaldrich.com
- Magnesium Nitrate – Chemicalbook.com
- Pytanie: Azotan magnezu i węglan sodu Mg(NO_3)_2 + Na_2 – Chegg.com
- Jak wyznacza się równanie równowagi azotanu magnezu z wodą? – Quora.com
- Rozkład termiczny azotanu magnezu – Chemiday.com
- Pytanie: Wodorotlenek sodu reaguje z azotanem magnezu tworząc wodorotlenek magnezu – Chegg.com