Układ okresowy to tabelaryczny układ pierwiastków chemicznych, uporządkowanych według liczby atomowej, konfiguracji elektronicznych i powtarzających się właściwości chemicznych. Kolejność ta pokazuje tendencje okresowe, takie jak elementy o podobnym zachowaniu w tej samej kolumnie. Ogólnie rzecz biorąc, w obrębie danego rzędu (okresu) pierwiastki są metalami po lewej stronie, a niemetalami po prawej.
Układ okresowy jest jednym z najbardziej emblematycznych symboli nauki, podsumowuje on znaczną część wiedzy z zakresu chemii. W każdej ze swoich wersji jest obecny w salach lekcyjnych i laboratoriach na całym świecie. Żadna inna dyscyplina nie ma podobnego dokumentu.
Układ okresowy, opracowany w drugiej połowie XIX wieku, stanowił systematyczny układ pierwiastków w grupy naturalne. Zakres tego układu pozwalał z dużą pewnością przewidzieć własności niektórych nieznanych pierwiastków i prawdopodobnych związków, jakie one tworzyły. Późniejsze osiągnięcia dostarczyły podstaw teoretycznych dla dzisiejszego Układu Okresowego. Duża liczba znanych pierwiastków i syntezowanych substancji stworzyła pilną potrzebę ich sklasyfikowania.
Odrobina historii o układzie okresowym
Na początku 1812 r. niemiecki chemik John W. Döbereiner podjął próbę pierwszego przybliżenia, porządkując odkryte pierwiastki w grupy po trzy. Klasyfikacja ta polegała na grupowaniu ich w porządku rosnącym według ich masy atomowej.
W 1860 roku Francuz Alexandre Béguyer (francuski geolog) zweryfikował pewną okresowość w pierwiastkach, porównując ich rozmiary i właściwości fizyczne. W swoich badaniach zweryfikował logiczny ciąg pomiędzy wielkościami i właściwościami obserwowanymi w atomach a ich odpowiednimi rozmiarami i obfitością.
W 1864 roku Julius Lothar Meyer opublikował pierwszą wersję układu okresowego, a później rosyjski chemik Dmitrij Iwanowicz Mendelejew ogłosił i opublikował Prawo Okresowe i Układ Okresowy Pierwiastków Chemicznych.

Dymitr Iwanowicz Mendelejew
Mendelejew miał genialną zdolność przewidywania; Nie tylko sformułował prawo okresowości chemicznej, ale także uporządkował znalezione pierwiastki i pozostawił miejsce dla tych, które nie zostały jeszcze odkryte, przewidując nawet ich właściwości fizyczne i chemiczne.
Układ okresowy dzisiaj
Zachowanie atomów jest zdeterminowane przez ich konfigurację elektroniczną, z rozmieszczeniem elektronów na najbardziej zewnętrznym poziomie określającym ich reaktywność i charakter chemiczny. Z tego powodu pierwiastki, które posiadają podobny rozkład elektronów, będą wykazywać podobne właściwości chemiczne.
Właściwości atomów powtarzają się okresowo, jeśli pierwiastki chemiczne są uporządkowane zgodnie z ich rosnącą liczbą atomową (Z).
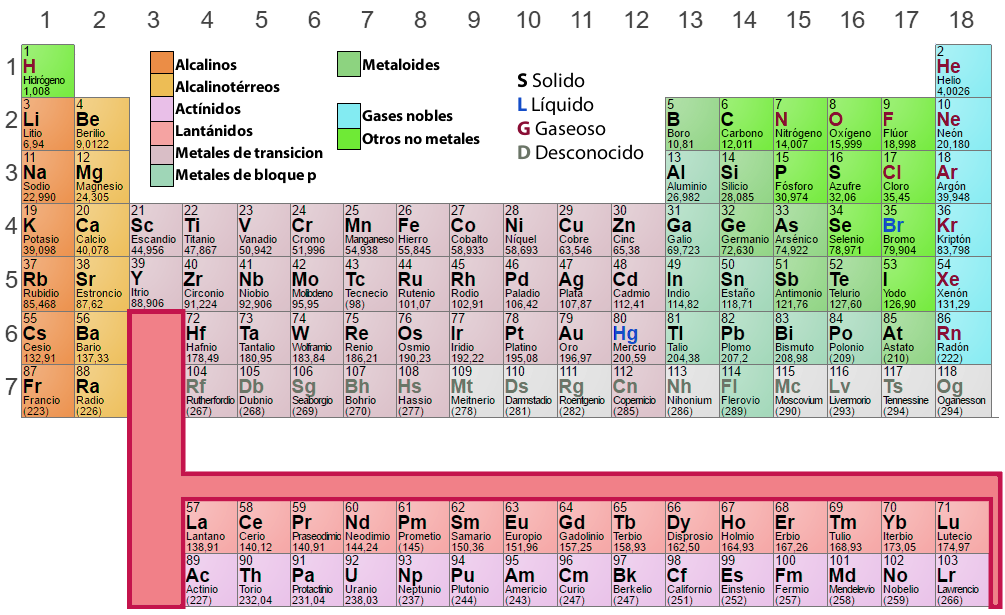
Analiza układu okresowego
W układzie okresowym pierwiastki, które mają podobny wzór konfiguracji elektronowej w powłoce zewnętrznej, są ułożone w tych samych kolumnach (Grupy lub Rodziny). Pierwiastki, które mają identyczne poziomy energetyczne, są ułożone w tych samych rzędach (okresach).
Grupy lub rodziny
Jest to pionowe uporządkowanie pierwiastków w układzie okresowym, według podobnych właściwości chemicznych. Tradycyjna numeracja osiemnastu kolumn to I A, II A, III A, IV A, itd, jak widać na powyższym układzie okresowym. Obecnie IUPAC (Międzynarodowa Unia Chemii Czystej i Stosowanej) zaleca kolejną numerację, czyli: 1, 2, 3, 4, 5, itd. Ważne jest, aby wziąć pod uwagę, co następuje:
- Wodór (H), chociaż pojawia się w grupie IA (1), nie jest metalem alkalicznym. Przeciwnie, wodór jest tak różny od innych pierwiastków chemicznych, że niektóre klasyfikacje wolą umieścić go poza tabelą.
- Grupy A są najważniejsze w tabeli, ich elementy są nazywane reprezentatywnymi.
- Pierwiastki w grupach III B, IV B, V B, VI B, VII B, VIII B, I B i II B stanowią tzw. pierwiastki przejściowe. Zauważ, że grupa VIII B jest grupą potrójną.
- Innym ważnym podziałem, jakiego możemy dokonać w układzie okresowym jest ten, w którym dzielimy
elementy na metale, niemetale i gazy szlachetne.
Pierwiastki w tej samej grupie posiadają podobne właściwości chemiczne i charakteryzują się posiadaniem równej liczby elektronów na ostatnim poziomie energetycznym. Każdy element grupy jest umieszczony w różnych okresach i do ich oznaczenia jest zapisywane za pomocą cyfr rzymskich (I, II, III, IV, itd.) liczbę elektronów w ostatnim poziomie, a następnie litery (A lub B), które identyfikują jego charakter i rodzaje orbitali, które przedstawia.
Okresy
Siedem poziomych linii lub rzędów, które pojawiają się w układzie okresowym nazywamy okresami, ważne jest, aby zauważyć, że:
- W szóstym okresie trzecia siatka obejmuje 15 pierwiastków (od lantanu do lutetu), które dla wygody zaznaczono w wierszu poniżej tabeli; począwszy od lantanu, pierwiastki te tworzą tzw. szereg lantanowców.
- Analogicznie, w siódmym okresie, trzecia siatka obejmuje również 15 pierwiastków chemicznych (actinium do laurentium), które są wskazane na drugiej linii poniżej tabeli. Począwszy od aktynu, tworzą one serię aktynowców.
- Należy zauważyć, że wszystkie elementy po uranu (U-92) nie istnieją w przyrodzie, muszą być syntetyzowane sztucznie. Są one nazywane pierwiastkami transuranowymi. Oprócz tych elementów, technet (Tc-43), promethium (Pm-61) i astatine (As-85) są również sztucznie syntetyzowane.
Pierwiastki tego samego okresu mają taką samą liczbę poziomów energetycznych z elektronami. Okresy są numerowane z uwzględnieniem wartości skrajnego poziomu energetycznego. Każdy okres zaczyna się od metalu alkalicznego, a kończy na gazie szlachetnym, z wyjątkiem pierwszego poziomu, gdzie znajduje się wodór.
Pierwiastki w układzie okresowym
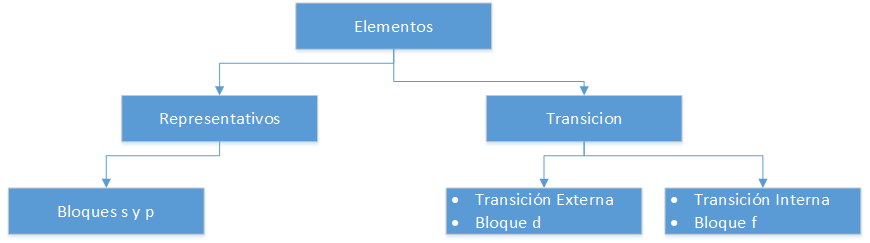
Pierwiastki reprezentatywne
Odpowiadają one grupom A układu okresowego. Nie spełniają one zasady oktetu, tzn. ich ostatni poziom energetyczny ma mniej niż 8 elektronów. Tak więc na przykład, atomy reprezentatywnych pierwiastków należących do grupy III A, takich jak aluminium (Al), mają 3 elektrony walencyjne w ostatniej powłoce, czyli mają niepełne orbitale p (p1 do p6).
Pierwiastki z grup IA do VA, mają tendencję do oddawania elektronów, aby osiągnąć najbliższą konfigurację gazu szlachetnego (ns2 np6). Natomiast pierwiastki z grup VI A i VII A, wychwytują elektrony, aby osiągnąć najbliższą konfigurację gazu szlachetnego.
| Grupa | Nazwa | Konfiguracja elektroniczna |
|---|---|---|
| IA | Alkaliczne | ns1 |
| IIA | A. | ns2np2 |
| VA | Nitrogenna | ns2np3 |
| VIA | Kalcynogenna | ns2np4 |
| VIA | Kalcynogenna | ns2np4 |
| VIA | Kalcynogenna | ns2np4 |
| VIIA | Halogeny | ns2np5 |
| 0 | Gazy szlachetne | ns2np6 |
Pierwiastki przejściowe
Umieszczone są one w grupach B układu okresowego. Pierwiastki należące do tej klasyfikacji posiadają orbitale d (od d1 do d10) na ostatnim poziomie energetycznym.
Pierwiastki przejściowe wewnętrzne
Znajdują się one w dolnej części układu okresowego, nazywane są również pierwiastkami ziem rzadkich. Ich główną cechą jest to, że mają orbitale f (od f1 do f14) na ostatnim poziomie energetycznym.
Natura pierwiastków
Gazy szlachetne
- Kolumna 18 w układzie okresowym.
- Grupa VIII lub 0.
- Charakteryzują się tym, że wszystkie ich poziomy elektronowe są kompletne.
- Konfiguracja elektronowa typu ns2p6, ns2 (hel).
- W normalnych warunkach są chemicznie obojętne (bardzo niereaktywne).
Pierwiastki metaliczne
- Prawie wszystkie są stałe (w temperaturze pokojowej), z wyjątkiem rtęci, cezu i rubidu.
- są bardzo dobrymi przewodnikami prądu elektrycznego.
- łatwo tracą elektrony, stając się stabilnymi kationami.
- mają metaliczny połysk i są bardzo dobrymi przewodnikami ciepła.
- Są ciągliwe, co oznacza, że pod wpływem działania siły mogą być odkształcane bez pękania.
- Są plastyczne, tzn. ich zdolność do odkształcania pozwala na wykorzystanie ich do produkcji arkuszy.
Pierwiastki niemetaliczne
.