Glikogenoliza, czyli rozkład glikogenu, uwalnia glukozę, gdy jest potrzebna.
W wątrobie glikogen stanowi rezerwę glukozy dla utrzymania prawidłowego poziomu glukozy we krwi, a jego rozpad następuje przede wszystkim:
- w stanie postnym, np. podczas postu nocnego;
- między posiłkami;
- podczas aktywności fizycznej o wysokiej intensywności.
W hepatocytach, glikogenoliza jest stymulowana przez glukagon i adrenalinę, hamowana przez insulinę i podlega negatywnej regulacji allosterycznej również przez glukozę (patrz poniżej).
W mięśniach, glikogen jest źródłem energii dla aktywności mięśniowej; dlatego rozpad glikogenu następuje podczas skurczu i tylko w mięśniach zaangażowanych w aktywność. komórkach mięśniowych glikogenoliza jest stymulowana przez adrenalinę i regulowana przez pozytywne i negatywne efektory allosteryczne, AMP i jon wapnia (Ca2+) oraz ATP i glukozo-6-fosforan, odpowiednio (patrz poniżej).
SEKCJA
- Etapy glikogenolizy
- Metaboliczny los glukozo-1-fosforanu w mięśniach i wątrobie
- Kowalencyjna regulacja glikogenolizy w mięśniach i wątrobie
- β-Receptory adrenergiczne
- Stymulujące białka G
- Cyklaza adenylowa
- Kinaza białkowa A
- Kinaza fosforylowa
- Allosteryczna regulacja glikogenolizy w mięśniach i wątrobie
- Kinaza fosforylowa mięśniowa
- Kinaza fosforylowa wątrobowa
- Kinaza fosforylowa kinaza fosforylazy mięśniowej
- Mięśniowa fosforylaza glikogenu
- Allosteryczna regulacja PP1
- Wątrobowa fosforylaza glikogenu
Etapy glikogenolizy
Glikogenoliza rozpoczyna się działaniem fosforylazy glikogenu (EC 2.4.1.1), homodimeru, który do swojej aktywności wymaga obecności pirydoksalu-5-fosforanu, pochodnej pirydoksyny lub witaminy B6. Enzym katalizuje fosforylityczne rozszczepienie wiązania α-(1,4) glikozydowego, uwalniając cząsteczki glukozy po kolei z nieredukujących końców, czyli końców z wolną grupą 4′-OH, gałęzi zewnętrznych. W wyniku tej reakcji, która nie zużywa ATP, lecz ortofosforan, powstaje 1-fosforan glukozy.
Glikogen(n reszt glukozowych) + Pi → 1-fosforan glukozy + Glikogen(n-1 reszt glukozowych)
Uwaga: w jelicie cienkim α-amylaza trzustkowa (EC 3.2.1.1) katalizuje hydrolityczne rozszczepienie wiązań α-(1,4) glikozydowych skrobi, dając cząsteczki glukozy.
In vivo, fosforylaza glikogenu katalizuje nieodwracalną fosfolizę, reakcję szczególnie korzystną dla mięśni szkieletowych i serca (patrz poniżej). Nieodwracalność reakcji jest zapewniona przez stosunek /, który zwykle jest większy niż 100. Z drugiej strony, reakcja jest łatwo odwracalna in vitro.
Fosforylaza glikogenu działa powtarzalnie na nieredukujących końcach gałęzi, zatrzymując się po osiągnięciu jednostki glukozy, która znajduje się 4 reszty od punktu rozgałęzienia: jest to zewnętrzna granica granicy dekstryny. W tym momencie, dwie aktywności enzymatyczne, obecne na tym samym łańcuchu polipeptydowym, kończą rozkład glikogenu: α-(1,4)-glukan-6-glikozylotransferaza (EC 2.4.1.24) i amylo-α-(1,6)-glukozydaza lub enzym rozszczepiający (EC 3.2.1.33). Pierwsza aktywność enzymatyczna przenosi trzy z czterech pozostałych jednostek glukozy z gałęzi na nieredukujący koniec innej gałęzi, pozostawiając w pierwszym łańcuchu tylko jedną jednostkę glukozy, która jest przyłączona do łańcucha wiązaniem α-(1,6)-glikozydowym. Druga aktywność enzymatyczna hydrolizuje to wiązanie α-(1,6)-glikozydowe, uwalniając glukozę i nierozgałęziony łańcuch jednostek α-(1,4)-połączonych glukozą.
Bez rozgałęzienia, fosforylaza glikogenu może kontynuować usuwanie jednostek glukozy, aż do osiągnięcia następnej granicy dekstryny.
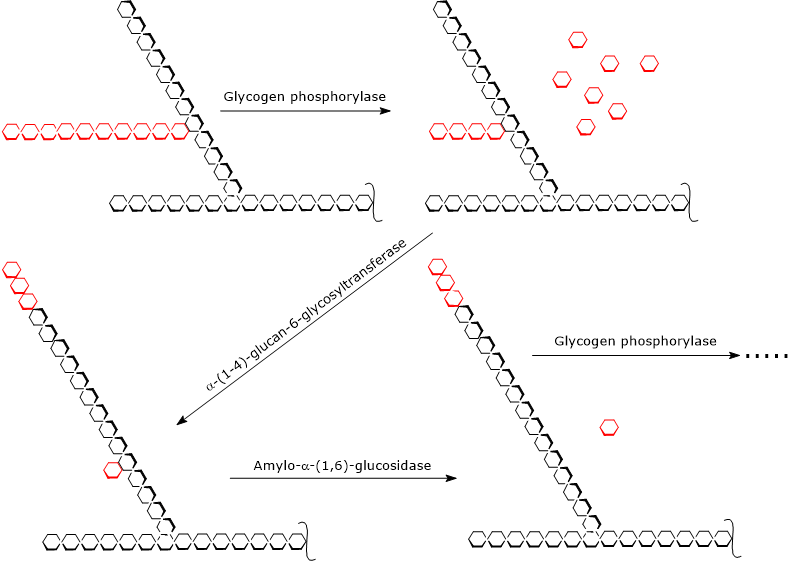
Produktami reakcji katalizowanych przez trzy aktywności enzymatyczne są:
- glukozo-1-fosforan (około 90% uwolnionych cząsteczek glukozy);
- niewielka ilość wolnej glukozy, pozostałe 10% ;
- mniejsza i mniej rozgałęziona cząsteczka glikogenu.
Metaboliczne losy glukozo-1-fosforanu w mięśniach i wątrobie
Glukozo-1-fosforan jest cząsteczką naładowaną, dlatego jest uwięziony wewnątrz komórki.est on przekształcany do glukozo-6-fosforanu w reakcji katalizowanej przez fosfoglukomutazę (EC 5.4.2.2), ten sam enzym, który uczestniczy również w syntezie glikogenu, przekształcając glukozo-6-fosforan w glukozo-1-fosforan. Enzym ten katalizuje reakcję odwracalną: kierunek zależy od względnego stężenia obu cząsteczek, a w tym przypadku przesuwa grupę fosforanową z C1 do C6.
Glukoza 1-fosforan ⇄ Glukoza 6-fosforan
W mięśniach, a także w większości innych narządów i tkanek, glukoza z glikogenolizy wchodzi do glikolizy jako glukoza 6-fosforan, omijając etap aktywacji katalizowany przez heksokinazę. Dlatego fosforylaza glikogenu, uwalniając już „aktywowaną” cząsteczkę glukozy, oszczędza ATP. Cząsteczka ATP jest potrzebna do syntezy innego pośredniego związku glikolitycznego, fruktozo-1,6-bisfosforanu.
W ten sposób część energii aktywacji wymaganej do syntezy glikogenu zostaje zachowana: wydajność netto ATP na cząsteczkę glukozy w wyniku glikolizy do mleczanu wynosi 3, a nie 2, co stanowi korzyść dla pracującego mięśnia. Równanie ogólne to:
Glikogen(n reszt glukozy) + 3 ADP + 3 Pi → Glikogen(n-1 reszt glukozy) + 2 Mleczan + 3 ATP
W wątrobie, glukozo-6-fosforan z glikogenu jest deposforylowany przez glukozo-6-fosfatazę (EC 3.1.3.9), a następnie uwalniany do krwiobiegu. Są to etapy usuwania jednostek glukozy, w postaci fosforylowanej glukozy, przez glikogenolizę wątrobową:
Glikogen(n reszt glukozowych) + Pi → glukozo-1-fosforan + Glikogen(n-1 reszt glukozowych)
glukoza-.1- fosforan → glukozo-6-fosforan
glukozo-6-fosforan + H2O → glukoza + Pi
Generalne równanie to:
Glikogen(n reszt glukozowych) + H2O → Glikogen(n-1 reszt glukozowych) +Glukoza
Kowalencyjna regulacja glikogenolizy w mięśniach i wątrobie
Rozkład glikogenu znajduje się pod precyzyjną kontrolą poprzez kowalencyjne i/lub allosteryczne modyfikacje niektórych kluczowych białek, takich jak kinaza fosforylazy (EC 2.7.11.19), fosforylazy glikogenu i fosfatazy białkowej 1.
- adrenalina (znana również jako epinefryna), produkowana przez nadnercza, która działa na przykład na mięśnie, wątrobę i komórki tłuszczowe;
- glukagon, produkowany przez komórki alfa trzustki, który działa na hepatocyty i adipocyty.
Hormony te, wiążąc się ze swoimi receptorami błonowymi, uruchamiają identyczną kaskadę zdarzeń wewnątrzkomórkowych, które wzmacniają o kilka rzędów wielkości ich sygnał, stymulując glikogenolizę i hamując syntezę glikogenu.
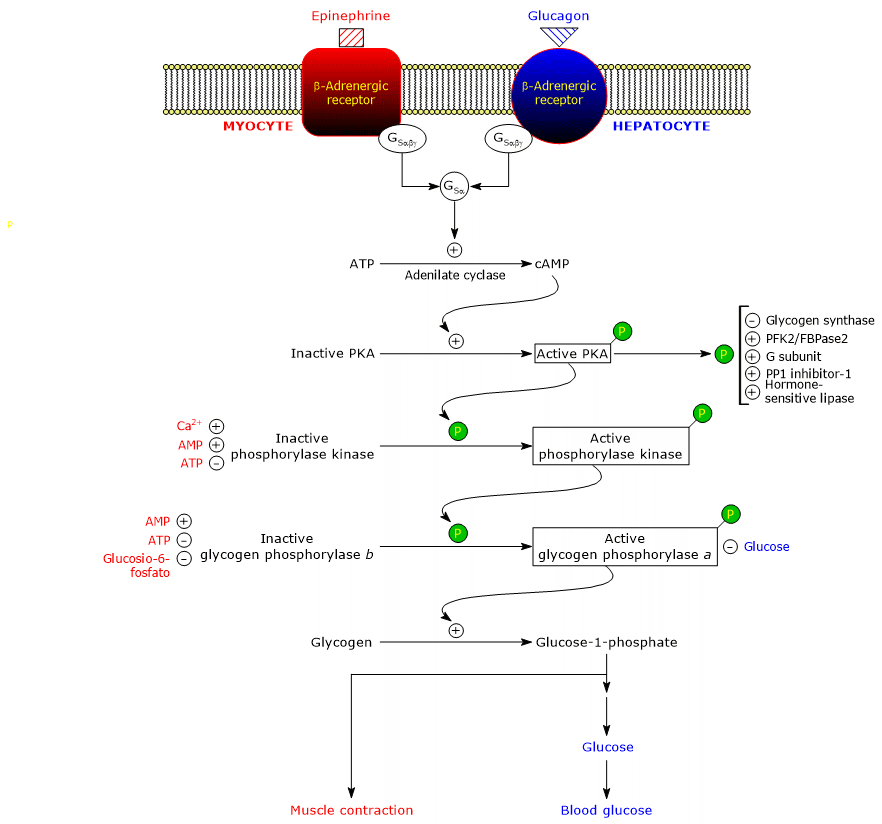 igcaption wątrobie
igcaption wątrobieNależy zauważyć, że nawet acetylocholina, poprzez wiązanie się z receptorem znajdującym się na złączu nerwowo-mięśniowym, wyzwala tę samą kaskadę aktywacji adrenaliny i glukagonu.to białka biorące udział w tej kaskadzie.
Receptory beta-adrenergiczne
Receptory dla adrenaliny i glukagonu są integralnymi białkami błonowymi, z siedmioma transmembranowymi α-helikami.
Termin „adrenergiczny” pochodzi od adrenaliny. Istnieją cztery podtypy receptorów adrenergicznych: α1, α2, β1 i β2. W dalszej części rozważań uwzględnione zostaną tylko receptory β1 i β2, określane jako β, które działają w ten sam sposób.
Receptory β-adrenergiczne powodują zmiany w metabolizmie energetycznym, takie jak:
- zwiększenie rozpadu glikogenu w komórkach mięśni i wątroby;
- zwiększenie rozpadu trójglicerydów (lipolizy) w tkance tłuszczowej.
Stymulujące białka G
Wiązanie hormonu z receptorem powoduje zmianę konformacyjną w cytozolowej części receptora, a to modyfikuje interakcję z drugim białkiem w kaskadzie: stymulującym białkiem wiążącym nukleotyd guaninowy lub prościej stymulującym białkiem G (GS). Jest to heterotrimer składający się z trzech podjednostek: α (zawierającej miejsce wiązania nukleotydu), β i γ. W formie nieaktywnej, GSαβγ-GDP, heterotrimer ten jest sprzężony z receptorami β-adrenergicznymi.
Zmiany konformacyjne receptora pozwalają mu na katalizowanie zamiany GDP na GTP w podjednostce α kompleksu GSαβγ. Prowadzi to do rozpadu trimeru na nieaktywny dimer, βγ, i kompleks GSα-GTP, który przemieszcza się wzdłuż płaszczyzny wewnętrznej powierzchni błony plazmatycznej, do której jest zakotwiczony przez kowalencyjnie związaną grupę palmitoilową, aż do momentu dotarcia do cyklazy adenylowej (EC 4.6.1.1.1).
Uwaga: działanie GS przypomina działanie białek Ras, innej klasy białek G, które są zaangażowane w transdukcję sygnału insulinowego.
Cyklaza adenylowa
Jest to integralny enzym błonowy, którego miejsce aktywne znajduje się po cytozolowej stronie błony plazmatycznej. Interakcja pomiędzy GSα a cyklazą adenylową powoduje aktywację enzymu, który z kolei katalizuje syntezę cAMP z ATP. Prowadzi to do wzrostu wewnątrzkomórkowego stężenia cyklicznego nukleotydu.
Działanie stymulujące GSα jest samoograniczające, ponieważ jest on GPTazą, czyli hydrolizuje związany GTP do GDP, wyłączając się tym samym. W formie nieaktywnej GSα dysocjuje od cyklazy adenylowej i ponownie łączy się z dimerem Gβγ. Dlatego heterotrimer jest ponownie dostępny do interakcji z kompleksem hormon-receptor.
Kinaza białkowa A
CAMP wiąże i aktywuje kinazę białkową zależną od cAMP lub kinazę białkową A lub PKA (EC 2.7.11.11). Nieaktywna forma enzymu jest tetramerem składającym się z dwóch podjednostek katalitycznych i dwóch regulatorowych. Każda z dwóch podjednostek regulatorowych posiada domenę autoinhibicyjną, czyli region, który zajmuje miejsce wiązania substratu każdej z podjednostek katalitycznych. Wiązanie dwóch cząsteczek cAMP do dwóch miejsc na każdej podjednostce regulatorowej prowadzi do zmiany konformacyjnej, która powoduje ich odłączenie od tetrameru, uwalniając dwie podjednostki katalityczne jako aktywne enzymy. Aktywna forma PKA katalizuje fosforylację niektórych białek, aktywując je lub hamując, jak na przykład:
- syntaza glikogenu (EC 2.4.1.11), hamowana;
- wrażliwa na hormony lipaza (EC 3.1.1.79), aktywowana;
- fosfofruktokinaza 2/fruktozo-2,6-bisfosfataza (odpowiednio EC 2.7.1.105 i EC 3.1.3.46), aktywowane;
- inhibitor-1 i wiążąca glikogen (G) podjednostka fosfatazy białkowej 1, aktywowane;
- kinaza fosforylowa, aktywowana.
cAMP ma bardzo krótki okres półtrwania: jest hydrolizowany do AMP, który nie ma aktywności drugiego posłańca, w reakcji katalizowanej przez fosfodiesterazę cyklicznych nukleotydów (EC 3.1.4.53). Kofeina i teofilina, dwie metyloksantyny zawarte odpowiednio w kawie i herbacie, hamują fosfodiesterazę, zwiększając w ten sposób okres półtrwania cAMP i wzmacniając jego działanie.
Kinaza fosforylowa
Kolejny etap kaskady jest katalizowany przez kinazę fosforylową.
Białko to składa się z czterech różnych podjednostek, z których każda występuje w czterech kopiach, tworząc kompleks określany jako (αβγδ)4. Podjednostki γ mają aktywność katalityczną, podczas gdy podjednostki α, β i δ są podjednostkami regulatorowymi. Podjednostki α i β są fosforylowane, gdy enzym przechodzi ze stanu nieaktywnego do aktywnego. Podjednostka δ, zwana również kalmoduliną, jest białkiem regulatorowym, które wiąże jony wapnia. Białko to jest obecne również w wielu innych enzymach. Działa jako sensor wapnia, czyli reaguje na zmiany wewnątrzkomórkowego stężenia wapnia, wpływając na aktywność białek, z którymi oddziałuje (patrz niżej). Kinaza fosforylowa występuje w dwóch izoformach, z których jedna ulega ekspresji w wątrobie, a druga w mięśniach szkieletowych i sercowych; różnią się one podjednostkami α i γ, które są kodowane przez różne geny.
Jednym z białek docelowych kinazy fosforylowej jest fosforylaza glikogenu. Enzym ten występuje jako izoenzymy w różnych tkankach i w dwóch stanach konformacyjnych w dynamicznej równowadze, określanych jako:
- T, dla napiętych lub naprężonych, które są mniej aktywne;
- R, dla zrelaksowanych, które są bardziej aktywne i zdolne do wiązania się z glikogenem, również w stanie fosforylowanym (patrz poniżej).
Kinaza fosforyluje pojedynczą resztę serynową (Ser-14) w każdej z dwóch podjednostek fosforylazy glikogenu, który jest prawie całkowicie w stanie T, przekształcając go w aktywnej formie, która, odwrotnie, jest prawie całkowicie w stanie R, a zatem wyzwalanie rozpadu glikogenu.
Fosforylowany enzym jest bardziej aktywną formą enzymu i jest określany jako fosforylaza glikogenu a; niefosforylowany enzym jest mniej aktywną formą enzymu i jest określany jako fosforylaza glikogenu b. Te dwie formy enzymatyczne mogą być hamowane lub aktywowane allosterycznie (patrz poniżej).
W mięśniach, glikogenoliza uwalnia glukozę 1-fosforan, który, jak wcześniej widziano, jest metabolizowany w samym mięśniu do produkcji energii do skurczu mięśni, a zatem do walki lub ucieczki odpowiedzi wywołanej przez adrenalinę.
W wątrobie, glukagon wyzwala uwalnianie glukozy do obiegu w celu przeciwdziałania hipoglikemii.
Po zakończeniu sytuacji stresowej fosfataza a, zwana również fosfatazą fosfoproteinową 1 lub PP1 (EC 3.1.3.17), katalizuje usuwanie grup fosforanowych z kinazy fosforylowej i fosforylazy glikogenowej a, przekształcając je w formy nieaktywne (enzym usuwa również grupy fosforanowe z syntazy glikogenowej). PP1 zbudowany jest z podjednostki katalitycznej, która ma niską wydajność katalityczną i niskie powinowactwo do glikogenu, oraz wspomnianej już podjednostki G, która należy do rodziny białek wiążących inne białka z glikogenem, zwanych białkami celującymi w glikogen (również kinaza fosforylowa, fosforylaza glikogenu i syntaza glikogenu są wiązane z cząsteczkami glikogenu przez białka z tej rodziny).
PP1 jest również hamowany przez inne białko zwane inhibitorem 1 PP1.
Jak już wcześniej zauważono, PKA fosforyluje:
- podjednostkę G, która w postaci ufosforylowanej nie jest w stanie związać się z podjednostką katalityczną PP1, w związku z czym PP1 nie spełnia swoich celów związanych z glikogenem (odwrotnie, fosforylacja podjednostki G indukowana stymulacją insuliną, dotykająca zróżnicowanych reszt aminokwasowych, umożliwia wiązanie się z podjednostką katalityczną PP1);
- inhibitor-1, który w formie ufosforylowanej jest zdolny do hamowania aktywności PP1.
Więc związanie hormonu z jego receptorem uruchamia reakcję kaskadową, która m.in. prowadzi do zahamowania aktywności PP1. Utrzymuje ona fosforylację zarówno fosforylazy glikogenu, jak i syntazy glikogenu: pierwszy enzym jest aktywowany, podczas gdy drugi jest hamowany. W ten sposób metabolizm węglowodanów jest zoptymalizowany.
Allosteryczna regulacja glikogenolizy w mięśniach i wątrobie
Glikogenoliza jest również regulowana przez pozytywne i negatywne efektory allosteryczne. Działają one na trzy enzymy: kinazę fosforylazy mięśniowej, wątrobową i mięśniową fosforylazę glikogenu oraz PP1.
Kinaza fosforylazy mięśniowej
Aktywność enzymu jest regulowana przez dwa pozytywne efektory allosteryczne, jon wapnia i AMP, oraz jeden negatywny efektor allosteryczny, ATP.zrost wewnątrzkomórkowego stężenia jonów wapnia jest sygnałem do skurczu mięśnia, a po uwolnieniu z siateczki sarkoplazmatycznej wapń wiąże się z podjednostką δ (kalmoduliną) enzymu, aktywując go.AMP gromadzi się w mięśniu podczas intensywnego skurczu, z powodu zużycia ATP, wiąże się z enzymem i aktywuje go. I odwrotnie, gdy stężenie ATP jest wysokie, czyli mięsień nie kurczy się, wiąże się on z miejscem allosterycznym dla AMP, unieczynniając kinazę.
Wątrobowa kinaza fosforylowa
Niektóre hormony mogą działać zarówno poprzez wyzwalanie kowalencyjnych modyfikacji białek docelowych, jak i poprzez powodowanie uwalniania jonów wapnia z retikulum endoplazmatycznego.
W wątrobie kinaza fosforylowa jest regulowana przez hormony powodujące uwalnianie jonów wapnia. Przykładami są wazopresyna, ale także adrenalina, gdy wiąże się ona z receptorami α1. W odniesieniu do adrenaliny, jej wiązanie z receptorami α1 aktywuje białko G, które stymuluje fosfolipazę C-β, która z kolei przekształca fosfatydyloinozytol-4,5-bisfosforan do 1,4,5-trifosforanu inozytolu (IP3) i diacyloglicerolu. Inozytol 1,4,5-trifosforan powoduje uwolnienie jonów wapnia z retikulum endoplazmatycznego. Jony wapnia, wiążąc się z podjednostką δ kinazy fosforylowej, prowadzą do jej aktywacji.
Mięśniowa fosforylaza glikogenu
Mięśniowa fosforylaza glikogenu b jest aktywowana w obecności wysokich stężeń AMP, który wiążąc się ze specyficznym miejscem wiązania nukleotydów, zmienia strukturę czwartorzędową enzymu, przesuwając równowagę allosteryczną w kierunku stanu aktywnego R formy b. I odwrotnie, ATP i glukozo-6-fosforan, które konkurują z AMP o to samo miejsce wiązania nukleotydów, działają jako negatywne efektory allosteryczne, przesuwając równowagę allosteryczną w kierunku nieaktywnego stanu T formy b.
Mięśniowa fosforylaza glikogenu a jest aktywna, niezależnie od poziomu AMP, ATP i glukozo-6-fosforanu.
W spoczynku mięśni prawie cała fosforylaza glikogenu jest w nieaktywnej formie b.
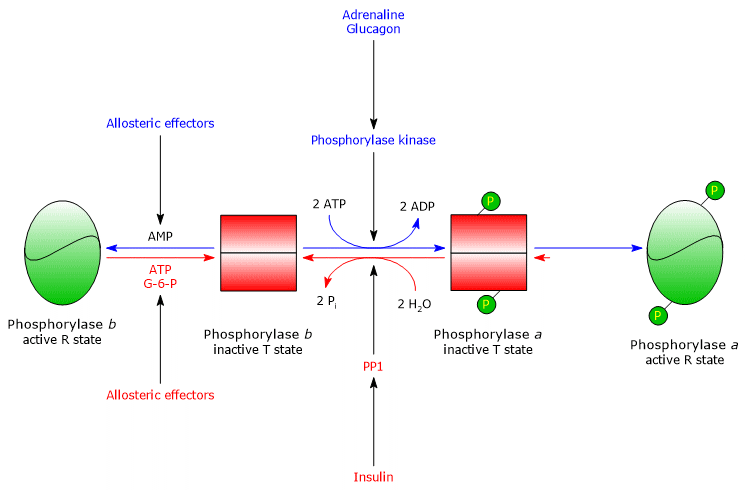
W rzeczywistości, kowalencyjna i allosteryczna regulacja enzymu zapewnia, że wewnątrzkomórkowe poziomy glukozy są precyzyjnie regulowane.
- Jeśli komórka o odpowiednim ładunku energetycznym otrzymuje sygnał hormonalny, który uruchamia kaskadę aktywacji, fosforylaza glikogenu b, hamowana przez ATP i glukozo-6-fosforan, pozostaje w stanie T, dopóki ładunek jest wysoki.
- Jeśli ładunek energetyczny komórki jest niski, fosforylaza glikogenu b, aktywowana przez AMP, rozpoczyna rozkład glikogenu, nawet przy braku bodźca hormonalnego, który indukuje jej konwersję do aktywnej formy a.
Allosteryczna regulacja PP1
PP1 jest allosterycznie aktywowana przez glukozo-6-fosforan, a więc wtedy, gdy ładunek energetyczny komórki jest niski.
Wątrobowa fosforylaza glikogenu
W wątrobie regulacja allosteryczna enzymu zachodzi poprzez różne mechanizmy.
- Pierwsza różnica dotyczy odpowiedzi na AMP: wątrobowa fosforylaza glikogenu b nie jest aktywowana przez AMP.
- Druga różnica dotyczy fosforylazy glikogenu a: enzym jest hamowany przez glukozę, która jest inhibitorem kompetycyjnym (monosacharyd przesuwa równowagę allosteryczną w kierunku nieaktywnego stanu T formy a).
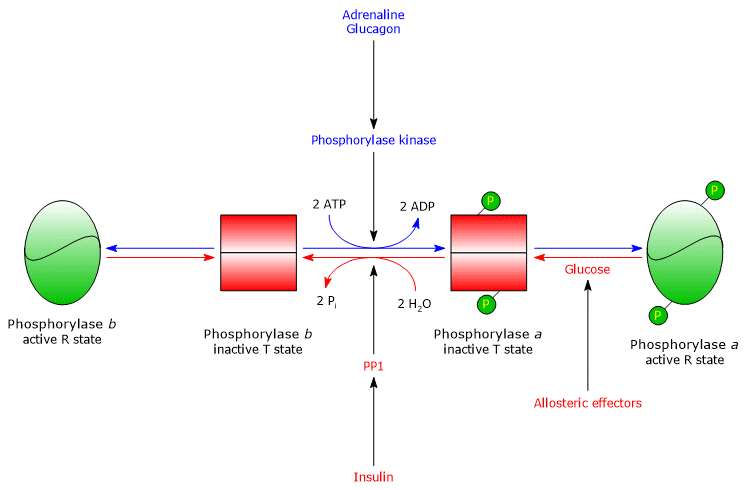
W wątrobie, Celem glikogenolizy jest dostarczenie glukozy do innych tkanek, gdy poziom glukozy we krwi jest niski. Kiedy poziom glukozy we krwi wraca do normy, jej stężenie w hepatocytach wzrasta i wiąże się ona z fosforylazą glikogenu a, wywołując zmianę konformacyjną, która odsłania ufosforylowane reszty serynowe dla aktywności PP1, co powoduje inaktywację enzymu poprzez depfosforylację. Dlatego miejsce allosteryczne dla glukozy wątrobowej fosforylazy glikogenu pozwala enzymowi działać jako czujnik glukozy we krwi, odpowiednio reagując na zmiany poziomu glukozy we krwi. Ostatecznie izoenzym wątrobowy odpowiada tylko na glukozę, a nie na AMP, czyli na komórkowy ładunek energetyczny, co jest godne uwagi, ponieważ to kwasy tłuszczowe, a nie glukoza, są podstawowym źródłem energii dla wątroby.
Berg J.M., Tymoczko J.L., and Stryer L. Biochemistry. 5 wydanie. W. H. Freeman and Company, 2002
Nelson D.L., M. M. Cox M.M. Lehninger. Principles of biochemistry. 4th Ed. W.H. Freeman and Company, 2004
Rawn J.D. Biochimica. Mc Graw-Hill, Neil Patterson Publishers, 1990
Roach P.J., Depaoli-Roach A.A., Hurley T.D., Tagliabracci V.S. Glycogen and its metabolism: some new developments and old themes. Biochem J 2012:441;763-87. doi:10.1042/BJ20111416
Rosenthal M.D., Glew R.H. Medical Biochemistry – Human Metabolism in Health and Disease. John Wiley J. & Sons, Inc, Publication, 2009