
Samica północnopacyficznej ośmiornicy olbrzymiej (Enteroctopus dofleini) żyje od trzech do czterech lat; Składa tysiące jaj w pojedynczej walce, a następnie umiera. Natomiast dojrzałe drzewo sekwoi przybrzeżnej (Sequoia sempervirens) żyje przez wiele setek lat i produkuje miliony nasion każdego roku (rys. 1). Jak ilustrują te dwa przykłady, organizmy różnią się drastycznie pod względem tego, jak się rozwijają, ile czasu zajmuje im wzrost, kiedy stają się dojrzałe, ile potomstwa o określonej wielkości wytwarzają i jak długo żyją. Razem, specyficzne dla danego wieku, rozmiaru lub etapu wzorce rozwoju, wzrostu, dojrzewania, reprodukcji, przetrwania i długości życia definiują cykl życia organizmu, jego historię życia.

Głównym celem teorii historii życia, gałęzi ekologii ewolucyjnej, jest wyjaśnienie niezwykłej różnorodności historii życia wśród gatunków. Ale jest jeszcze jeden, bardziej przekonujący powód, dla którego ewolucja historii życia jest ważna: adaptacja przez dobór naturalny opiera się na zmienności darwinowskiej kondycji wśród osobników, a ponieważ cechy historii życia determinują przeżycie i reprodukcję, są one głównymi składnikami kondycji. Badania nad ewolucją historii życia dotyczą więc zrozumienia adaptacji, najbardziej fundamentalnego zagadnienia w biologii ewolucyjnej.
Wprowadzamy tu podstawy teorii historii życia i przegląd tego, czego biolodzy dowiedzieli się o ewolucji historii życia. Bardziej szczegółowe informacje na ten temat można znaleźć w Stearns (1992), Roff (1992, 2002), Charlesworth (1994) oraz Flatt i Heyland (2011). Zobacz również artykuły Nature Education Knowledge autorstwa Sheffersona (2010), Younga (2010) oraz Fabiana i Flatta (2011).
Podstawy teorii historii życia
Teoria historii życia stara się wyjaśnić, w jaki sposób dobór naturalny i inne siły ewolucyjne kształtują organizmy, aby zoptymalizować ich przetrwanie i reprodukcję w obliczu wyzwań ekologicznych stawianych przez środowisko (Stearns 1992, Roff 1992, Stearns 2000), lub jak ostatnio ujął to David Reznick: „Teoria historii życia przewiduje, w jaki sposób dobór naturalny powinien kształtować sposób, w jaki organizmy przeznaczają swoje zasoby na tworzenie potomstwa” (Reznick 2010, s. 124). Teoria ta czyni to poprzez analizę ewolucji komponentów kondycji, tak zwanych cech historii życia, oraz tego, jak na siebie oddziałują: rozmiar w momencie narodzin; wzór wzrostu; wiek i rozmiar w momencie dojrzałości; liczba, rozmiar i płeć potomstwa; wysiłek reprodukcyjny specyficzny dla wieku, stadium lub rozmiaru; wskaźniki przeżycia specyficzne dla wieku, stadium lub rozmiaru; oraz długość życia.
Klasyczna teoria traktuje ewolucję historii życia jako problem optymalizacyjny: biorąc pod uwagę określone czynniki ekologiczne (np. drapieżniki, odżywianie), które wpływają na prawdopodobieństwo przeżycia i reprodukcji organizmu, oraz ograniczenia i kompromisy właściwe dla organizmu, jakie są optymalne wartości i kombinacje cech historii życia, które maksymalizują sukces reprodukcyjny? Aby znaleźć rozwiązanie tego problemu musimy zrozumieć jego „warunki brzegowe” (Stearns 2000): (1) jak zewnętrzne, środowiskowe czynniki wpływają na przeżycie i reprodukcję; oraz (2) jak wewnętrzne powiązania pomiędzy cechami historii życia (trade-off) i inne ograniczenia ograniczają to, czy i jak cechy historii życia mogą ewoluować. Kiedy te warunki zostaną zrozumiane i zdefiniowane, modele historii życia mogą być wykorzystane do odpowiedzi na pytania takie jak: Jak mały lub duży powinien rosnąć organizm? W jakim wieku i przy jakich rozmiarach powinien dojrzewać? Ile razy powinien się rozmnażać? Ile potomstwa powinien wyprodukować i jakiej wielkości powinno ono być? Jak długo powinien się rozmnażać i jak długo powinien żyć?
Problemy optymalizacji historii życia są zwykle modelowane przy użyciu równania Eulera-Lotki, które opisuje tempo wzrostu populacji (tj, fitness) klonalnego genotypu (lub substytucji alleli) w ciągłym czasie generacji jako funkcji jego wieku przy dojrzałości, wieku przy ostatnim rozmnażaniu, specyficznego dla wieku prawdopodobieństwa przeżycia i oczekiwanej specyficznej dla wieku liczby potomstwa (Stearns 1992, Roff, 1992, Brommer 2000):
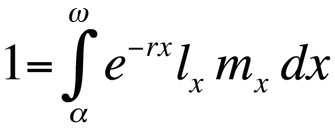
gdzie α jest wiekiem przy pierwszej reprodukcji, ω wiekiem przy ostatniej reprodukcji, lx prawdopodobieństwem przeżycia od urodzenia do klasy wieku x, mx oczekiwaną liczbą potomstwa w klasie wieku x, a r tempem wzrostu populacji lub parametrem maltuzjańskim. Równanie sumuje prawdopodobieństwa przeżycia i reprodukcji w ciągu całego życia osobników w populacji i może być rozwiązane dla r. Zauważmy, że w kontekście teorii historii życia r mierzy tempo wzrostu lub kondycję klonu lub, w organizmach rozmnażających się płciowo, tempo rozprzestrzeniania się allelu, który wpływa na historię życia. Tak więc, domyślnym założeniem jest, że modelowana populacja składa się z fenotypowo i genetycznie identycznych osobników. Jeśli populacja opisana równaniem Eulera-Lotka jest stacjonarna (nierosnąca), r wynosi zero i równanie przyjmuje postać
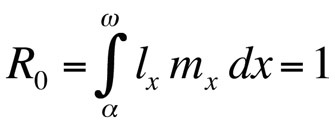
albo, jeśli czas generacji jest dyskretny,
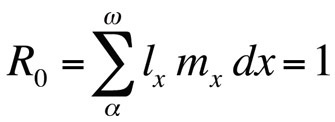
gdzie R0 jest oczekiwaną liczbą córek na samicę w ciągu życia (współczynnik reprodukcji netto). To równanie jest prostsze niż wersja dla czasu ciągłego i może być stosowane zawsze, gdy r wynosi zero lub jest bliskie zeru; dla stabilnych populacji, które nie zmieniają swojej wielkości, R0 jest odpowiednią miarą kondycji (Stearns 1992, Roff 1992, Brommer 2000). Używając tych ram, można zapytać, jaka konkretna kombinacja cech historii życia maksymalizuje kondycję lub jak bardzo wpływa na nią zmiana jednej z cech. To podejście zostało wykorzystane z dużym sukcesem do przewidywania ewolucji cech historii życia.
Zmienność genetyczna dla cech historii życia
Ewolucja cech historii życia przez dobór naturalny zależy od zmienności genetycznej, na którą dobór może oddziaływać, by wytworzyć adaptacje w odpowiedzi na środowisko. Wspomniane wyżej modele zakładają, że ewolucja historii życia nie jest ograniczona przez brak zmienności genetycznej. Co ciekawe jednak, odziedziczalność (h2 = VA/VP = addytywna wariancja genetyczna podzielona przez wariancję fenotypową), tj. część różnic fenotypowych między osobnikami w populacji, która jest wyjaśniona przez addytywne różnice genetyczne między nimi, jest zwykle mała dla cech historii życia. Ta niska odziedziczalność może być spowodowana niską ilością addytywnej wariancji genetycznej; mimo to w populacjach naturalnych i laboratoryjnych istnieje duża zmienność genetyczna dla cech historii życia. Zgodnie z poglądem, że komponenty kondycji są nośnikiem dużej ilości zmienności genetycznej, wiele eksperymentów sztucznej selekcji w laboratorium z powodzeniem doprowadziło do zmian ewolucyjnych cech historii życia w przewidywanym kierunku (Stearns 1992, Roff 1992, Houle 2001). Jednym z powodów tak dużej liczby VA cech historii życia może być fakt, że są to bardzo złożone, ilościowe, poligeniczne cechy, na które wpływa wiele loci (Houle 1992).
Jak jednak pogodzić fakt, że VA jest duże, a jednocześnie h2 jest małe? Prawdopodobnym powodem niskiej odziedziczalności cech historii życia jest to, że chociaż VA (licznik) jest duża, VP (mianownik) jest znacznie większa niż VA. Należy zauważyć, że wariancja fenotypowa VP składa się z VA, addytywnej wariancji genetycznej, plus reszta, VR, która sama składa się ze wszystkich nieaddytywnych genetycznych źródeł zmienności (tj. z powodu dominacji, epistazy itp.) oraz zmienności fenotypowej wywołanej przez środowisko (tj. plastyczności fenotypowej, interakcji genotypu ze środowiskiem; patrz poniżej). Tak więc cechy historii życia mają prawdopodobnie niską odziedziczalność, ponieważ są kształtowane przez wiele loci (co zawyża zarówno VA, jak i VP), a jednocześnie zawierają znaczne ilości resztkowej zmienności VR, na przykład zmienność wynikającą ze zmian w środowisku (co zawyża VP, ale nie VA) (Houle 1992, Houle 2001).
Co więcej, chociaż cechy historii życia podlegają silnej selekcji, która powinna wyczerpać wariancję genetyczną, kilka czynników może utrzymać wariancję genetyczną dla tych cech, w tym równowaga mutacji i selekcji, heterogeniczność środowiska i interakcje genotypu ze środowiskiem oraz ujemne korelacje genetyczne (Stearns 1992, Roff 1992, Houle 2001). Jednakże, pomimo typowo dużych ilości zmienności historii życia, ewolucja historii życia podlega również ograniczeniom.
Handel historią życia i inne ograniczenia
Przystosowanie byłoby oczywiście maksymalne, gdyby przeżycie i reprodukcja były maksymalne w każdym wieku, stadium lub rozmiarze organizmu. W zasadzie wtedy, podstawowy problem ewolucji historii życia jest trywialny: wszystkie cechy historii życia powinny zawsze ewoluować tak, by maksymalizować przeżycie i reprodukcję, a więc i kondycję (Houle 2001). To bardzo szybko doprowadziłoby do ewolucji „darwinowskich demonów” (Law 1979), które opanowałyby świat, tj. organizmów, które zaczynają się rozmnażać zaraz po urodzeniu, produkują nieskończoną liczbę potomstwa i żyją wiecznie. Takie organizmy nie istnieją jednak w realnym świecie: Zasoby są ograniczone, a cechy historii życia podlegają wewnętrznym kompromisom i innym rodzajom ograniczeń, więc dobór naturalny nie może maksymalizować cech historii życia – a więc i kondycji – poza pewnymi granicami. Takie ograniczenia nazywamy ograniczeniami ewolucyjnymi (Stearns 1992, Houle 2001); jak wspomniano wyżej, stanowią one wewnętrzny „warunek brzegowy”, który musimy zrozumieć, aby przewidzieć ewolucję historii życia.
Jednym z najważniejszych typów ograniczeń są kompromisy w historii życia (Stearns 1992, Roff 1992, Flatt i Heyland 2011). Kompromis istnieje wtedy, gdy wzrost jednej cechy historii życia (poprawiającej kondycję) jest połączony ze spadkiem innej cechy historii życia (obniżającej kondycję), tak że korzyść z poprawy kondycji poprzez wzrost cechy 1 jest zrównoważona kosztem poprawy kondycji poprzez spadek cechy 2 (Rysunek 2A). Na poziomie genetycznym takie kompromisy są powodowane przez allele o antagonistycznych efektach plejotropowych lub przez nierównowagę powiązań między loci.
Trade-offy są zwykle opisywane przez ujemne korelacje fenotypowe lub genetyczne między składnikami kondycji wśród osobników w populacji (Rysunek 2A). Jeśli związek ten jest genetyczny, przewiduje się, że ujemna korelacja genetyczna ogranicza (tj. spowalnia lub zapobiega) ewolucję cech, których dotyczy. Tak więc, genetyczny trade-off istnieje w populacji, gdy ewolucyjna zmiana cechy, która zwiększa kondycję, jest powiązana z ewolucyjną zmianą innej cechy, która obniża kondycję. Istnienie korelacji genetycznych może być ustalone poprzez projekty ilościowej hodowli genetycznej lub poprzez skorelowane reakcje fenotypowe na selekcję. Na przykład, bezpośrednia sztuczna selekcja na wydłużoną długość życia w genetycznie zmiennych populacjach laboratoryjnych muszki owocowej (Drosophila melanogaster) powoduje ewolucję zwiększonej długości życia osobników dorosłych (czasami w ciągu 10 lub mniej pokoleń), ale ten ewolucyjny wzrost długowieczności jest połączony ze zmniejszoną wczesną reprodukcją (np., Zwaan et al. 1995). Sugeruje to, że długość życia i wczesna reprodukcja są genetycznie negatywnie sprzężone, np. poprzez antagonistyczne allele plejotropowe (np. Flatt 2011, Fabian i Flatt 2011).
Na poziomie fizjologicznym, kompromisy są spowodowane konkurencyjną alokacją ograniczonych zasobów do jednej cechy historii życia w stosunku do drugiej w obrębie jednego osobnika, na przykład, gdy osobniki o wyższym wysiłku reprodukcyjnym mają krótszą długość życia lub odwrotnie (Rysunek 2B). Pomocnym sposobem myślenia o kompromisach w alokacji zasobów jest wyobrażenie sobie historii życia jako skończonego tortu, którego poszczególne plastry reprezentują sposób, w jaki organizm dzieli swoje zasoby pomiędzy wzrost, przechowywanie, utrzymanie, przetrwanie i reprodukcję (Reznick 2010; Rysunek 2C). Zasadniczy problem jest następujący: biorąc pod uwagę warunki ekologiczne i fakt, że zwiększenie jednego kawałka oznacza zmniejszenie innego, jaki jest najlepszy sposób podziału tortu? Zauważmy, że skoro kompromisy w alokacji zasobów mogą mieć podłoże genetyczne, a różne genotypy mogą różnić się pod względem aspektów alokacji zasobów, genetyczne i fizjologiczne spojrzenie na kompromisy niekoniecznie jest niekompatybilne. Jednakże, fizjologiczne kompromisy na poziomie indywidualnym nie zawsze przekładają się na genetyczne (ewolucyjne) kompromisy na poziomie populacji. Na przykład, gdy fizjologiczny (wewnątrz-indywidualny) trade-off jest genetycznie ustalony („hard-wired”) wśród wszystkich osobników w populacji, wszystkie osobniki będą wykazywać ten sam negatywny fizjologiczny związek między dwiema cechami historii życia, ale korelacja genetyczna między osobnikami będzie równa zeru (Stearns 1989, Stearns 1992).
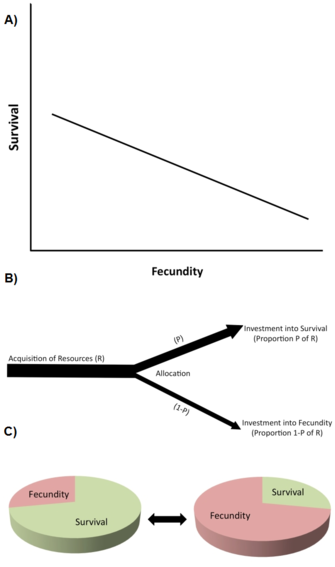
Książka Stearns (1992) wymienia 45 możliwych kompromisów wśród 10 głównych cech historii życia, a można przewidzieć istnienie wielu innych. Te kompromisy, którym poświęcono najwięcej uwagi, obejmują (1) bieżącą reprodukcję versus przeżycie; (2) bieżącą reprodukcję versus przyszłą reprodukcję; (3) bieżącą reprodukcję versus wzrost rodzicielski; (4) bieżącą reprodukcję versus stan rodzicielski; oraz (5) liczbę versus wielkość potomstwa.
Najlepsze dowody na genetycznie uwarunkowane kompromisy w historii życia pochodzą z eksperymentów sztucznej selekcji i eksperymentalnej ewolucji przeprowadzonych na Drosophila (patrz przeglądy w Stearns i Partridge 2001, Flatt i Schmidt 2009, Flatt 2011). Podsumowując, w wielu eksperymentach stwierdzono: ujemną korelację między wczesną płodnością a długością życia osobników dorosłych; dodatnią korelację między czasem rozwoju a wielkością ciała; dodatnią korelację między czasem rozwoju lub wielkością ciała a wczesną płodnością; oraz ujemną korelację między wczesną i późną płodnością.
Inne ograniczenia w historii życia, które uniemożliwiają doborowi naturalnemu osiągnięcie określonego optimum kondycyjnego, mogą dotyczyć czynników biofizycznych, biochemicznych i strukturalnych, właściwości rozwojowych organizmu, uwarunkowań filogenetycznych i historycznych lub po prostu braku zmienności genetycznej (Stearns 1992, Houle 2001).
Plastyczność fenotypowa w cechach historii życia
Zmienność genetyczna i ograniczenia nie są jedynymi czynnikami wpływającymi na ekspresję i ewolucję cech historii życia. Inną ważną kwestią jest to, że na zmienność historii życia często silnie wpływa środowisko (np. temperatura, odżywianie, drapieżniki), zjawisko zwane plastycznością fenotypową, czyli zdolność pojedynczego genotypu (lub klonu) do wytwarzania różnych fenotypów w różnych środowiskach (Stearns 1992, Roff 1997, Pigliucci 2001, DeWitt i Scheiner 2004). Plastyczność określonego genotypu może być opisana za pomocą funkcji matematycznej zwanej normą reakcji, tj. linii lub krzywej, która odnosi fenotypy wytwarzane przez ten genotyp do zmian w środowisku, w którym występuje (Rysunek 3A).
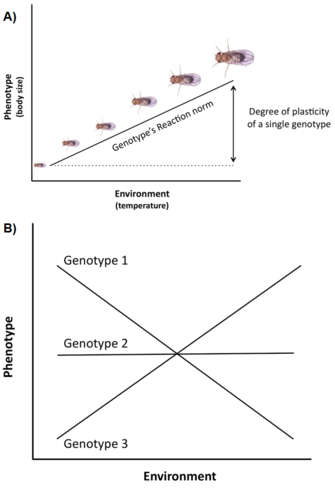
Ważność takiej plastyczności w ewolucji historii życia jest co najmniej potrójna (Stearns i Koella 1986, Stearns et al. 1991, Stearns 1992, Nylin i Gotthard 1998, DeWitt i Scheiner 2004, Flatt 2005): (1) ponieważ plastyczność moduluje fenotypową ekspresję zmienności genetycznej dla pojedynczych cech historii życia oraz korelacji genetycznych dla par cech, wpływa ona na genetyczną odpowiedź na selekcję w różnych środowiskach; (2) jeśli istnieje adaptacyjna zmienność wśród genotypów dla plastikowej odpowiedzi, selekcja może wytworzyć optymalną normę reakcji, która maksymalizuje kondycję w różnych środowiskach; oraz (3) plastyczność specyficznej cechy może homeostatycznie buforować organizm przed wywołanymi przez środowisko zmianami w innych cechach, tak aby wydajność organizmu, a tym samym kondycja, była optymalna.
Wiele cech historii życia (np, wiek dojrzewania, płodność) wykazuje wysoki stopień plastyczności, a w naturalnych populacjach często występuje znaczne zróżnicowanie genetyczne dla plastyczności, tj. genotypy mają różne normy reakcji, zjawisko to nazywane jest interakcją genotypu ze środowiskiem (GxE) (Rysunek 3B). Co więcej, nie tylko pojedyncze cechy, ale także korelacje między cechami mogą być plastyczne, a różne środowiska mogą zmieniać nachylenie i/lub znak korelacji cech (Stearns et al. 1991, Stearns 1992). U ropuch szarych (Scaphiophus couchii), na przykład, osobniki, które rozwijają się w stawach o krótkim czasie trwania mają krótszy okres larwalny i mniejszy rozmiar ciała w momencie metamorfozy (przy czym cechy te są ujemnie skorelowane) niż osobniki, które rozwijają się w stawach o długim czasie trwania (przy czym cechy te są dodatnio skorelowane) (Newman 1988, Stearns et al. 1991).
Po omówieniu podejścia do modelowania optymalności i czynników, które wpływają na ekspresję cech historii życia, przechodzimy teraz do omówienia niektórych głównych przewidywań dla ewolucji historii życia (szczegóły patrz: Stearns 1992, Roff 1992, Charlesworth 1994, Stearns 2000, Roff 2002).
Predictions for the Evolution of Life History Traits
W jakim wieku i rozmiarze powinien dojrzewać organizm? Sukces reprodukcyjny genotypu zależy silnie od jego tempa wzrostu i – jako konsekwencja wzrostu – od jego wieku i wielkości w momencie dojrzewania. Aby przewidzieć optymalny wiek i rozmiar w momencie dojrzewania, musimy zrozumieć względne koszty i korzyści (pod względem śmiertelności i reprodukcji) wczesnego lub późnego dojrzewania oraz wzrostu dużego lub pozostania małym. Korzyści z jednej „strategii” są kosztami drugiej, i odwrotnie. Korzyści z wcześniejszego dojrzewania i mniejszego rozmiaru (tj. koszty późniejszego dojrzewania i większego rozmiaru) obejmują: (1) wyższe prawdopodobieństwo przeżycia do wieku dojrzałego z powodu krótszego czasu trwania ryzykownego okresu rozwojowego i młodocianego, oraz (2) krótszy czas generacji, który pozwala rodzicom produkować potomstwo, które rodzi się wcześniej i które wcześniej zaczyna się rozmnażać. Tak więc, na przykład, wysoka śmiertelność młodocianych powinna sprzyjać ewolucji wcześniejszej dojrzałości. I odwrotnie, korzyści z dojrzewania później i w większym rozmiarze (tj. koszty dojrzewania wcześniej i w mniejszym rozmiarze) obejmują: (1) dłuższy wzrost, który prowadzi do większych rozmiarów w wieku dojrzałym, a tym samym do zwiększonej płodności (ponieważ płodność często wzrasta wraz z rozmiarem), (2) niższą śmiertelność dorosłych (a tym samym potencjalnie wyższą płodność w ciągu całego życia) ze względu na większy rozmiar (śmiertelność z powodu drapieżników jest często niższa dla większych osobników), oraz (3) wyższą jakość potomstwa (np. zwiększone inwestycje na potomstwo, lepsza opieka rodzicielska), co poprawia przeżywalność wyprodukowanego potomstwa.
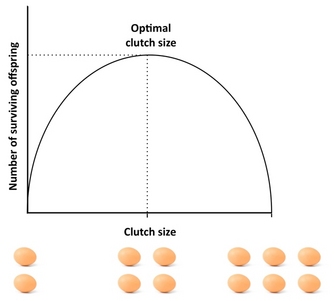
Jak wiele potomstwa powinien wyprodukować organizm? Dobrym punktem wyjścia do odpowiedzi na to pytanie jest „sprzęgło Lacka”, koncepcja, która sięga ornitologa Davida Lacka (1947). Podstawowym założeniem Lacka było to, że ptaki powinny optymalizować wielkość swojego sprzęgła poprzez maksymalizację liczby wylatanych (przeżywających) potomków. Odchylenia od optymalnej wielkości sprzęgła obniżają sukces reprodukcyjny: jeśli rodzice produkują zbyt duże sprzęgło, mogą nie być w stanie utrzymać i wychować całego potomstwa, a niektóre lub wszystkie z nich umierają, podczas gdy jeśli produkują zbyt małe sprzęgło, liczba wylatującego potomstwa może być niższa niż to, co rodzice mogliby utrzymać (Rysunek 4). Chociaż Lack był poprawny w swoim twierdzeniu, że kondycja jest często maksymalizowana przy pośredniej inwestycji, rozmiary sprzęgła są zazwyczaj mniejsze niż przewiduje to Lack. Dzieje się tak dlatego, że koncepcja ta ignoruje kilka czynników, które mogą zmniejszyć wielkość sprzęgła, w tym śmiertelność rodziców, przyszłą reprodukcję, tempo produkcji wnuków i konflikt między rodzicami a potomstwem. Na przykład, istnienie kompromisów pomiędzy bieżącą reprodukcją a przeżywalnością rodziców, bieżącą i przyszłą reprodukcją lub liczbą i wielkością potomstwa może powodować odchylenia od sprzęgła braku, a modele, które biorą takie czynniki pod uwagę zazwyczaj dają lepsze dopasowanie do obserwowanej wielkości sprzęgła niż sprzęgło braku. Doskonałe badania empiryczne nad optymalną wielkością sprzęgła można znaleźć w pracy Daan et al. (1990) na pustułkach europejskich.
Jak często organizm powinien się rozmnażać? Czy powinien być semelparny (tj. rozmnażać się tylko raz) czy iteroparny (tj. rozmnażać się kilka razy) (Rysunek 5; zob. też Young 2010)? Teoria sugeruje, że iteroparność i ewolucja zwiększonej długości życia reprodukcyjnego są preferowane, gdy przeżywalność osobników dorosłych jest wysoka, a płodność osobników dorosłych lub przeżywalność młodych niska: wysoka (lub niezmienna) przeżywalność osobników dorosłych zwiększa liczbę zdarzeń reprodukcyjnych w ciągu życia, a niska (lub zmienna) płodność lub przeżywalność osobników młodych powoduje straty kondycji, które selekcjonują do zwiększonego kompensacyjnego wysiłku reprodukcyjnego. I odwrotnie, semelparityzm i ewolucja zmniejszonej długości życia reprodukcyjnego są faworyzowane, gdy przeżywalność dorosłych jest niska, a przeżywalność młodych wysoka. Tak więc, wysoka (lub nie zmienna) przeżywalność dorosłych w stosunku do młodocianych sprzyja iteroparyczności i wydłuża długość życia reprodukcyjnego, podczas gdy wysoka (lub zmienna) śmiertelność dorosłych w stosunku do młodocianych sprzyja semelparności i skraca długość życia reprodukcyjnego. Organizmy semelparne mają zwykle większy wysiłek reprodukcyjny niż organizmy iteroparne.

Powyższe rozważania są aspektami bardziej ogólnego zagadnienia zwanego „ogólnym problemem historii życia” lub „modelem wysiłku reprodukcyjnego” (Schaffer 1983, Stearns 1992, Roff 1992, Charlesworth 1994): biorąc pod uwagę, że reprodukcja ma zarówno korzyści (tj, produkcja potomstwa) i koszty (np. zmniejszona przyszła reprodukcja, zwiększona śmiertelność rodziców lub potomstwa), jaka jest optymalna inwestycja reprodukcyjna, która maksymalizuje kondycję? Wiele teoretycznych i empirycznych badań zajęło się tym problemem; niektóre z głównych wniosków z tej pracy są następujące (patrz Stearns 1992, Roff 1992, Charlesworth 1994): (1) wysiłek reprodukcyjny często, ale nie zawsze, wzrasta wraz z wiekiem, ponieważ oczekuje się, że koszt obecnej reprodukcji w odniesieniu do przyszłej reprodukcji będzie malał wraz z wiekiem (ponieważ liczba przyszłych zdarzeń reprodukcyjnych, w których koszty mogą się przejawiać, maleje wraz z wiekiem); (2) jeśli wysiłek reprodukcyjny przynosi malejące zwroty lub jeśli śmiertelność wzrasta wraz ze wzrostem wysiłku, preferowane są pośrednie inwestycje reprodukcyjne i iteroparność; W przeciwnym razie, maksymalny wysiłek reprodukcyjny i semelparity są faworyzowane; (3) jeśli śmiertelność wzrasta we wszystkich klasach wiekowych, wysiłek reprodukcyjny wzrasta we wczesnym okresie życia, a wiek dojrzałości spada; podobnie, jeśli śmiertelność dorosłych wzrasta, wiek dojrzałości powinien spadać; i (4) jeśli śmiertelność wzrasta po określonym wieku (lub w jednej określonej klasie wiekowej), wysiłek reprodukcyjny wzrasta przed i spada po tym wieku. Jako szczególnie piękne testy takich modeli wysiłku reprodukcyjnego odsyłamy czytelnika do eksperymentów terenowych i laboratoryjnych Davida Reznicka i współpracowników na gupikach z Trynidadu (np. Reznick et al. 1990).
Jak długo powinien żyć organizm (patrz też Fabian i Flatt 2011)? Ewolucja długości życia może być postrzegana jako równowaga pomiędzy selekcją dla zwiększenia długości życia reprodukcyjnego (a więc potencjalnie zwiększonego sukcesu reprodukcyjnego) i starzenia się (tj. zależnego od wieku wzrostu śmiertelności). Korzyści z ewolucji dłuższego życia reprodukcyjnego obejmują (również patrz wyżej): (1) większą liczbę zdarzeń reprodukcyjnych (a więc i potomstwa) w ciągu życia, jeśli zewnątrzpochodna śmiertelność dorosłych jest niska, (2) wystarczający czas na reprodukcyjną kompensację potomstwa utraconego z powodu wysokiej śmiertelności młodocianych, oraz (3) zmniejszoną niepewność reprodukcyjną z powodu wysokiej zmienności śmiertelności młodocianych z jednej rundy reprodukcji na następną, ponownie dzięki możliwości kompensacji utraconego potomstwa. Efekty te są przeciwdziałane przez te, które zwiększają śmiertelność dorosłych (np. koszty przeżycia związane z reprodukcją; starzenie się) w stosunku do śmiertelności młodocianych. Tak więc, wzrost w średniej (i / lub wariancji) śmiertelności dorosłych w stosunku do młodocianych mają tendencję do faworyzowania krótszy okres reprodukcyjny i semelparity, podczas gdy zmniejszenie średniej (i / lub wariancji) dorosłych w stosunku do młodocianych śmiertelności mają tendencję do faworyzowania dłuższy okres reprodukcyjny i iteroparity.
Dzisiaj wiele z tych przewidywań teorii historii życia jest dobrze popartych dowodami; zakończymy ten artykuł podając przykład szczególnie eleganckiego eksperymentu, który potwierdził główne przewidywania „ogólnego problemu historii życia”.
Przykład empirycznego testu teorii
Aby przetestować podstawowe założenia teorii historii życia, Stearns i in. (2000) wykorzystali wyludnioną populację muszki owocowej (D. melanogaster) do stworzenia dwóch zestawów replikowanych linii „ewolucji eksperymentalnej”: trzy linie poddano działaniu wysokiej śmiertelności dorosłych (HAM; przez losowe zabicie 90% much dwa razy w tygodniu) i trzy linie poddano działaniu niskiej śmiertelności dorosłych (LAM; przez zabicie 10% much dwa razy w tygodniu). Po czterech latach eksperymentalnej ewolucji w tych warunkach w laboratorium, Stearns i współpracownicy zmierzyli fenotypy historii życia wszystkich linii w obu metodach, aby zbadać ewolucyjne odpowiedzi much na wysoką i niską śmiertelność zewnętrzną. Wyniki tego długoterminowego eksperymentu były zarówno jednoznaczne, jak i intrygujące, potwierdzając przewidywania teoretyczne: muszki owocowe, które ewoluowały w warunkach HAM rozwijały się szybciej jako larwy, wylęgały się wcześniej i przy mniejszych rozmiarach jako osobniki dorosłe, miały wyższą wczesną szczytową płodność i wykazywały krótszą długość życia niż muszki LAM, u których ewoluował przeciwny zestaw adaptacji. Innymi słowy, muchy ewoluujące w wysoce niebezpiecznym środowisku zareagowały ewolucyjnie przyspieszając swój rozwój, obniżając wiek i wielkość w wieku dojrzałym, składając wcześniej więcej jaj i żyjąc krócej: przystosowały się do wysokiego poziomu losowej śmiertelności poprzez przesunięcie ich wysiłku reprodukcyjnego na wcześniejszy wiek i poprzez skompresowanie całej historii życia w krótszą długość życia. Tak więc, podobnie jak w przypadku Reznick et al. (1990) u gupików, wyniki te potwierdzają główne przewidywania teorii historii życia, w szczególności główną rolę zewnątrzpochodnej śmiertelności dorosłych w kształtowaniu ewolucji wzrostu, dojrzewania, reprodukcji i starzenia się.
Podsumowanie
W tym miejscu przedstawiliśmy podstawy teorii historii życia. Teoria historii życia próbuje zrozumieć, w jaki sposób dobór naturalny projektuje organizmy w celu osiągnięcia sukcesu reprodukcyjnego, biorąc pod uwagę wiedzę o tym, jak czynniki selektywne w środowisku (np. śmiertelność zewnętrzna) i czynniki wewnętrzne organizmu (np. kompromisy, ograniczenia) wpływają na przeżycie i reprodukcję. Używając różnych metod teoretycznych i empirycznych, a w szczególności stosując myślenie optymalnością, teoretycy historii życia wyprowadzili główne przewidywania dotyczące ewolucji głównych cech historii życia, w tym wieku i wielkości w wieku dojrzałym, liczby i wielkości potomstwa, specyficznego dla wieku lub wielkości wysiłku reprodukcyjnego, długości życia reprodukcyjnego i starzenia się. Bazując na tych przewidywaniach i testując je w eksperymentach terenowych i laboratoryjnych, na przykład na muchach, rybach czy ptakach, biolodzy zajmujący się historią życia dostarczyli nam przekonujących odpowiedzi na fundamentalne pytania, takie jak: Jak szybko powinien rozwijać się organizm? W jakim wieku i jakiej wielkości powinien osiągnąć dojrzałość? Ile potomstwa powinien mieć i jak duże powinno ono być? Czy powinien rozmnażać się raz, czy więcej niż raz? I jak długo powinien żyć? Dzięki rozwiązaniu tych problemów teoria historii życia wywarła ogromny wpływ na nasze rozumienie adaptacji przez dobór naturalny, najbardziej fundamentalnego zagadnienia w całej biologii ewolucyjnej.