.jpg) Produkcja amoniaku jest kluczowa dla światowego przemysłu rolniczego, gdyż z niego produkowane są wszystkie nawozy zawierające azot.
Produkcja amoniaku jest kluczowa dla światowego przemysłu rolniczego, gdyż z niego produkowane są wszystkie nawozy zawierające azot.
Usługi amoniaku
Produkcja nawozów jest zdecydowanie najważniejszym zastosowaniem amoniaku. Należą do nich mocznik, sole amonowe (fosforany amonu, azotan amonu, azotan wapnia) oraz roztwory amoniaku.
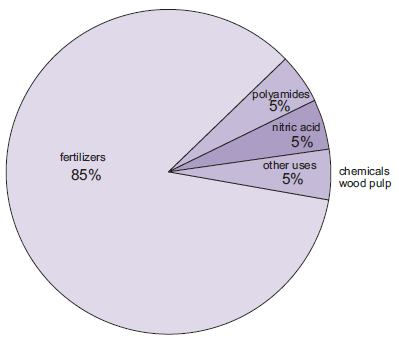
Rysunek 1 Zastosowania amoniaku.
Rośniejąca ilość amoniaku, choć wciąż niewielka w porównaniu z innymi zastosowaniami, jest wykorzystywana jako stężony roztwór w walce z odprowadzaniem tlenków azotu z elektrowni.
Roczna produkcja amoniaku
Ammoniak zajmuje drugie miejsce, po kwasie siarkowym, jako substancja chemiczna o największym tonażu. Jest on coraz częściej produkowany w krajach, które posiadają tanie źródła gazu ziemnego i węgla (Chiny i Rosja ok. 40%). Największe zakłady produkują ok. 3000 ton dziennie, a w planach jest budowa zakładów produkujących 4000-5000 ton dziennie, co oznaczałoby, że całkowitą produkcję światową można by opanować przy pomocy 100 takich jednostek. Obecna produkcja wynosi:
| Świat | 146 mln ton |
| Chiny | 48 mln ton |
| Rosja | 12 mln ton |
| Indie | 11 mln ton |
| U.S. | 9 mln ton |
| Indonezja | 5 mln ton |
| Trynidad i Tobago | 5 mln ton |
| Ukraina | 4 mln ton |
Dane z:
U.S. Geological Survey, Mineral Commodity Summaries, 2016.
Wzrost tonażu wyprodukowanego amoniaku po prostu nadąża za rosnącą polulacją świata i z jego rosnącym standardem życia. Przewiduje się, że do 2018 roku zapotrzebowanie na amoniak wzrośnie do blisko 200 mln ton.
1. International Fertilizer Association, 2014.
Produkcja amoniaku
Produkcja amoniaku z azotu i wodoru odbywa się w dwóch głównych etapach:
a) produkcja wodoru
b) synteza amoniaku (proces Habera)
Produkcja wodoru obejmuje kilka odrębnych procesów. Rysunek 2 przedstawia ich kolejność i umiejscowienie w zakładzie produkcji amoniaku (etapy 1-5). Pokazany jest również konwerter używany do produkcji amoniaku z wodoru (etap 6). To, co dzieje się w każdym z tych etapów, opisano poniżej rysunku.
|
Rysunek 2 Zakład produkcji amoniaku w Australii Zachodniej: 1 Jednostki odsiarczania |
.jpg) |
(a) Wytwarzanie wodoru
Wodór jest produkowany z różnych surowców, głównie z gazu ziemnego, węgla lub benzyny. Sposoby otrzymywania wodoru z tych surowców omówiono oddzielnie.
Wodór z gazu ziemnego (metanu)
Obejmuje to dwa etapy:
i) wytworzenie gazu syntezowego (mieszaniny tlenku węgla i wodoru (reforming parowy))
ii) usunięcie tlenku węgla i wytworzenie mieszaniny wodoru i azotu (reakcja przesunięcia)
(i) Wytworzenie gazu syntezowego
W jakikolwiek sposób uzyskuje się metan, będzie on zawierał pewne organiczne związki siarki i siarkowodór, z których oba muszą być usunięte. W przeciwnym razie zatrują one katalizator potrzebny do produkcji gazu syntezowego. W instalacji odsiarczania, organiczne związki siarki są często najpierw przekształcane w siarkowodór, przed reakcją z tlenkiem cynku. Materiał wsadowy jest mieszany z wodorem i przepuszczany przez katalizator składający się z mieszanych tlenków kobaltu i molibdenu na obojętnym nośniku (specjalnie obrobiony tlenek glinu) w temperaturze ok. 700 K.
.jpg)
Następnie gazy przepuszcza się przez tlenek cynku w temperaturze ok. 700 K i usuwa siarkowodór:
.jpg)
Pierwotny reforming parowy przekształca metan i parę wodną w gaz syntezowy, mieszaninę tlenku węgla i wodoru:
.jpg)
Wysokie temperatury i niskie ciśnienia sprzyjają powstawaniu produktów (Zasada Le Chateliera). W praktyce, reagenty są przepuszczane przez katalizator niklowy, drobno podzielony na powierzchni nośnika z tlenku wapnia/tlenku glinu, umieszczonego w pionowych rurkach ze stopu niklu. Rurki, do 350 równoległych, są ogrzewane w piecu w temperaturze powyżej 1000 K i pod ciśnieniem około 30 atm. Jest to przykład reaktora rurowego.
Drugi reforming parowy powoduje reakcję tlenu z powietrza z częścią obecnego w nim wodoru, a powstała mieszanina jest przepuszczana przez katalizator niklowy. Para i ciepło wytworzone w wyniku spalania reformują większość pozostałego metanu. Do kluczowych reakcji należą:
small.jpg)
Gaz powstający na tym egzotermicznym etapie ma temperaturę ok. 1200 K i jest chłodzony w wymiennikach ciepła. Para powstająca z wody używanej do chłodzenia gazów jest używana do obsługi turbin i tym samym sprężarek oraz do wstępnego podgrzewania reaktantów.
Niektóre ostatnie projekty wykorzystują ciepło odpadowe z wtórnego reformera bezpośrednio do dostarczenia ciepła do pierwotnego reformera.
Na tym etapie gaz zawiera wodór, azot, tlenek węgla i dwutlenek węgla oraz około 0,25% metanu. Ponieważ powietrze zawiera 1% argonu, ten również gromadzi się w gazie syntezowym.
(ii) Reakcja zmiany
Ten proces przekształca tlenek węgla w dwutlenek węgla, jednocześnie wytwarzając więcej wodoru.
Odbywa się w dwóch etapach. W pierwszym, wysokotemperaturowym, gaz jest mieszany z parą i przepuszczany przez katalizator z tlenku żelaza/chromu(III) w temperaturze około 700 K w reaktorze ze złożem stałym. Powoduje to obniżenie stężenia tlenku węgla z 11%:
.jpg)
W drugim etapie, reakcji przesunięcia w niskiej temperaturze, mieszanina gazów jest przepuszczana przez katalizator miedziowo-cynkowy w temperaturze ok. 500 K. Stężenie tlenku węgla jest dalej obniżane do 0,2%.
Reakcja przebiega w dwóch etapach z kilku powodów. Reakcja jest egzotermiczna. Jednakże, w wysokiej temperaturze, stężenie wyjściowe tlenku węgla jest nadal dość wysokie, ze względu na kontrolę równowagi. Katalizator miedziowy stosowany w etapie niskotemperaturowym jest bardzo wrażliwy na wysokie temperatury i nie mógłby efektywnie pracować w etapie wysokotemperaturowym. Dlatego też większa część reakcji jest przeprowadzana w wysokiej temperaturze, aby odzyskać większość ciepła. Gaz jest następnie usuwany w niskiej temperaturze, gdzie równowaga jest znacznie korzystniejsza, na bardzo aktywnym, ale niestabilnym katalizatorze miedziowym.
Mieszanina gazów zawiera obecnie około 18% dwutlenku węgla, który jest usuwany przez oczyszczanie gazu roztworem zasady, przy użyciu jednej z kilku dostępnych metod. Preferowana jest zasada organiczna (w absorberze dwutlenku węgla), roztwór etanoloaminy, często 2,2′-(metyloimino)bis-etanolu (N-metylo-dietanoloaminy).
Dwutlenek węgla uwalnia się po podgrzaniu roztworu w stripperze dwutlenku węgla.) Duża jego część jest skraplana i sprzedawana, np. do napojów gazowanych, jako chłodziwo w elektrowniach jądrowych i do wspomagania wzrostu roślin w szklarniach.
Ostatnie ślady tlenków węgla usuwa się przepuszczając gazy przez katalizator niklowy w temperaturze 600 K:
.jpg)
Proces ten znany jest jako metanizacja. Otrzymuje się gaz o typowym składzie: 74% wodoru, 25% azotu, 1% metanu, wraz z pewną ilością argonu.
Wodór z benzyny
Jeśli jako surowca używa się benzyny, konieczny jest dodatkowy etap reformingu. Benzyna jest ogrzewana do postaci pary, mieszana z parą wodną i przepuszczana przez rury, ogrzewane w temperaturze 750 K i wypełnione katalizatorem, niklem na nośniku z mieszaniny tlenków glinu i magnezu. Głównym produktem jest metan wraz z tlenkami węgla, który jest następnie przetwarzany przez reforming parowy, jak w przypadku gazu ziemnego, po którym następuje reakcja przemiany.
Wodor z węgla
Jeśli używa się węgla, jest on najpierw drobno mielony i ogrzewany w atmosferze tlenu i pary. Część węgla spala się bardzo szybko w tlenie (w czasie krótszym niż 0,1 s) powodując wzrost temperatury w piecu, a reszta węgla reaguje z parą wodną:
.jpg)
Wydzielający się gaz zawiera ok. 55% tlenku węgla, 30% wodoru, 10% dwutlenku węgla oraz niewielkie ilości metanu i innych węglowodorów. Mieszanina ta jest przetwarzana w reakcji przesunięcia.
Główne problemy związane z wykorzystaniem węgla to duże ilości dwutlenku i trójtlenku siarki powstające podczas spalania węgla oraz znaczne ilości innych zanieczyszczeń, takich jak arsen i brom, z których wszystkie są bardzo szkodliwe dla atmosfery i wszystkie są poważnymi truciznami dla katalizatorów w procesie. Istnieje również ogromny problem z utylizacją popiołu.
Wodór z biomasy
Gaz syntezowy może być produkowany z bioplazmy. Proces ten jest opisany w jednostce dotyczącej biorafinerii.
(b) Produkcja amoniaku (Proces Habera)
.jpg)
Sercem procesu jest reakcja pomiędzy wodorem i azotem w reaktorze ze złożem stałym. Gazy, w stechiometrycznych proporcjach, są podgrzewane i przepuszczane pod ciśnieniem przez katalizator (Rysunek 3).
.jpg)
Rysunek 3 Schemat ilustrujący konwencjonalny reaktor syntezy (konwerter).
Proporcja amoniaku w mieszaninie równowagowej wzrasta ze wzrostem ciśnienia i ze spadkiem temperatury (Zasada Le Chateliera). Dane ilościowe podano w tabeli 1. Aby uzyskać rozsądną wydajność i korzystną szybkość, stosuje się wysokie ciśnienie, umiarkowaną temperaturę i katalizator.
| Ciśnienie/atm | Procent amoniaku obecnego w stanie równowagi w zakresie temperatur | |||||
|---|---|---|---|---|---|---|
| 373 K | 473 K | 573 K | 673 K | 773 K | 973 K | |
| 10 | – | 50.7 | 14.7 | 3.9 | 1.2 | 0.2 |
| 25 | 91.7 | 63.6 | 27.4 | 8.7 | 2.9 | – |
| 50 | 94.5 | 74.0 | 39.5 | 15.3 | 5.6 | 1.1 |
| 100 | 96.7 | 81.7 | 52.5 | 25.2 | 10.6 | 2.2 |
| 200 | 98.4 | 89.0 | 66.7 | 38.8 | 18.3 | – |
| 400 | 99.4 | 94.6 | 79.7 | 55.4 | 31.9 | – |
| 1000 | – | 98.3 | 92.6 | 79.8 | 57.5 | 12.9 |
Tabela 1 Procent, objętościowo, amoniaku w mieszaninie równowagowej dla reakcji
między azotem a wodorem w zakresie temperatur i ciśnień.
W zależności od konstrukcji reaktora stosuje się szeroki zakres warunków. Stosowane temperatury wahają się od 600 do 700 K, a ciśnienia od 100 do 200 atmosfer. Prowadzone są intensywne prace nad poprawą skuteczności katalizatora, tak aby można było stosować ciśnienia tak niskie jak 50 atmosfer.
Ponieważ reakcja jest egzotermiczna, dodaje się chłodne reagenty (azot i wodór), aby obniżyć temperaturę reaktorów (rysunek 3).
Amoniak jest zwykle przechowywany na miejscu (etap 7) i przepompowywany do innej części zakładu, gdzie jest przekształcany w nawóz (mocznik lub sól amonową). Czasami jednak jest on transportowany drogą morską (rysunek 4) lub drogową, do wykorzystania w innym zakładzie.
.jpg) |
Rysunek 4 W zakładzie w Australii Zachodniej amoniak jest przesyłany rurociągiem do pobliskiego portu (Rysunek 2, krok 8) i transportowany statkiem. Ten przewozi około 40 000 ton skroplonego amoniaku. Za uprzejmą zgodą Yara International ASA. |
Oryginalnym katalizatorem, którego używał Haber, był Fe3O4, który był redukowany przez reagent, wodór, do żelaza. Wiele pracy włożono w udoskonalenie katalizatora i okazało się, że niewielka ilość wodorotlenku potasu była skuteczna jako promotor.
Ostatnio badania koncentrowały się na znalezieniu jeszcze bardziej skutecznych katalizatorów, aby proces mógł zachodzić przy niższych ciśnieniach i temperaturach. Obiecujący jest ruten na powierzchni grafitu.
.jpg)
Rysunek 5 Produkcja amoniaku.
Post script
Proces Habera ma tak duże znaczenie dla naszego życia, że został uhonorowany trzema Nagrodami Nobla w dziedzinie chemii, wszystkie przyznane niemieckim naukowcom w okresie prawie 90 lat, co jest niezwykłym rekordem.
Pierwsza została przyznana w 1918 r. Fritzowi Haberowi, chemikowi, który opracował proces w laboratorium. Drugim był Carl Bosch, którego błyskotliwe umiejętności inżynierskie umożliwiły zastosowanie procesu na masową skalę, ale który na swoją nagrodę czekał aż do 1931 r.
W 2007 r. Gerhard Ertl otrzymał nagrodę za pracę nad katalizą reakcji gazowych na ciałach stałych. Wśród szerokiego zakresu badanych przez niego reakcji, zdobył dowody na adsorpcję cząsteczek azotu i wodoru na powierzchni żelaza oraz na to, że te zaadsorbowane cząsteczki dysocjują na atomy. Atomy te następnie łączą się etapami, tworząc cząsteczkę amoniaku. Należy pamiętać, że warunki stosowane w tych badaniach (przy ciśnieniu poniżej 10-10 atm) bardzo różnią się od warunków stosowanych w przemyśle, ok. 150 atm.
Podsumowanie
Cały proces produkcji amoniaku z metanu jest podsumowany na rysunku 5. Jeśli surowcem jest węgiel lub benzyna, potrzebne są dodatkowe procesy. Benzyna jest przekształcana w metan i tlenki węgla przed przejściem do głównego reformera, a następnie do reakcji przemiany. Węgiel jest również przekształcany w wodór i tlenki węgla, a następnie mieszanina ta jest poddawana reakcji przemiany.
.