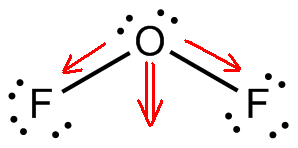
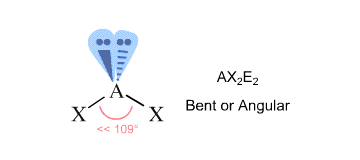Dyfluorek tlenu, #”OF”_2#, jest cząsteczką polarną, ponieważ ma wygiętą geometrię molekularną.
Ta geometria molekularna zapewnia, że momenty dipolowe związane z wiązaniami tlen – fluor nie znoszą się wzajemnie, dając cząsteczkę niepolarną.
Aby przekonać się, dlaczego tak jest, narysuj strukturę Lewisa tej cząsteczki. Cząsteczka będzie miała w sumie #20# elektronów walencyjnych
- #6# z atomu tlenu
- #7# z każdego z dwóch atomów fluoru
Atom tlenu będzie pełnił rolę atomu centralnego, tworząc pojedyncze wiązania z dwoma atomami fluoru. Wiązania te będą stanowiły #4# z #20# elektronów walencyjnych cząsteczki.
Wynikające z tego #16# elektrony zostaną umieszczone jako samotne pary
- trzy samotne pary na każdym atomie fluoru
- dwie samotne pary na atomie tlenu
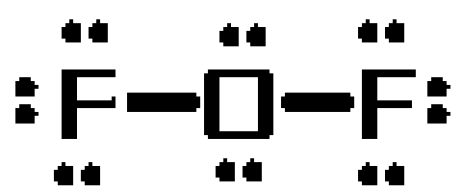
Teraz, bardzo ważne jest, aby zdać sobie sprawę, że struktury Lewisa nie są przeznaczone do przekazywania geometrii molekularnej!
Aby znaleźć geometrię cząsteczki, liczymy regiony gęstości elektronowej, które otaczają centralny atom – dadzą nam one liczbę steryczną atomu.
Regiony gęstości elektronowej to wiązania z innymi atomami (tutaj wiązania pojedyncze, podwójne lub potrójne liczą się jako jeden region) oraz samotne pary elektronów.
W twoim przypadku, centralny atom tlenu jest związany z dwoma innymi atomami i jest otoczony przez dwie samotne pary #-># to ma liczbę steryczną równą #4#.
Zgodnie z teorią VSEPR odpowiada to geometrii molekularnej #”AX”_2 „E”_2#, która jest charakterystyczna dla cząsteczki wygiętej.
Teraz, różnica w elektronegatywności między fluorem a tlenem zapewnia, że dwa wiązania #”O”-„F „# są polarne. Wygięta geometria molekularna spowoduje, że dwa momenty dipolowe dodadzą się do siebie.
W wyniku tego powstanie trwały moment dipolowy, a więc cząsteczki polarnej