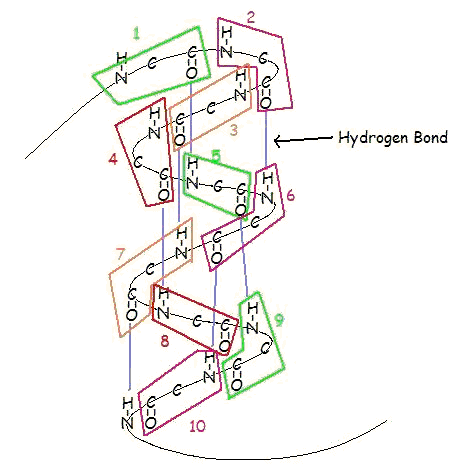
An α-helisa jest prawoskrętną spiralą reszt aminokwasowych na łańcuchu polipeptydowym, zwykle o długości od 4 do 40 reszt. Spirala ta jest utrzymywana razem przez wiązania wodorowe pomiędzy tlenem C=O na górnej spirali i wodorem N-H na dolnej spirali. Takie wiązanie wodorowe powstaje dokładnie co 4 reszty aminokwasowe, a każdy pełny obrót helisy to tylko 3,6 reszty aminokwasowej. Ten regularny wzór nadaje helisie α bardzo określone cechy w odniesieniu do grubości zwoju i długości każdego pełnego skrętu wzdłuż osi helisy.
Integralność strukturalna helisy α jest częściowo zależna od prawidłowej konfiguracji sterycznej. Aminokwasy, których grupy R są zbyt duże (tryptofan, tyrozyna) lub zbyt małe (glicyna) destabilizują α-helisy. Prolina również destabilizuje α-helisy ze względu na swoją nieregularną geometrię; jej grupa R wiąże się z powrotem do azotu grupy amidowej, co powoduje przeszkodę steryczną. Dodatkowo, brak wodoru na azocie Proliny uniemożliwia jej udział w wiązaniu wodorowym.
Innym czynnikiem wpływającym na stabilność α-helisy jest całkowity moment dipolowy całej helisy spowodowany indywidualnymi dipolami grup C=O zaangażowanych w wiązanie wodorowe. Stabilne α-helisy zazwyczaj kończą się naładowanym aminokwasem, aby zneutralizować moment dipolowy.