Wprowadzenie
| Klasa zasolenia | S |
| Hyperhaline | > 65 |
| Metahaline | 45-65 |
| Euhaline | 30-35 |
| Polyhaline | 18-30 |
| Mesohaline | 5-18 |
| Oligohaline | 0.5-5 |
Zasolenie wody morskiej definiuje się jako całkowitą ilość wagową rozpuszczonych soli w jednym kilogramie wody morskiej. Zasolenie wyrażane jest w jednostce g / kg, która często zapisywana jest jako ppt (part per thousand) lub ‰ (permil). Sole rozpuszczone w wodzie morskiej są zdysocjowane na swoje jony; dominującymi jonami są chlorki i sód; inne ważne jony to magnez, siarczany, wapń i potas. Z biegiem lat opracowano różne metody określania zasolenia. Najbardziej praktyczną obecnie stosowaną metodą jest metoda przewodnictwa elektrycznego. Ponieważ jest to metoda pośrednia, ustalono dokładny związek pomiędzy przewodnością a zasoleniem. Określone w ten sposób zasolenie jest wielkością bezwymiarową, która nazywana jest zasoleniem praktycznym. Zgodnie ze skalą praktycznego zasolenia, typowa „standardowa” woda morska ma zasolenie równe 35. W celu osiągnięcia lepszej zgodności z termodynamiką wody morskiej, w 2010 roku wprowadzono nową skalę zasolenia, tzw. skalę zasolenia bezwzględnego. Związana z tym niewielka liczbowa korekta praktycznej skali zasolenia nie ma dużego znaczenia praktycznego dla wód przybrzeżnych, gdzie jest ona karkołomna ze względu na dużą zmienność zasolenia w czasie i przestrzeni. Jednak w przypadku oceanu konieczna jest duża precyzja, ponieważ niewielkie różnice zasolenia mogą mieć duże znaczenie dla wielkoskalowej cyrkulacji oceanicznej i charakterystyki mas wodnych.
Woda morska jest gęstsza niż słodka ze względu na dodatkowy ciężar rozpuszczonych soli; zależność między zasoleniem a gęstością omówiono w artykule Gęstość wody morskiej). Ten artykuł zawiera przegląd różnych skal zasolenia. Czujniki stosowane do pomiaru przewodności omówiono w artykule Czujniki zasolenia.
Pomiary i definicje zasolenia na przestrzeni dziejów
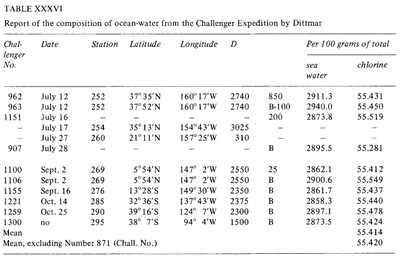
Stały skład wody morskiej (Dittmar, 1884)
Od czasów starożytnej Grecji podejmowano próby pomiaru „słoności” wody morskiej. Jednak te wczesne metody nie były zbyt wydajne, a ich czułość i powtarzalność była bardzo ograniczona. W okresie nowożytnym opracowano bardziej precyzyjne metody: ważenie po odparowaniu (Boyle, 1693; Birch, 1965), ekstrakcja rozpuszczalnikiem (Lavoisier, 1772) i strącanie (Bergman, 1784). W 1865 r. Forchhammer wprowadził termin zasolenie i poświęcił się pomiarom poszczególnych składników soli morskiej, a nie całkowitego zasolenia. Odkrył on, że stosunek głównych soli w próbkach wody morskiej z różnych miejsc jest stały. Ten stały stosunek znany jest jako Zasada Forchhammera, lub Zasada Stałych Proporcji. Pod koniec XIX wieku Wilhelm Dittmar, podążając za pracami Forchhammera, przetestował kilka metod analizy zasolenia i składu chemicznego wody morskiej. Metody Dittmara do analizy chemicznej wody morskiej były niezwykle precyzyjne. Dittmar analizował zawartość chloru w wodzie morskiej za pomocą strącania chlorków azotanem srebra i porównywał je z syntetycznie przygotowanymi próbkami wody morskiej, aby ocenić dokładność metody. Później przeanalizował 77 próbek z całego świata, pobranych podczas wyprawy Challenger Expedition i zauważył tę samą stałość składu zaobserwowaną przez Forchhammera: „chociaż stężenie wód jest bardzo różne, to skład procentowy rozpuszczonego materiału jest prawie taki sam we wszystkich przypadkach”. .
Definicja zasolenia 1902
Przy dokładniejszych technikach pomiaru zasolenia, zaistniała potrzeba posiadania tej samej definicji zasolenia i metod pomiarowych w całej społeczności naukowej. W 1889 roku Martin Knudsen został powołany przez ICES do przewodniczenia komisji, która miała zająć się kwestią zasolenia. Sformułował on następującą definicję:
„Zasolenie to całkowita ilość materiałów stałych, w gramach, rozpuszczonych w jednym kilogramie wody morskiej, gdy wszystkie węglany zostały przekształcone w tlenki, brom i jod zastąpione chlorem, a cała materia organiczna całkowicie utleniona”.
Mimo że definicja ta jest poprawna i służyła oceanografom przez następne 65 lat, metodologia jest niepraktyczna i trudna do precyzyjnego przeprowadzenia. Wiedząc, że główne jony pozostają w stałych proporcjach względem siebie, a chlor może być dokładnie zmierzony przez wolumetryczne miareczkowanie srebra, komisja zdefiniowała „chlorowość” jako miarę zasolenia. Pierwotnie, zasolenie było obliczane na podstawie zawartości Cl- (chlorowości). Chlorowość jest mierzona jako masa w g halogenków, które mogą być wytrącone z 1000 g wody morskiej przez Ag+ przy użyciu standardowego roztworu AgNO3. Reakcja jest następująca:
AgNO3 (aq) + NaCl (aq) → AgCl(s) + NaNO3 (aq)
Po przeanalizowaniu dużej liczby próbek z dziewięciu miejsc Knudsen i jego koledzy opracowali równanie do obliczania zasolenia na podstawie zawartości chloru:
S = 1,805 ^-, Cl^- + 0,03 ^; g / kg , ^quad (1)
gdzie chlorowość Cl- jest zdefiniowana jako masa srebra wymagana do całkowitego wytrącenia chlorowców w 0,3285234 kg próbki wody morskiej:
Cl- = 328.5234 Ag+
Pomiary zasolenia są czasami wyrażane w skali chlorowości (g Cl- / kg) lub w skali chlorowatości (g Cl- / l).
Zrewidowana definicja zasolenia 1966
Jak widać ze wzoru (1), metoda ta ma swoje ograniczenia i nie jest całkowicie poprawna: gdy chlorowość wynosi 0, zasolenie wynosi 0,03. Co więcej, Carritt i Carpenter (1959) oszacowali, że niepewność obliczonej wartości zasolenia na podstawie zmierzonej wartości chlorowości przy użyciu tej zależności może wynosić aż 0,04 g / kg. Wynika to z różnic w składzie chemicznym niektórych próbek wody morskiej (Bałtyk) oraz z faktu, że do określenia chlorowości pobrano próbki tylko z 9 różnych miejsc. Na początku lat 60-tych, wraz z rozwojem mostków konduktometrycznych, możliwe stało się mierzenie zasolenia z dużą precyzją (± 0,003 g/kg). Mostki podawały stosunek przewodności pomiędzy próbką a standardową wodą morską używaną do kalibracji mostków. Jednakże standardowa woda morska została opracowana dla pomiarów chlorowości, a nie dla przewodności, dlatego też zlecono opracowanie nowego standardu przewodności Wspólnemu Panelowi ds. Tablic i Standardów Oceanograficznych (JPOTS). W oparciu o nowe pomiary zasolenia, temperatury i przewodności z próbek z całego świata, stała formuła chlorowości została zmieniona na:
S = 1.80655 \, Cl^- . \qquad (2)
Praktyczna Skala Zasolenia-1978 / EOS-80
WHAT IS PSU? by Frank J. Millero in Oceanography Magazine, 1993
Po otrzymaniu najnowszego numeru Oceanografii, zirytowała mnie reklama Sea-Bird na wewnętrznej stronie okładki. Pokazuje ona diagram TS, który jest oznaczony terminem PSU. Chociaż nie udało mi się nakłonić firmy do zaprzestania używania tego terminu, pomyślałem, że powinienem napisać ten list, aby wyrazić moje obawy dotyczące jego użycia przez moich oceanografów w publikowanych artykułach. Termin ten najwyraźniej jest używany do oznaczenia stosowania Praktycznej Skali Zasolenia i jest skrótem od Practical Salinity Unit (Praktyczna Jednostka Zasolenia). Jako członek Joint Panel on Oceanographic Tables and Standards (Wspólnego Panelu ds. Tablic i Standardów Oceanograficznych), który odegrał zasadniczą rolę w opracowaniu międzynarodowego równania stanu wody morskiej oraz praktycznej skali zasolenia, jestem zdumiony praktyką, która, jak się wydaje, została przyjęta przez oceanografów, polegającą na stosowaniu PSU. Praktyczna skala zasolenia została zdefiniowana jako stosunek przewodności bez jednostek. Próbka wody morskiej o współczynniku przewodności 1,0 w temperaturze 15ºC z roztworem KCl o masie 32,4356 g w całkowitej masie 1 kg roztworu ma zasolenie 35.000 (nie są potrzebne jednostki ani ‰). Zależność tego stosunku od zasolenia i temperatury dla masy wody morskiej odparowanej lub rozcieńczonej wodą doprowadziła do pełnej definicji praktycznej skali zasolenia. Definicja ta została przyjęta przez wszystkie krajowe i międzynarodowe organizacje oceanograficzne. Gdzieś po drodze oceanografowie zaczęli używać terminu PSU (practical salinity unit – jednostka praktycznego zasolenia), aby wskazać, że praktyczna skala zasolenia jest używana do określania zasolenia konduktometrycznego. Najwyraźniej wynikało to z wcześniejszego stosowania ‰ jako części na tysiąc, co niektórzy oceanografowie uznawali za jednostkę. Wniosek jest taki, że zasolenie zawsze było stosunkiem i nie posiada jednostek fizycznych. Używanie terminu PSU nie powinno być dozwolone w terenie, a już na pewno nie powinno być stosowane w publikowanych pracach. W każdym przypadku, gdy do określenia zasolenia stosuje się praktyczną skalę zasolenia, należy to zaznaczyć gdzieś w pracy. Termin PSS może być użyty do wskazania, że zastosowano Praktyczną Skalę Zasolenia. Z pewnością nie trzeba używać terminu PSU na wszystkich rysunkach przedstawiających dane TS. Powinienem również zaznaczyć, że UNESCO (1985) opublikowało raport SUN, który dokładnie opisuje użycie jednostek w dziedzinie oceanografii. Raport ten został również przyjęty przez wszystkie Międzynarodowe Towarzystwa Oceanograficzne, ale nie jest powszechnie stosowany przez oceanografów i czasopisma publikujące dane oceanograficzne. Jeśli oceanografia ma stać się uznaną nauką, musi przyjąć jednostki, które są podstawowe dla chemii i fizyki. Nie powinna również przyjmować nowych jednostek dla zmiennych, które są bezjednostkowe.
Stosunek wagowy różnych rozpuszczonych soli w wodzie morskiej jest prawie taki sam wszędzie na całym świecie oceanów. Dotyczy to również wód przybrzeżnych, chociaż odchylenia od standardowego składu stają się bardziej istotne przy niskim zasoleniu w strefie przejściowej między solą a wodą słodką. Ze względu na w przybliżeniu uniwersalny skład soli rozpuszczonych w wodzie morskiej, zasolenie wody morskiej można określić na podstawie stopnia rozcieńczenia wody morskiej wodą słodką. Najwygodniej jest to zrobić poprzez pomiar przewodności C. Praktyczna Skala Zasolenia (PSS) została wprowadzona w celu ustalenia jednoznacznej zależności między zasoleniem a przewodnością. Zależność ta oparta jest na stosunku R przewodności wody morskiej do przewodności C(35,15) roztworu wzorcowego o masie 1 kg zawierającego 32,4356 g KCl w temperaturze 15oC, który ma zasolenie S=35.
Zależność pomiędzy zasoleniem S(T) a stosunkiem przewodności R=R(S,T) oparto na precyzyjnych oznaczeniach chlorowości i stosunku przewodności dla różnych temperatur T na 135 próbkach naturalnej wody morskiej, wszystkich pobranych w odległości do 100 m od powierzchni, w tym próbkach ze wszystkich oceanów oraz mórz: Bałtyckiego, Czarnego, Śródziemnego i Czerwonego. Po przeliczeniu chlorowości na zasolenie, wykorzystując zależność (2), obliczono następujący wielomian metodą najmniejszych kwadratów:
S(T) = S(15) + \Delta S(T) , \quad R= \Large \frac{C(S,T)}{C(35,15)} \normalsize , \quad (3)
S(15)=0.008-0.1692,R^{1/2}+25.3851,R+14.0941,R{3/2}-7.0261,R^2+2.7081,R^{5/2} , \quad (4)
Delta S(T)= \Largefrac{T-15}{1+0.0162(T-15)}\normalsize (0.0005-0.0056\,R^{1/2} \\ -0.0066\,R-0.0375\,R^{3/2}+0.0636\,R^2-0.0144},R^{5/2}) , quad (5)
dla 2 \, \ S \, 42 i dla ciśnienia atmosferycznego,
S(15) \, C^{1,0876} gdzie C wyrażone jest w mS/cm.
Jednakże, ponieważ przewodność bezwzględna nie może być mierzona z taką dokładnością, jaka jest wymagana do precyzyjnych pomiarów zasolenia, zaleca się stosowanie przewodności mierzonej w stosunku do przewodności standardowej wody morskiej i stosowanie zależności zasolenie-przewodność (3-5).
Praktyczna Skala Zasolenia została przyjęta w 1980 r. jako międzynarodowy standard dla oceanografii przez UNESCO/SCOR/ICES/IAPSO Joint Panel on Oceanographic Tables and Standards i SCOR Working Group 51 (JPOTS). Odpowiednie Equation Of State of Seawater (EOS-80) oparte na skali temperatury IPTS-68 i na Praktycznej Skali Zasolenia 1978, PSS-78 (Lewis i Perkin, 1981) zostało opublikowane przez Millero et al. (1980).
TEOS-10
IOC przy UNESCO wprowadziło w 2010 r. nową definicję zasolenia, tzw. zasolenie bezwzględne S_A. Termodynamiczne Równanie Stanu (TEOS) zostało zaktualizowane z kilku powodów :
- Kilka wielomianowych wyrażeń Międzynarodowego Równania Stanu Wody Morskiej (EOS-80) nie jest w pełni zgodna ze sobą, ponieważ nie są one dokładnie zgodne z termodynamicznymi relacjami Maxwella dotyczącymi zróżnicowania krzyżowego. Nowe podejście eliminuje ten problem.
- Od końca lat 70-tych pojawił się dokładniejszy opis termodynamiczny czystej wody (IAPWS-95). Wykonano również więcej dokładnych pomiarów właściwości wody morskiej (takich jak (i) pojemność cieplna, (ii) prędkość dźwięku oraz (iii) temperatura maksymalnej gęstości), które mogą być włączone do nowego opisu termodynamicznego wody morskiej.
- Wpływ zmienności składu wody morskiej w różnych basenach oceanicznych na gęstość wody morskiej stał się lepiej zrozumiały.
- Wzrastający nacisk na ocean jako integralną część globalnego silnika cieplnego wskazuje na potrzebę dokładnych wyrażeń dla entalpii i energii wewnętrznej wody morskiej, tak aby strumienie ciepła mogły być dokładniej określone w oceanie (entalpia i energia wewnętrzna nie były dostępne w EOS-80).
- Skala temperatury została zmieniona z ITS-68 na ITS-90, a masy atomowe pierwiastków zostały zmienione.
Zasolenie bezwzględne S_A jest zdefiniowane jako ułamek masowy rozpuszczonego materiału nie-H2O w próbce wody morskiej w jej temperaturze i ciśnieniu i wyrażone w jednostkach g / kg. Dlatego jest ono również określane jako zasolenie gęstościowe. Ułamek masowy H2O w próbce wody morskiej jest więc określony przez 1-0.001 S_A. Definicja ta prawidłowo rozwiązuje problem „co stanowi wodę, a co stanowi materiał rozpuszczony” (na przykład, rozpuszczenie danej masy CO2 w czystej wodzie zasadniczo przekształca część wody w materiał rozpuszczony, ponieważ powstaje mieszanina CO2, H2CO3, HCO3-, CO32-, H+, OH- i H2O, przy czym względne proporcje zależą od stałych dysocjacji, które zależą od temperatury, ciśnienia i pH.).
Wartości zasolenia bezwzględnego S_A różnią się tylko nieznacznie od odpowiadających im wartości zasolenia praktycznego S. Dla wody morskiej o standardowym składzie odniesienia
S_A = ≥Large\frac{35.16504}{35}normalsize S \; g / kg \quad (6).
Innymi słowy, dla referencyjnej próbki wody morskiej o zasoleniu praktycznym 35 zasolenie bezwzględne wynosi 35,16504 g/kg. Dla wody morskiej niestandardowej, pobranej w dowolnych miejscach oceanu, średnia różnica pomiędzy wartością zasolenia bezwzględnego S_A a równaniem (6) wynosi około 0,0107 g/kg. Wiadomo, że wartość zasolenia bezwzględnego S_A wyrażona w g / kg i odpowiadająca jej wartość zasolenia praktycznego S różnią się nie więcej niż o około 0,5%. Stosowanie zasolenia praktycznego ma tę zaletę, że jest ono (prawie) bezpośrednio określane na podstawie pomiarów przewodności, temperatury i ciśnienia, podczas gdy zasolenie bezwzględne jest zwykle uzyskiwane z kombinacji tych pomiarów oraz innych pomiarów i korelacji, które często nie są dobrze ustalone.
Biologiczny wpływ zasolenia

Osmoza przez półprzepuszczalną błonę, która pozwala cząsteczkom wody (niebieskim) przechodzić łatwiej niż cząsteczkom soli (czerwonym). Więcej cząsteczek wody przechodzi przez membranę do przedziału wody morskiej niż cząsteczek soli do przedziału wody słodkiej, aż do momentu, gdy stężenie soli jest równe po obu stronach membrany. W ten sposób wzrasta ciśnienie w komorze wody morskiej, tzw. ciśnienie osmotyczne. Adaptacja z ZME Science.
Wszystkie organizmy muszą utrzymywać równowagę pomiędzy wodą i rozpuszczalnikami w swoich ciałach, aby utrzymać swoje komórki przy życiu. Nazywa się to homeostazą. Aby to regulować, mogą one importować i eksportować rozpuszczalniki przez swoje błony, które są przepuszczalne dla substancji rozpuszczonych lub zawieszonych w wodzie. Przypadkowy ruch substancji rozpuszczonych przez przepuszczalną błonę nazywa się dyfuzją. Dyfuzja zachodzi do momentu, gdy stężenia po obu stronach membrany są równe. Kiedy substancja rozpuszczona nie może przejść przez membranę, równość stężeń po obu stronach osiągana jest przez ruch netto wody przez membranę. Ruch netto wody przez błonę półprzepuszczalną w odpowiedzi na różnice w stężeniu solutu nazywa się „osmozą”. Jest to niezbędne dla przetrwania komórek. W przypadku wyższego stężenia soli na zewnątrz niż wewnątrz, komórka straci wodę, stanie się odwodniona i umrze. W odwrotnym przypadku, komórka wchłonie wodę, napęcznieje i być może pęknie. Z tego powodu organizmy inwestują czas i energię w utrzymanie homeostazy.
Czujniki zasolenia Gęstość wody morskiej Intruzja wody morskiej i mieszanie w estuariach Cyrkulacja estuariowa Estuaria klina solnego Wymiana morza szelfowego z oceanem
Proszę zauważyć, że inni mogli również edytować treść tego artykułu.
- Dla innych artykułów tego autora patrz: Category:Articles by Souza Dias, Francisco
- Dla innych artykułów tego autora patrz: Category:Articles by TÖPKE, Katrien
- Aby zapoznać się z wkładem tego autora zobacz Special:Contributions/Francisco Souza Dias
- Aby zapoznać się z wkładem tego autora zobacz Special:Contributions/Ktopke