Wzrost i proliferacja guza
W normalnych warunkach, mTOR jest głównym regulatorem wzrostu i podziału komórek. Jednak w komórkach nowotworowych, nieprawidłowo aktywowany mTOR wysyła sygnały, które zachęcają komórki nowotworowe do wzrostu, przerzutów i inwazji na nowe zdrowe tkanki. Wśród nich, PI3K/fosforan i homologia grzybów usunięta na chromosomie 10 (PTEN)/AKT/TSC ścieżka jest głównym aktywatorem mTORC1, a mutacje genów w tej ścieżce mogą prowadzić do nowotworów złośliwych. Ponadto, ekspresja PTEN jest często eliminowana przez modyfikacje epigenetyczne, genetyczne i potranskrypcyjne w celu zwiększenia regulacji ścieżki PI3K/Akt/mTOR w większości nowotworów złośliwych.
Hou i wsp. odkryli, że mutacje w genie PTEN prowadziły do nieprawidłowej aktywacji ścieżki PI3K/PTEN w raku wątrobowokomórkowym (HCC). Co więcej, delecja genu PTEN indukuje ekspresję B7-H1, co prowadzi do immunosupresji oraz zwiększa progresję i inwazję guza. W raku wątroby, aktywowana ścieżka PI3K/PTEN/Akt/mTOR jest zaangażowana w inwazję guza i przerzuty poprzez wzrost regulacji metalopeptydazy macierzy 9 (MMP-9). Podobnie, szlak PI3K/Akt/mTOR kontroluje proliferację i przeżycie komórek macierzystych raka okrężnicy (CCSC). W sporadycznym raku jelita grubego, CCSC mogą być przyczyną nawrotów i przerzutów. Xie i wsp. stwierdzili, że mutacja genu kinazy wątrobowej B1 (LKB1) lub zewnątrzkomórkowy sygnał wzrostu mogą aktywować MTORC1. MTORC1 hamuje aktywność białka palca pierścieniowego 168 (RNF168) i promuje jego degradację poprzez fosforylację 60. seryny RNF168. To znacznie zmniejszy ubikwitynację modyfikacji histonu H2A i H2A histonu członka rodziny X (H2AX) po uszkodzeniu DNA, co zahamuje odpowiedź na uszkodzenie DNA i zmniejszy stabilność genomu, prowadząc do promocji złośliwej transformacji komórek i raka. Ponadto, istniejące badania pokazują, że Rheb jest GTPazą, która wiąże i aktywuje mTORC1, gdy GTP jest załadowany. Deng i wsp. wykazali, że ubikwitynacja Rheb jest regulowana przez sygnały czynników wzrostu. Ubikwitynowany Rheb hamuje aktywność Rheb poprzez promowanie wiązania Rheb do TSC2, co prowadzi do zahamowania ekspresji mTORC1. Oprócz szlaku mTORC1, szlak mTORC2 jest również zaangażowany w regulację powstawania i rozwoju komórek nowotworowych. Wang i wsp. wykazali, że deubikwitynaza OTU 7B (OTUD7B) obniża poziom ubikwitynacji GβL, aby zapobiec interakcji GβL z SIN1, co prowadzi do aktywacji szlaku sygnałowego mTORC2/AKT i obniżenia ekspresji mTORC1. To częściowo aktywuje onkogenną sygnalizację AKT i promuje nowotworzenie. Jednakże ligaza ubikwitynowa TNF Receptor Associated Factor 2 (TRAF2) wywiera przeciwny efekt, zwiększając poziom ubikwitynacji GβL. Podobnie Kovalski i wsp. dowiedli, że mutacje Ras mogą wiązać się z mTOR kinazy mTORC2 i białkiem 1 (MAPKAP1) aktywowanym przez mitogen (mitogen-activated protein kinase-associated protein 1) w celu promowania aktywności kinazy mTORC2, inicjując w ten sposób programy transkrypcji proliferacyjnego cyklu komórkowego.
Podsumowując, mTOR jest zawsze stymulowany w nowotworach w celu utrzymania wzrostu, przeżycia i proliferacji komórek nowotworowych i odgrywa kluczową rolę w biologii komórek nowotworowych (Ryc. 1). 1).
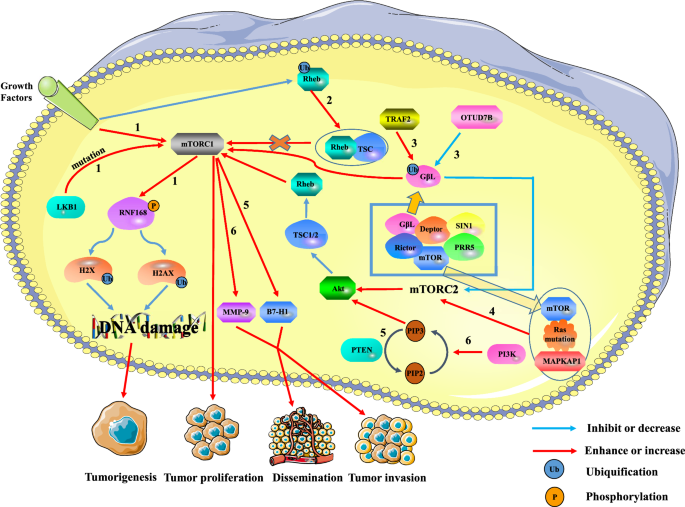
Zależność między mTOR a guzami. Nadaktywacja mTORC1 może promować powstawanie guzów, proliferację i przerzuty, podczas gdy mTORC2 może regulować ekspresję mTORC1 poprzez szlak mTORC2/AKT/TSC/Rehb. Ścieżka 1: Zewnątrzkomórkowe sygnały wzrostu i wewnątrzkomórkowe mutacje LKB1 aktywują mTORC1, która zmniejsza ubikwitynację histonu H2A i H2A po uszkodzeniu DNA poprzez fosforylację RNF168. Może to prowadzić do uszkodzenia naprawy DNA i sprzyjać powstawaniu nowotworów. Ścieżka 2: Ubikwitynacja Rheb zmniejsza aktywność Rheb poprzez promowanie wiązania Rheb do TSC2. Obniżenie regulacji Rehb zmniejsza aktywację mTORC1, co prowadzi do zahamowania wzrostu guza. Ścieżka 3: TRAF2 i Otud7B odpowiednio regulują aktywność mTORC1/2 poprzez zwiększenie lub zmniejszenie poziomu ubikwitynacji G beta L mTORC2. TRAF2 zwiększał aktywność mTORC1 i hamował aktywność mTORC2. Chociaż obniżenie ekspresji mTORC2 inaktywuje szlak AKT/TSC/Rehb/mTORC1, ogólna aktywność mTORC1 jest zwiększona. Jednakże Otud7B ma odwrotny wpływ na TRAF2. Ścieżka 4: Zmutowany Ras wiąże się z mTOR i MAPKAP1 mTORC2, aby promować ekspresję mTORC2. Wzrost regulacji mTORC2 promuje proliferację guza poprzez ścieżkę AKT/TSC/Rehb/mTORC1. Ścieżka 5: Delecja genu PTEN indukuje ekspresję B7-H1, co zwiększa progresję i inwazję guza. Ścieżka 6: Ścieżka PI3K/PTEN/AKT/mTOR jest zaangażowana w inwazję i przerzuty raka wątroby poprzez wzrost regulacji MMP-9
Metabolizm guza
mTOR jest aktywowany, gdy składniki odżywcze są wystarczające, co promuje anabolizm oraz magazynowanie i wykorzystanie energii. Kiedy składniki odżywcze są stosunkowo rzadkie, organizm musi hamować aktywację mTOR, aby utrzymać materiał komórkowy i energię na stałym poziomie. Komórki nowotworowe wymagają dużych ilości białek, lipidów i nukleotydów, aby odpowiedzieć na ich potrzeby wzrostu i podziału. Dlatego nieprawidłowa aktywność szlaku mTOR często występuje w nowotworach, ponieważ mTOR odgrywa kluczową rolę w regulacji metabolizmu.
W komórkach raka piersi, szlak PI3K/AKT/mTORC1/sterol regulatory element-binding protein (SREBP) jest głównym mechanizmem indukowania syntezy nowych lipidów i promowania proliferacji guza. Kinaza pirogronianowa (PK) jest zaangażowana w metabolizm cukrów, podczas gdy syntaza kwasu tłuszczowego (FASN) jest zaangażowana w syntezę kwasu tłuszczowego (FA). Tao i wsp. odkryli, że obniżenie ekspresji kinazy pirogronianowej M2 (PKM2) dezaktywuje szlak sygnałowy AKT/mTOR, zmniejszając w ten sposób ekspresję SREBP-1c. Zmniejszony poziom ekspresji SREBP-1c hamuje wytwarzanie FA poprzez hamowanie transkrypcji genu FASN, co skutkuje zahamowaniem wzrostu komórek nowotworowych. Ponadto Di Malta i wsp. donoszą, że wyregulowany gen czynnika transkrypcyjnego enhancer (TFE) może aktywować szlak Rag GTPase/mTORC1. W normalnych komórkach szlak ten jest aktywowany, aby komórki mogły lepiej absorbować składniki odżywcze w celu utrzymania funkcji fizjologicznych. W komórkach nowotworowych, szlak ten jest często nadmiernie aktywowany, aby zaspokoić potrzeby żywieniowe szybko rosnących komórek nowotworowych. Jednakże Guri i wsp. zbadali, że mTORC2 promował produkcję sfingomieliny i kardiolipiny w HCC. Z jednej strony sfingomielina i fosfolipidy sercowe są składnikami strukturalnymi biofilmów komórkowych. Z drugiej strony, metabolizm i transport fosfolipidów sercowych przyczynia się do prawidłowego funkcjonowania mitochondriów, więc muszą być one dostarczane w dużych ilościach w szybko proliferujących komórkach nowotworowych. Wyniki te sugerują, że szlak sygnałowy mTORC2 promuje proliferację HCC i produkcję lipidów związanych z energią.
Jak wspomniano powyżej, metabolizm komórek nowotworowych może być regulowany przez szlak mTOR, aby zaspokoić ich potrzeby proliferacyjne i odżywcze. I odwrotnie, metabolizm komórek nowotworowych może również promować wzrost guza poprzez szlak mTOR. Ericksen i wsp. wykazali, że zmniejszenie rozkładu aminokwasów rozgałęzionych (BCAA) może promować występowanie i rozwój guzów poprzez zwiększenie aktywności mTORC1. Stwierdzili oni również, że aktywność kluczowego enzymu w procesie katabolizmu BCAA jest silnie skorelowana z inwazją guza. Dlatego też akumulacja BCAA spowodowana zahamowaniem katabolizmu BCAA w tkankach guza wątroby może być podstawowym mechanizmem przewlekłej aktywacji nowotworowego mTORC1. Podobnie Shi i wsp. wykazali, że ekspresja receptora adenozyny A2a (A2aR) w tkankach raka żołądka (GC) była zwiększona, a ekspresja A2aR była pozytywnie skorelowana z zaawansowaniem GC. Wyniki te sugerują, że adenozyna aktywuje ścieżkę sygnałową PI3K/AKT/mTOR poprzez wiązanie się z A2aR, co ostatecznie sprzyja postępowi GC. Madak-Erdogan i wsp. stwierdzili, że wolne kwasy tłuszczowe (FFAs) aktywowały receptor estrogenowy α (ERα) i szlak mTOR, co było skorelowane z wyższą proliferacją i inwazyjnością komórek ER (+) raka piersi.
Badania te wskazują, że szlak sygnałowy mTOR jest ściśle związany z metabolizmem nowotworu i dostarczają teoretycznego wsparcia dla łącznego stosowania inhibitorów mTOR i niektórych leków, które zakłócają metabolizm nowotworu (ryc. 2). 2).
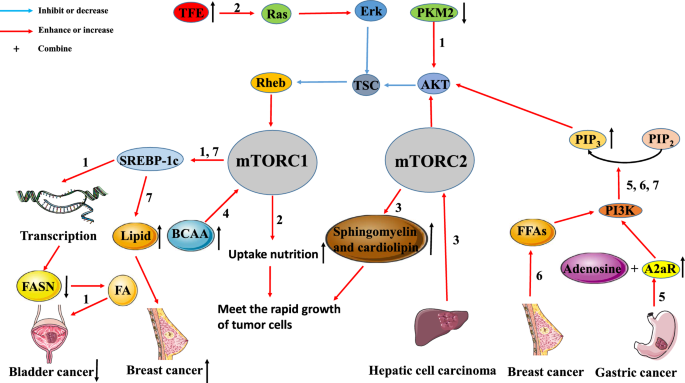
Interakcje pomiędzy metabolizmem guza a szlakiem sygnalizacyjnym mTOR. Szlak mTOR jest ściśle związany z metabolizmem guza. Ścieżka 1: W raku pęcherza moczowego, down-regulation ekspresji PKM2 zmniejsza ekspresję SREBP-1 poprzez inaktywację ścieżki AKT/TSC/Rehb/mTORC1. Obniżenie ekspresji SREBP-1c hamuje wytwarzanie FA poprzez zahamowanie transkrypcji FASN, co prowadzi do zahamowania wzrostu guza). Ścieżka 2: Podwyższona regulacja TEF w guzach aktywuje ścieżkę Ras/Erk/TSC/Rehb/mTORC1. Aktywacja tego szlaku będzie promować pobieranie składników odżywczych przez komórki nowotworowe, aby zaspokoić potrzeby szybkiego wzrostu guza. Ścieżka 3: HCC może zwiększać produkcję sfingomieliny i kardiolipiny poprzez aktywację mTORC2. Duże ilości sfingomieliny i kardiolipiny są wykorzystywane do składania błon komórkowych, które również zaspokajają potrzeby szybkiej proliferacji guza. Ścieżka 4: Nagromadzenie BCAA może promować występowanie i rozwój guzów poprzez aktywację mTORC1. Ścieżka 5: A2aR, który jest wysoce wyrażony w raku żołądka, wiąże adenozynę, aby aktywować ścieżkę PI3K/AKT/mTORC1. Ścieżka 6: W raku piersi, FFAs promują proliferację guza i przerzuty poprzez aktywację ścieżki PI3K/AKT/mTORC1. Ścieżka 7: Ścieżka PI3K/AKT/mTORC1/SREBP promuje proliferację raka piersi poprzez indukowanie syntezy nowych lipidów
Komórki odpornościowe
Tumory mogą rozwijać tolerancję immunologiczną poprzez tłumienie zdolności układu odpornościowego do rozpoznawania i zabijania komórek nowotworowych. Immunoterapia nowotworów jest gorącym tematem badawczym w ostatnich latach, a wiele dowodów wskazuje na to, że szlak mTOR, który jest często nieprawidłowo aktywowany w guzach, może regulować różnicowanie i funkcję komórek odpornościowych.
Komórki T
Komórki progenitorowe T ze szpiku kostnego wchodzą do grasicy, gdzie różnicują się w dwa typy komórek: komórki αβ T i γδ T. Poprzez eksperyment z nokautem genów, Yang i wsp. udowodnili, że delecja RAPTOR w mTORC1 przerwałaby proces przebudowy metabolizmu oksydacyjnego i metabolizmu glukozy podczas różnicowania komórek T. To wyzwala produkcję reaktywnych form tlenu. Wywołuje to produkcję reaktywnych form tlenu (ROS), które zaburzają różnicowanie komórek T αβ i zwiększają różnicowanie komórek T γδ. Ponadto Essig i wsp. wykazali, że roquina może hamować ekspresję szlaku PI3K/mTOR. Downregulacja szlaku PI3K/mTOR nie tylko hamuje różnicowanie i aktywację tradycyjnych komórek T, ale także ogranicza specjalizację komórek Treg. Pollizzi i wsp. stwierdzili w modelach mysich, że aktywacja mTORC1 promuje produkcję klastra różnicowania (CD) 8+ efektorowych komórek T o wysokiej glikolizie. Komórki te zachowują fenotyp efektorowy, ale nie ulegają konwersji do fenotypu pamięci. W przeciwieństwie do nich, komórki T z obniżoną aktywnością mTORC1 mają cechy komórek pamięci, ale nie mogą różnicować się w komórki efektorowe i nie mogą wytworzyć odpowiedzi pamięci immunologicznej ze względu na wadliwą funkcję metaboliczną. Dalsze badania wykazały, że mTORC1 może wpływać na funkcję efektorową komórek T CD8+, podczas gdy aktywność mTORC2 reguluje zdolność pamięci komórek T CD8+.
Ogólnie, ścieżka sygnalizacyjna mTOR może wpływać na różnicowanie i funkcję komórek T. Badania te rozszerzają nasze obecne zrozumienie biologii komórek T.
Komórki naturalnego zabójcy i komórki dendrytyczne
Scieżka sygnalizacyjna mTOR nie tylko reguluje komórki T, ale jest ściśle związana z różnicowaniem i funkcjami komórek dendrytycznych (DC) i komórek naturalnego zabójcy (NK). DC mają silną zdolność prezentacji antygenów, a komórki NK są ważnymi komórkami odpornościowymi w organizmie. Wang i wsp. udowodnili, że mTORC1 i mTORC2 regulują działanie komórek NK w unikalny sposób. Stwierdzili, że mTORC2 negatywnie reguluje funkcje komórek NK głównie poprzez hamowanie osi transduktor sygnału i aktywator transkrypcji 5 (STAT5)/członek rodziny nośników wolnych 7 (SLC7A5). Natomiast mTORC1 pozytywnie reguluje aktywność mTORC2 poprzez podtrzymywanie szlaku sygnałowego interleukiny (IL)-15 pośredniczonego przez CD122. W ostatnich latach uważa się, że oprócz komórek NK, również DC są związane ze szlakiem sygnałowym mTOR. Chen i wsp. stwierdzili, że apoptoza DC wywodzących się z komórek jednojądrzastych szpiku kostnego (BMM) była zmniejszona po leczeniu inhibitorami mTOR. Stwierdzili również, że DC pochodzące z komórek BMM mają lepsze zdolności prezentacji antygenów, a cytotoksyczne limfocyty T CD8+ specyficzne dla e7 aktywowane przez te DC mają większą aktywność przeciwnowotworową. Inhibitory mTOR mogą zatem zwiększyć skuteczność immunoterapii nowotworów poprzez wydłużenie czasu życia DC, poprawę zdolności prezentacji antygenów i ich przetwarzania. Badania te dostarczają pomysłów na ukierunkowanie komórek NK i DC do terapii przeciwnowotworowej.
Makrofagi
Makrofagi typu M1 mogą zabijać komórki nowotworowe na wiele sposobów, podczas gdy makrofagi typu M2 promują powstawanie, inwazję i przerzuty nowotworów. Zhihua i wsp. wykazali, że ekspresja mikroRNA (miRNA)-30c była znacząco zmniejszona w GC. Dalsze badania wykazały, że czynnik indukowany hipoksją-1α (HIF-1α) hamował ekspresję miRNA-30c. Obniżenie ekspresji miRNA-30c zmniejszy aktywność mTOR i glikolizę w makrofagach związanych z guzem. To ostatecznie będzie promować wzrost GC i przerzuty poprzez hamowanie różnicowania i funkcji makrofagów typu M1.
Ogólnie, ścieżka mTOR, która jest często aktywowana w nowotworach, promuje wzrost guza poprzez regulację różnicowania i funkcji komórek odpornościowych. Odegra to pozytywną rolę w poszukiwaniu nowej immunoterapii i poprawie leczenia nowotworów.
Odporność guza na leki
Celowanie w szlaki molekularne komórek nowotworowych jest sposobem leczenia różnych nowotworów, ale guzy nieuchronnie rozwijają oporność na leki. Kiedy guz staje się oporny, efekty uboczne leczenia wzrastają, podczas gdy skuteczność leku znacznie spada.
Twory układu pokarmowego
Badania wykazały, że mitochondrialne białko rozprzęgające 2 (UCP2) prowadzi do oporności guza na wiele leków przeciwnowotworowych poprzez redukcję ROS generowanych przez metabolizm mitochondrialny. Dando i wsp. udowodnili, że połączenie genipiny i ewerolimusu może synergistycznie hamować wzrost komórek gruczolakoraka trzustki (PAAD) i indukować autofagię komórek nowotworowych. Dzieje się tak, ponieważ inhibicja UCP2 w komórkach PAADD aktywuje ścieżkę Akt/mTOR poprzez mechanizm zależny od ROS, co zmniejsza antyproliferacyjny efekt inhibitora UCP2 – genipiny. Szlak hedgehog, w którym pośredniczy białko palca cynkowego GLI1, odgrywa istotną rolę w GC. Yao i wsp. wykazali jednak, że szlak AKT/mTOR może aktywować GLI1. Co więcej, ekspresja GLI1 i p-AKT była skorelowana z przerzutami komórek nowotworowych i opornością na leki, a poziom ekspresji był negatywnie skorelowany z rokowaniem pacjentów z GC.
Twory układu oddechowego
Inhibitor wee1 AZD1775, który celuje w naprawę DNA i punkty kontrolne cyklu komórkowego, okazał się skuteczny u niektórych pacjentów z rakiem płuc, ale oporność na lek jest również powszechna. W związku z tym Sen i wsp. stwierdzili, że ekspresja kinazy tyrozynowej receptora AXL (ARK) w opornym na AZD1775 drobnokomórkowym raku płuca (SCLC) była podwyższona. ARK może bezpośrednio lub za pośrednictwem mTOR aktywować szlak kinaz białkowych regulowanych zewnątrzkomórkowo (ERK) w celu rekrutacji i aktywacji kinazy punktu kontrolnego 1 (CHK1). Wyniki te sugerują, że ARK może usprawniać naprawę uszkodzeń DNA poprzez aktywację CHK1, co ostatecznie unieważnia inhibitor Wee1. Podobnie Ye i wsp. wykazali, że w niedrobnokomórkowym raku płuca (NSCLC), transmembrana-4 L-sześć członek rodziny-1 (TM4SF1) reguluje wrażliwość guza na leki chemioterapeutyczne poprzez regulację ekspresji receptora domeny dyskoidalnej 1 (DDR1)/ścieżki Akt/ERK/mTOR.
Rak nerki i rak skóry
Inhibitory kinazy tyrozynowej (TKI) mogą być stosowane w leczeniu raka nerkowokomórkowego (RCC), ale u niektórych pacjentów z RCC rozwinie się oporność na leki. Ishibashi i wsp. donoszą, że leczenie skojarzone inhibitorem receptora interleukiny-6 (IL-6R) i inhibitorem TKI w niskich dawkach było bardziej skuteczne w hamowaniu wzrostu RCC i angiogenezy in vivo w porównaniu z zastosowaniem samego inhibitora TKI. Wynika to z faktu, że niskie dawki inhibitorów TKI indukują wysoki poziom IL-6, która aktywuje szlak AKT/mTOR. Wyniki te sugerują, że mechanizm niepowodzenia inhibitorów TKI u niektórych chorych na RCC jest związany z podwyższoną aktywacją IL-6 szlaku sygnałowego mTOR.
Mutacje proto-onkogenu B-Raf (BRAF) występują w nieczerniakowych rakach skóry (NMSC), ale inhibitory BRAF nie były stosowane w tych nowotworach. Głównym powodem jest fakt, że NMSC z mutacją BRAF wykazują pierwotną lub wtórną oporność na inhibitory BRAF. Sen i wsp. stwierdzili silną korelację pomiędzy szlakiem sygnałowym PI3K/mTOR a opornością na inhibitory BRAF. Sugeruje to, że aktywacja szlaku mTOR może prowadzić do oporności NMSC zmutowanych w BRAF na inhibitory BRAF. Ponadto Obenauf i wsp. stwierdzili, że inhibitory BRAF, kinazy tyrozynowej receptora anaplastycznego (ALK) i receptora naskórkowego czynnika wzrostu (EGFR) indukowały pewne sygnały wydzielnicze w komórkach nowotworowych, co prowadziło do proliferacji i przerzutów lekoopornych komórek nowotworowych. Dalsze badania wykazały, że w komórkach czerniaka poddanych działaniu inhibitora BRAF, downregulacja czynnika transkrypcyjnego FOS related antigen-1 (FRA1) aktywuje wiele szlaków sygnałowych, wśród których główną rolę odgrywa szlak PI3K/AKT/mTOR. Jednoczesne hamowanie szlaków sygnałowych BRAF i PI3K/AKT/mTOR pozwala na zahamowanie wzrostu opornych na leki komórek czerniaka zmutowanego w BRAF.
Powyższe badania sugerują, że komórki nowotworowe mogą unikać indukowanej lekami przeciwnowotworowymi śmierci komórek poprzez aktywację wewnątrzkomórkowego szlaku sygnałowego mTOR, a więc aktywacja szlaku sygnałowego mTOR może być jednym z mechanizmów oporności nowotworów na leki. Kombinacje leków ukierunkowane na szlak sygnałowy mTOR mogą być stosowane w leczeniu guzów, które rozwinęły oporność.
Autofagia i apoptoza nowotworów
Z jednej strony, autofagia może utrzymać genom w stanie stabilnym poprzez usuwanie uszkodzonych organelli i błędnie uformowanych białek, więc może hamować wzrost komórek nowotworowych. Z drugiej strony, autofagia dostarcza guzowi więcej składników odżywczych, co wzmacnia zdolność guza do radzenia sobie w ekstremalnych warunkach. Ponadto nieograniczona proliferacja nowotworów jest częściowo spowodowana zahamowaniem apoptozy komórek nowotworowych.
Sun i wsp. stwierdzili, że mTOR hamuje ekspresję kinazy syntazy glikogenu-3 (GSK-3) w komórkach raka prostaty. Zmniejszenie regulacji GSK-3 hamuje szlak sygnałowy kaspazy-3, prowadząc do zmniejszenia produkcji ROS. Zmniejszona ilość ROS hamuje apoptozę komórek nowotworowych, chroniąc komórki raka prostaty. Jednak Zou i wsp. donieśli, że mTORC2 uniemożliwił nowotworowemu inhibitorowi fosfatazy białkowej 2A (CIP2A) wiązanie się z fosfatazą białkową 2A (PP2A), aby przywrócić aktywność PP2A. PP2A zmniejsza transkrypcję miR-9-3p i zwiększa ekspresję czynnika transkrypcyjnego E2F 1 (E2F1) poprzez promowanie degradacji c-Myc, dzięki czemu hamuje apoptozę komórek nowotworowych. Ponadto, Yang i wsp. wykazali, że ekspresja p-AKT, p-mTOR, P62 i B-cell lymphoma-2 (BCL-2) była znacząco zmniejszona w komórkach raka płaskonabłonkowego jamy ustnej (OSCC) z knockdownem długiego niekodującego RNA (lncRNA) CASC9, podczas gdy ekspresja BCL2 associated X (BAX) była zwiększona. Wyniki te sugerują, że lncRNA CASC9 hamuje apoptozę indukowaną autofagią poprzez szlak AKT/mTOR, co promuje proliferację komórek OSCC.
Podsumowując, powyższe badania wskazują, że szlak sygnałowy mTOR może promować występowanie i progresję nowotworów poprzez regulację autofagii i apoptozy komórek nowotworowych. Ponadto, powyższe badania stanowią również teoretyczne wsparcie dla badań klinicznych nad lekami ukierunkowanymi przeciwnowotworowo, co ma ogromne znaczenie.