Calcular cargas formais
A carga formal de um átomo numa molécula é a carga hipotética que o átomo teria se pudéssemos redistribuir uniformemente os electrões nas ligações entre os átomos. Outra forma de dizer isto é que a carga formal resulta quando tomamos o número de electrões de valência de um átomo neutro, subtraímos os electrões sem ligação, e depois subtraímos o número de ligações ligadas a esse átomo na estrutura de Lewis.
Assim, calculamos a carga formal da seguinte forma:
Carga formal = (electrões de valência do elemento “livre”) – (electrões não partilhados) – (ligações).
Podemos verificar novamente os cálculos da carga formal determinando a soma das cargas formais para toda a estrutura. A soma das cargas formais de todos os átomos de uma molécula deve ser zero; a soma das cargas formais de um ião deve ser igual à carga do ião.
Devemos lembrar que a carga formal calculada para um átomo não é a carga real do átomo na molécula. A carga formal é apenas um procedimento de contabilidade útil; não indica a presença de cargas reais.
Cálculo da Carga Formal de Lewis Structures
Atribuir cargas formais a cada átomo no íon interhalogenado \({ICl4-}}).
Solução
Dividimos igualmente os pares de electrões de ligação para todas as ligações {I-Cl}}:
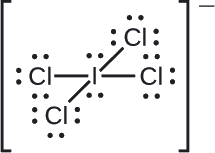 imageedit_2_8215662475.png
imageedit_2_8215662475.png
>/p>p> Atribuímos pares de electrões solitários aos seus átomos. Cada átomo de Cl tem agora sete electrões atribuídos, e o átomo I tem oito.
Subtrair este número do número de electrões de valência para o átomo neutro:
- I: 7 – 8 = -1
- Cl: 7 – 7 = 0
A soma das cargas formais de todos os átomos é igual a -1, que é idêntica à carga do ião (-1).
Exercicio \(\PageIndex{1})
p>Calcular a carga formal de cada átomo na molécula de monóxido de carbono:

Resposta
C -1, O +1
Cálculo da Carga Formal de Lewis Structures
Atribuir cargas formais a cada átomo na molécula interhalogena {BrCl3}}.
Solução
Atribuir um dos electrões em cada ligação de Br-Cl ao átomo de Br e um ao átomo de Cl nessa ligação:
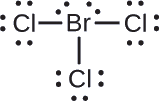 imageedit_6_8383188586.png
imageedit_6_8383188586.png
Atribuir os pares solitários ao seu átomo. Agora cada átomo de Cl tem sete electrões e o átomo de Br tem sete electrões.
Subtrair este número do número de electrões de valência para o átomo neutro. Isto dá a carga formal:
- Br: 7 – 7 = 0
- Cl: 7 – 7 = 0
Todos os átomos em {BrCl3}} têm uma carga formal de zero, e a soma das cargas formais totaliza zero, como deve acontecer numa molécula neutra.
Exercicio \\(\PageIndex{2})
p>Determinar a carga formal para cada átomo em \(\ce{NCl3}}.Resposta
p>N: 0; todos os três átomos de Cl: 0