.jpg) O fabrico de amoníaco é crucial para a indústria agrícola mundial, pois a partir dele são produzidos todos os fertilizantes que contêm azoto.
O fabrico de amoníaco é crucial para a indústria agrícola mundial, pois a partir dele são produzidos todos os fertilizantes que contêm azoto.
Usos de amoníaco
O fabrico de fertilizantes é de longe o uso mais importante de amoníaco. Estes incluem ureia, sais de amónio (fosfatos de amónio, nitrato de amónio, nitrato de amónio de cálcio) e soluções de amoníaco.
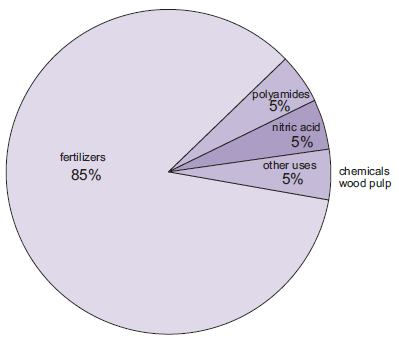
Figure 1 Os usos do amoníaco.
Uma quantidade crescente de amoníaco, embora ainda pequena em comparação com outras utilizações, é utilizada como solução concentrada no combate à descarga de óxidos de azoto das centrais eléctricas.
Produção anual de amoníaco
Amoníaco ocupa o segundo lugar, em relação ao ácido sulfúrico, como o químico com a maior tonelagem. É cada vez mais produzido em países que têm fontes de gás natural e carvão de baixo custo (a China e a Rússia são responsáveis por cerca de 40%). As maiores fábricas produzem cerca de 3000 toneladas por dia e existem planos para construir fábricas que produzem 4000-5000 toneladas por dia, o que significaria que a produção mundial total poderia ser gerida com 100 unidades deste tipo. A produção actual é:
| World | 146 milhões de toneladas |
| China | 48 milhões de toneladas |
| Rússia | 12 milhões de toneladas |
| India | 11 milhões de toneladas |
| U.S. | 9 milhões de toneladas |
| 5 milhões de toneladas >/td> |
|
| Trinidad e Tobago | 5 milhões de toneladas |
| 4 milhões de toneladas |
Data from:
U.S. Geological Survey, Mineral Commodity Summaries, 2016.
O aumento da tonelagem de amoníaco produzido está apenas a acompanhar a crescente polulação mundial e o seu crescente nível de vida. Espera-se que a procura de amoníaco aumente para quase 200 milhões de toneladas até 20181.
1. International Fertilizer Association, 2014.
Fabrico de amoníaco
O fabrico de amoníaco a partir de azoto e hidrogénio tem lugar em duas fases principais:
a) o fabrico de hidrogénio
b) a síntese de amoníaco (o Processo Haber)
p>O fabrico de hidrogénio envolve vários processos distintos. A figura 2 mostra a sua sequência e a localização dentro de uma fábrica de amoníaco (etapas1-5). Também é mostrado o conversor utilizado para fazer amoníaco a partir do hidrogénio (passo 6). O que ocorre em cada uma destas etapas é descrito abaixo da figura.
|
Figure 2 Uma fábrica de amoníaco na Austrália Ocidental: 1 Unidades de dessulfuração |
.jpg) |
(a) O fabrico de hidrogénio
Hidrogénio é produzido a partir de uma variedade de matérias-primas, principalmente de gás natural, carvão ou nafta. As formas como o hidrogénio é obtido a partir destas matérias-primas são tratadas em separado.
Hidrogénio a partir de gás natural (metano)
Isto envolve duas fases:
i) o fabrico do gás de síntese (uma mistura de monóxido de carbono e hidrogénio (vapor reforming))
ii) a remoção do monóxido de carbono e a produção de uma mistura de hidrogénio e azoto (a reacção de deslocamento)
(i) O fabrico do gás de síntese
Seja qual for a forma de obtenção do metano, este conterá alguns compostos orgânicos de enxofre e sulfureto de hidrogénio, ambos os quais devem ser removidos. Caso contrário, irão envenenar o catalisador necessário para o fabrico do gás de síntese. Na unidade de dessulfuração, os compostos orgânicos de enxofre são muitas vezes primeiro convertidos em sulfureto de hidrogénio, antes da reacção com óxido de zinco. A matéria-prima é misturada com hidrogénio e passa sobre um catalisador de óxidos mistos de cobalto e molibdénio sobre um suporte inerte (uma alumina especialmente tratada) a cerca de 700 K.
.jpg) br>
br>
br>Então os gases são passados sobre óxido de zinco a cerca de 700 K e o sulfureto de hidrogénio é removido:
.jpg)
Reformação a vapor primário converte metano e vapor em gás de síntese, uma mistura de monóxido de carbono e hidrogénio:
.jpg)
As altas temperaturas e as baixas pressões favorecem a formação dos produtos (Princípio de Le Chatelier). Na prática, os reagentes são passados sobre um catalisador de níquel, finamente dividido na superfície de um suporte de óxido de cálcio/ óxido de alumínio contido em tubos verticais de liga de níquel. Os tubos, até 350 em paralelo, são aquecidos num forno acima de 1000 K e sob uma pressão de cerca de 30 atm. Este é um exemplo de um reactor tubular.
Secundário vapor reforming reage ao oxigénio do ar com uma parte do hidrogénio presente e a mistura resultante é passada sobre um catalisador de níquel. O vapor e o calor produzidos a partir da combustão reformam a maior parte do metano residual. Entre as principais reacções estão:
small.jpg)
O gás emergente desta fase exotérmica líquida está a cerca de 1200 K e é arrefecido em permutadores de calor. O vapor formado a partir da água utilizada no arrefecimento dos gases é utilizado para operar turbinas e assim compressores e para pré-aquecer reactores.
algumas concepções recentes utilizam o calor residual do reformador secundário directamente para fornecer calor ao reformador primário.
Nesta fase o gás contém hidrogénio, azoto, monóxido de carbono e dióxido de carbono e cerca de 0,25% de metano. Como o ar contém 1% de árgon, este também se acumula no gás de síntese.
(ii) A reacção de deslocamento
Este processo converte o monóxido de carbono em dióxido de carbono, enquanto gera mais hidrogénio.
Tem lugar em duas fases. Na primeira, a reacção de deslocamento a altas temperaturas, o gás é misturado com vapor e passa sobre um catalisador ferro/óxido de crómio(III) a cerca de 700 K, num reactor de leito fixo. Isto diminui a concentração de monóxido de carbono de 11%:
.jpg)
Na segunda fase, a reacção de deslocamento a baixa temperatura, a mistura de gases é passada sobre um catalisador de cobre-zinco a cerca de 500 K. A concentração de monóxido de carbono é ainda mais reduzida para 0,2%.
A reacção é feita em duas fases por várias razões. A reacção é exotérmica. No entanto, a alta temperatura, a concentração de saída de monóxido de carbono é ainda bastante elevada, devido ao controlo de equilíbrio. O catalisador de cobre utilizado na fase de baixa temperatura é muito sensível às altas temperaturas, e não poderia funcionar eficazmente na fase de alta temperatura. Assim, a maior parte da reacção é realizada a alta temperatura para recuperar a maior parte do calor. O gás é então removido a baixa temperatura, onde o equilíbrio é muito mais favorável, no catalisador de cobre muito activo mas instável.
A mistura de gás contém agora cerca de 18% de dióxido de carbono que é removido esfregando o gás com uma solução de uma base, utilizando um dos vários métodos disponíveis. Um que é favorecido é uma base orgânica (no absorvedor de dióxido de carbono), uma solução de uma etanolamina, frequentemente 2,2′-(metilimino)bis-etanol (N-metil dietanolamina).
O dióxido de carbono é libertado ao aquecer a solução no decapante do dióxido de carbono). Muito dele é liquefeito e vendido, por exemplo, para bebidas carbonatadas, como refrigerante para centrais nucleares e para promover o crescimento de plantas em estufas.
Os últimos vestígios de óxidos de carbono são removidos passando os gases sobre um catalisador de níquel a 600 K:
.jpg)
Este processo é conhecido como metanização. Um gás é obtido de composição típica: 74% hidrogénio, 25% azoto, 1% metano, juntamente com algum argon.
Hidrogénio da nafta
Se a nafta for utilizada como matéria-prima, é necessária uma fase de reforma extra. A nafta é aquecida para formar um vapor, misturada com vapor e passada através de tubos, aquecida a 750 K e embalada com um catalisador, níquel apoiado numa mistura de óxidos de alumínio e magnésio. O produto principal é metano juntamente com óxidos de carbono, sendo depois processado por reforma a vapor, como se fosse gás natural, seguido pela reacção de deslocamento.
Hidrogénio do carvão
Se for utilizado carvão, este é primeiro finamente moído e aquecido numa atmosfera de oxigénio e vapor. Parte do carvão queima muito rapidamente em oxigénio (em menos de 0,1 s) causando o aumento da temperatura no forno e o resto do carvão reage com o vapor:
.jpg)
O gás emitido contém cerca de 55% de monóxido de carbono, 30% de hidrogénio, 10% de dióxido de carbono e pequenas quantidades de metano e outros hidrocarbonetos. Esta mistura é tratada pela reacção de deslocamento.
Os principais problemas de utilização do carvão incluem as grandes quantidades de dióxido de enxofre e trióxido geradas na queima do carvão e as quantidades significativas de outras impurezas tais como arsénico e bromo, todas elas muito nocivas para a atmosfera e todas elas são venenos severos para os catalisadores no processo. Há também um enorme problema com a eliminação das cinzas.
Hidrogénio da biomassa
Gás de síntese pode ser produzido a partir de biomassa. O processo é delineado na unidade sobre biorefinarias.
(b) O fabrico de amoníaco (Processo Haber)
.jpg)
O coração do processo é a reacção entre hidrogénio e azoto num reactor de leito fixo. Os gases, em proporções estequiométricas, são aquecidos e passados sob pressão sobre um catalisador (Figura 3).
.jpg)
Figure 3 Um diagrama que ilustra um reactor de síntese convencional (um conversor).
A proporção de amoníaco na mistura de equilíbrio aumenta com o aumento da pressão e com a queda da temperatura (Princípio de Le Chatelier). Os dados quantitativos são apresentados no Quadro 1. Para obter um rendimento razoável e uma taxa favorável, são utilizadas pressões elevadas, temperaturas moderadas e um catalisador.
Tabela 1 Percentagem, por volume, de amoníaco na mistura de equilíbrio para a reacção
entre azoto e hidrogénio a uma gama de temperaturas e pressões.
É utilizada uma vasta gama de condições, dependendo da construção do reactor. As temperaturas utilizadas variam entre 600 e 700 K, e as pressões entre 100 e 200 atmosferas. Muito trabalho está a ser feito para melhorar a eficácia do catalisador, para que pressões tão baixas como 50 atmosferas possam ser utilizadas.
Como a reacção é exotérmica, são adicionados reagentes refrigerantes (azoto e hidrogénio) para reduzir a temperatura dos reactores (Figura 3).
O amoníaco é normalmente armazenado no local (passo 7) e bombeado para outra parte da instalação onde é convertido num fertilizante (ureia ou sal de amónio). Contudo, por vezes é transportada por mar (Figura 4) ou por estrada, para ser utilizada noutra planta.
.jpg) |
Figura 4 Numa fábrica na Austrália Ocidental, o amoníaco é transferido por gasoduto para um porto próximo (Figura 2, passo 8) e transportado por navio. Este transporta cerca de 40 000 toneladas de amoníaco liquefeito. Por autorização gentil da Yara International ASA. |
O catalisador original que Haber utilizou foi Fe3O4, que foi reduzido pelo reagente, hidrogénio, a ferro. Muito trabalho foi feito para melhorar o catalisador e verificou-se que uma pequena quantidade de hidróxido de potássio era eficaz como promotor.
Recentemente, a investigação tem-se concentrado em encontrar catalisadores ainda mais eficazes para permitir que o processo tenha lugar a pressões e temperaturas mais baixas. O ruténio sobre uma superfície de grafite é um promissor.
.jpg) br>>p>p>Figure 5 A produção de amoníaco.
br>>p>p>Figure 5 A produção de amoníaco.
br>
Postscript
O Processo Haber é de tal importância para as nossas vidas, que figurou em três Prémios Nobel da química, todos para cientistas alemães, ao longo de um período de quase 90 anos, um recorde notável.
O primeiro foi dado em 1918, a Fritz Haber, o químico que desenvolveu o processo no laboratório. O segundo foi para Carl Bosch, cujos brilhantes conhecimentos de engenharia tornaram o processo viável em grande escala, mas que esperou até 1931 pelo seu prémio.
Em 2007, Gerhard Ertl recebeu o Prémio pelo seu trabalho de catálise de reacções gasosas em sólidos. Entre a vasta gama de reacções que estudou, ganhou provas da adsorção de moléculas de azoto e moléculas de hidrogénio na superfície do ferro e de que estas moléculas adsorvidas se dissociam em átomos. Estes átomos juntam-se então em fases para formar a molécula de amoníaco. É preciso lembrar que as condições utilizadas nestes estudos (a menos de 10-10 atm) são muito diferentes das condições utilizadas na indústria, ca 150 atm.
Sumário
Todo o processo de produção de amoníaco a partir do metano está resumido na Figura 5. Se o carvão ou a nafta é a matéria-prima, são necessários processos extra. A nafta é convertida em metano e óxidos de carbono antes de ir para o reformador primário e daí para a reacção de deslocamento. O carvão é também convertido em hidrogénio e óxidos de carbono e esta mistura é então submetida à reacção de deslocamento.