Nitrato de magnésio representado pela fórmula química Mg(NO3)2 ou MgN2O6 que leva o nome IUPAC dinitrato de magnésio é um pó branco cristalino higroscópico solúvel em água e álcool . É um sal de magnésio e contém ligações químicas que são iónicas por natureza.

Nitrato de Magnésio
Nitrato de Magnésio Identificação |
|
| CAS Number | 10377-60-3 |
| PubChem CID | 25212 |
| ChemSpider ID | 23415 |
| Número CE | 233-826-7 |
Composição e Síntese
Nitrato de magnésio pode ser preparado combinando sulfato de magnésio com nitrato de cálcio .
MgSO4 + Ca(NO3)2 = Mg(NO3)2 + CaSO4
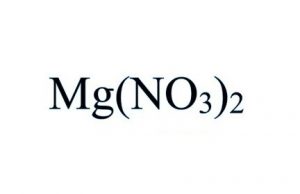
Fórmula de Nitrato de Magnésio
Propriedades e Características do Magnésio Nitrato
Geral Propriedades |
||
| Massa solar/peso molecular | 148.313 g/mol | |
Propriedades físicas |
||
| Cor/aparecimentos | Cristais brancos | |
| Ponto de fusão/ponto de congelação | 89°C, 192.2°F | |
| Boiling point | 330°C, 626°F | |
| Densidade | 1.46 g cm-3 | |
| Estado da matéria à temperatura ambiente (fase normal) | Sólido | |
Química Propriedades |
||
| Solubilidade na água | 42 g/100 ml (a 20oC) | |
| pH | 5-7 (ácido) | |
Propriedades atómicas |
||
| Crystal structure | Cubic | |
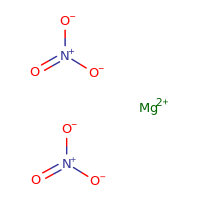 p>Estrutura de nitrato de magnésio
p>Estrutura de nitrato de magnésio Reacções proeminentes de Mg(NO3)2
Uma reacção química entre nitrato de magnésio e carbonato de sódio produz carbonato de magnésio e nitrato de sódio .
Mg(NO3)2 + Na2CO3 = MgCO3 + 2NaNO3
O nitrato de magnésio decompõe-se na água formando hidróxido de magnésio, amoníaco e oxigénio .
Mg(NO3)2 + 4H2O = Mg(OH)2 + 2NH3 + 4O2
No aquecimento de Mg(NO3)2, decompõe-se em óxido de magnésio, dióxido de azoto e oxigénio .
2Mg(NO3)2 = 2MgO + 4NO2 + O2
Reage com hidróxido de sódio para dar hidróxido de magnésio e nitrato de sódio .
Mg(NO3)2 + 2NaOH = Mg(OH)2 + 2NaNO3
Usos de nitrato de magnésio
- Como fonte segura de íons nitrato .
- Na produção de fertilizantes nitrogenados .
- Na fabricação de pirotecnia e ácido nítrico concentrado ..
- Ajuda na perfuração e revestimento para produção de nitrato de amónio e é um ingrediente de cosméticos e champôs .
Is It Dangerous
Sendo um oxidante forte, pode causar um risco de incêndio. Pode também causar um risco de explosão quando posto em contacto com substâncias orgânicas. O contacto com os olhos, pele e inalação deve ser evitado, pois resulta em irritação, tosse e falta de ar. A ingestão em grandes quantidades resulta em dor abdominal, tonturas, diarreia com sangue, vómitos, convulsões, fraqueza e colapso .
- Nitrato de Magnésio – Pubchem.ncbi.nlm.nih.gov
- Nitrato de Magnésio – Chemspider.com
- Nitrato de Magnésio – Americanelements.com
- Nitrato de Magnésio – Sciencemadness.org
- Como é determinada a equação equilibrada de nitrato de magnésio mais água? – Quora.com
li>Nitrato de Magnésio Hexahydrate – Sigmaaldrich.com li>Nitrato de Magnésio – Chemicalbook.com li>Question: Nitrato de Magnésio e Carbonato de Sódio Mg(NO_3)_2 + Na_2 – Chegg.com
li>A decomposição térmica do nitrato de magnésio – Chemiday.com li>Question: O hidróxido de sódio reage com nitrato de magnésio para formar hidróxido de magnésio – Chegg.com