Glycogenolysis, ou decomposição do glicogénio, liberta glicose quando é necessária.
No fígado, o glicogénio é uma reserva de glicose para a manutenção dos níveis normais de glicose no sangue, e a sua decomposição ocorre principalmente:
- no estado de jejum, por exemplo, durante o jejum nocturno;
- durante uma actividade física de alta intensidade.
li> entre as refeições;
Em hepatócitos, a glicogenólise é estimulada pelo glucagon e adrenalina, inibida pela insulina, e sujeita a regulação alérgica negativa também pela glicose (ver abaixo).
No músculo, o glicogénio é uma fonte de energia para a actividade muscular; portanto, a degradação do glicogénio ocorre durante a contracção, e apenas nos músculos envolvidos na actividade.
Em células musculares, a glicogenólise é estimulada pela adrenalina, e regulada por agentes de efeito alérgico positivos e negativos, AMP e ião de cálcio (Ca2+), e ATP e glucose 6-fosfato, respectivamente (ver abaixo).
CONTENTES
- Etapas da glicogenólise
- >li>Destino metabólico da glicose 1-fosfato em músculo e fígado
- β-Receptores adrenérgicos
- Músculo fosforilase cinase
- Hepática phosphorylase kinase
- Muscle glycogen phosphorylase
- Regulação alostérica da PP1
- Hepatic glycogen phosphorylase
- 1-fosfato de glucose (cerca de 90% das moléculas de glucose libertadas);
- uma pequena quantidade de glucose livre, os restantes 10% ;
- uma molécula de glicogénio mais pequena e menos ramificada.
- adrenalina (também conhecida como epinefrina), produzida pelas glândulas supra-renais, que actua por exemplo sobre as células musculares, hepáticas e gordurosas;
- glucagon, produzido pelas células alfa do pâncreas, que actua sobre os hepatócitos e adipócitos.
- an increase in glycogen breakdown in muscle and liver cells;
- an increase in triglyceride breakdown (lipolysis) in adipose tissue.
- glicogénio sintetase (EC 2.4.1.11), inibida;
- T, para tenso ou tenso, que é menos activo;
- G-subunidade, que, na forma fosforilada, não é capaz de ligar a subunidade catalítica do PP1, e portanto o PP1 não atinge os seus alvos associados ao glicogénio (inversamente, a fosforilação da subunidade G induzida pela estimulação da insulina, afectando diversos resíduos de aminoácidos, permite a ligação à subunidade catalítica do PP1);
- inibidor-1, que, na forma fosforilada, é capaz de inibir a actividade do PP1.
- Se uma célula com uma carga energética adequada receber o sinal hormonal que desencadeia a cascata de activações, a glicogénio fosforilase b, inibido por ATP e glucose-6-fosfato, permanece no estado T até a carga ser elevada.
- Se a carga energética celular for baixa, a glicogénio fosforilase b, activada por AMP, inicia a decomposição do glicogénio, mesmo na ausência do estímulo hormonal que induz a sua conversão para a forma activa a.
- A primeira diferença diz respeito à resposta à AMP: a glicogénio hepático fosforilase b não é activada pela AMP.
- A segunda diferença diz respeito à glicogénio fosforilase a: a enzima é inibida pela glicose, que é um inibidor competitivo (o monossacarídeo desloca o equilíbrio alostárico para o estado T inactivo da forma.
/ul> Regulação covalente da glicogenólise em músculo e fígado
Proteínas G estimuladorasAdenil ciclaseProteína cinase AFosforilase cinase Proteína cinase Proteína G estimulante Regulação alostérica da glicogenólise muscular e hepática
Passos de glicogenólise
Glycogenolysis começa pela acção da glicogénese fosforilase (EC 2.4.1.1), um homodímero que para a sua actividade requer a presença de piridoxal-5-fosfato, um derivado da piridoxina ou vitamina B6. A enzima catalisa a clivagem fosforolítica de α-(1,4) ligação glicosídica, libertando as moléculas de glicose uma de cada vez das extremidades não redutoras, ou seja, as extremidades com um grupo livre de 4′-OH, dos ramos externos. Esta reacção, que não consome ATP mas um ortofosfato, produz glicose 1-fosfato.
Glicogénio(n resíduos de glicose) + Pi → Glicose 1-Fosfato + Glicogénio(n-1 resíduos de glicose)
Nota: no intestino delgado, pancreática α-amilase (EC 3.2.1.1) catalisa a clivagem hidrolítica das ligações glicosídicas do amido α-(1,4), e produz moléculas de glucose.
In vivo, a glicogénio fosforilase catalisa uma fosforólise irreversível, uma reacção particularmente vantajosa para o músculo esquelético e o coração (ver abaixo). A irreversibilidade da reacção é assegurada pela relação /, que é normalmente superior a 100. Pelo contrário, a reacção é facilmente reversível in vitro.
A fosforilase glicogénica actua repetitivamente nas extremidades não redutoras dos ramos, parando quando a unidade de glucose que está a 4 resíduos do ponto do ramo é atingida: este é o limite externo do limite da dextrina. Neste ponto, duas actividades enzimáticas, presentes na mesma cadeia de polipeptídeos, degradação completa do glicogénio: a α-(1,4)-glucan-6-glucosiltransferase (EC 2.4.1.24) e a amilo-α-(1,6)-glucosidase ou enzima de detritos (EC 3.2.1.33). A primeira actividade enzimática transfere três das quatro unidades de glucose restantes do ramo para a extremidade não redutora de outro ramo, deixando na primeira cadeia apenas uma única unidade de glucose, que é ligada à cadeia por uma ligação glicosídica α-(1,6)-glycosidic. A segunda actividade enzimática hidrolisa esta ligação α-(1,6)-glicosídica, libertando glicose e uma cadeia não ramificada de unidades de glicose α-(1,4)-linked glucose units.
Sem o ramo, a glicogénio fosforilase pode continuar a remover unidades de glicose até atingir o próximo limite de dextrina.
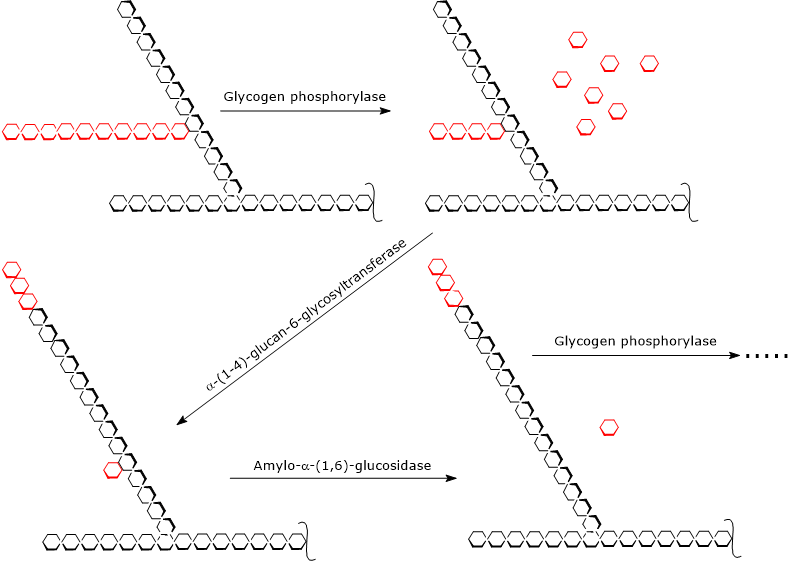
Por isso, os produtos das reacções catalisadas pelas três actividades enzimáticas são:
Metabolic fate of glucose 1-fosfato em músculo e fígado
Glucose 1-fosfato é uma molécula carregada, e portanto está presa dentro da célula.
É convertida em glucose 6-fosfato na reacção catalisada pela fosfoglucomutase (EC 5.4.2.2), a mesma enzima que também intervém na síntese do glicogénio convertendo a glucose 6-fosfato em glucose 1-fosfato. Esta enzima catalisa uma reacção reversível: a direcção é determinada pelas concentrações relativas das duas moléculas e, neste caso, move o grupo fosfato de C1 para C6.
Glucose 1-Fosfato ⇄ Glucose 6-Fosfato
No músculo, e na maioria dos outros órgãos e tecidos, a glicose da glicólise entra na glicólise como glicose 6-fosfato, contornando a etapa de activação catalisada pela hexoquinase. Assim, a glicogénese fosforilase, libertando uma molécula de glicose já “activada”, poupa uma ATP. Uma molécula de ATP é necessária para sintetizar outro intermediário glicolítico, a frutose 1,6-bisfosfato.
Desta forma, uma parte da energia de activação necessária para a síntese do glicogénio é conservada: o rendimento líquido de ATP por molécula de glicose por glicólise ao lactato é de 3 em vez de 2, uma vantagem para o músculo de trabalho. A equação global é:
glicogénio(n resíduos de glicose) + 3 ADP + 3 Pi → Glicogénio(n-1 resíduos de glicose) + 2 lactato + 3 ATP
No fígado, a glicose 6-fosfato de glicogénio é desfosforilada pela glicose 6-fosfatase (EC 3.1.3.9), e depois libertada para a corrente sanguínea. Estes são os passos na remoção de unidades de glucose, sob a forma de glucose fosforilada, por glicogénese hepática:
glicogénio(n resíduos de glicose) + Pi → Glucose 1-Fosfato + Glicogénio(n-1 resíduos de glicose)
glucose-1-fosfato → glucose-6-fosfato
glucose-6-fosfato + H2O → glucose + Pi
A equação geral é
glicogénio(n resíduos de glicose) + H2O → Glicogénio(n-1 resíduos de glicose) +Glicose
Regulação covalente da glicogénese em músculo e fígado
A decomposição do glicogénio está sob um fino controlo através de modificações covalentes e/ou alostéricas de algumas proteínas chave, tais como a fosforilase quinase (EC 2.7.11.19), glicogénio fosforilase, e proteína fosfatase 1.
Aqui, são analisados os efeitos de duas hormonas, que actuam através de modificações covalentes das proteínas alvo:
Estas hormonas, ligadas aos seus receptores de membrana, desencadeiam uma cascata idêntica de eventos intracelulares que amplificam por várias ordens de magnitude o seu sinal, estimulando a glicogenólise e inibindo a síntese do glicogénio.
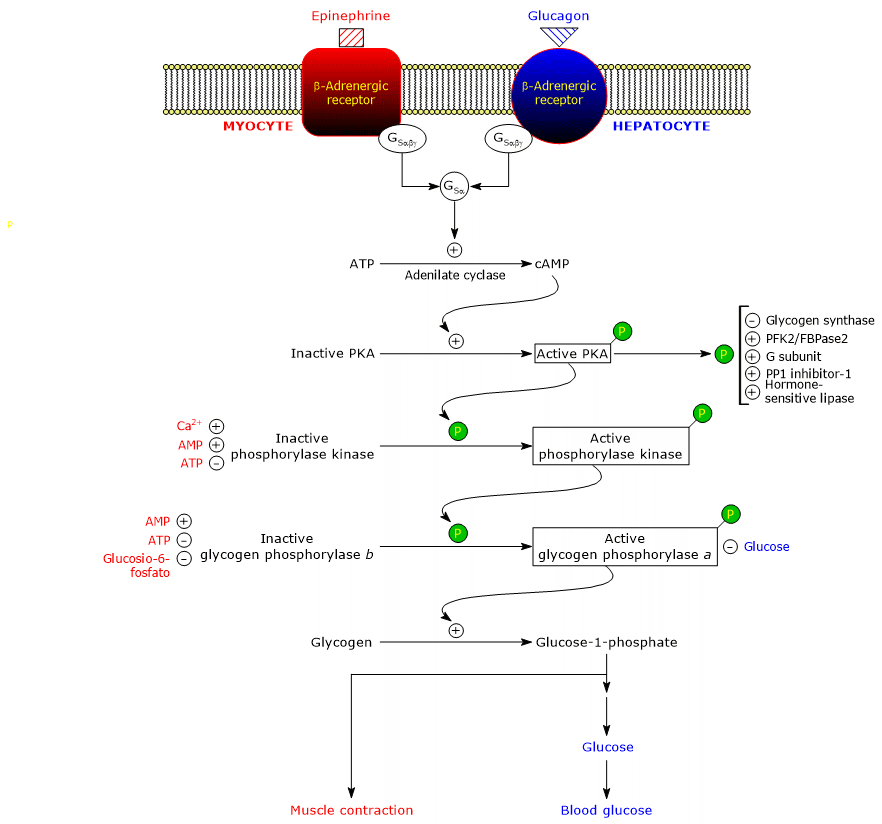
De notar que mesmo a acetilcolina, pela ligação ao receptor localizado na junção neuromuscular, desencadeia a mesma cascata de activações de adrenalina e glucagon.
Aqui, as proteínas envolvidas na cascata.
β-Adrenalina receptores
Os receptores para adrenalina e glucagon são proteínas de membrana integral, com sete transmembranas α-helices.
O termo “adrenérgico” deriva da adrenalina. Existem quatro subtipos de receptores adrenérgicos: α1, α2, β1 e β2. Na discussão subsequente, apenas β1 e β2 receptores, referidos como β, e que actuam da mesma forma, serão considerados.
β-adrenergic receptors cause alterações no metabolismo energético, tais como:
Proteínas G estimulante
A ligação da hormona ao receptor causa uma alteração conformacional na porção citosólica do receptor, e isto modifica a interacção com a segunda proteína da cascata: a proteína de ligação estimulante da guanina nucleotídica ou, mais simplesmente, a proteína G estimulante (GS). É um heterotrimer composto por três subunidades: α (contendo o site de ligação de nucleótidos), β, e γ. Na forma inactiva, GSαβγ-GDP, o heterotrimer é acoplado a receptoresadrenérgicos β.
As alterações conformacionais no receptor permitem-lhe catalisar a substituição do PIB por GTP na subunidade α do complexo GSαβγ. Isto leva à dissociação do trimer num dímero inactivo, βγ, e do complexo GSα-GTP que se move ao longo do plano da superfície interna da membrana plasmática, ao qual é ancorado por um grupo palmitoyl covalentemente ligado, até atingir a adenylyl ciclase (EC 4.6.1.1).
Nota: a acção do GS assemelha-se à das proteínas Ras, outra classe de proteínas G que estão envolvidas na transdução do sinal de insulina.
Adenil ciclase
É uma enzima de membrana integral, cujo local activo se encontra no lado citosólico da membrana plasmática. A interacção entre GSα e a adenil ciclase activa a enzima que, por sua vez, catalisa a síntese de cAMP a partir de ATP. Isto leva a um aumento da concentração intracelular do nucleótido cíclico.
A actividade estimulante do GSα é auto-limitada, pois é um GPTasi, ou seja, hidrolisa o GTP ligado ao PIB, desligando-se assim. Na forma inactiva, GSα dissocia-se da adenil ciclase e reassocia-se com o dímero Gβγ. Portanto, o heterotrimer está novamente disponível para interagir com um complexo hormonal-receptor.
Proteína kinase A
cAMP liga-se e activa cAMP-dependente da proteína quinase ou proteína kinase A ou PKA (EC 2.7.11.11). A forma inactiva da enzima é um tetrâmero composto por duas subunidades catalíticas e duas subunidades reguladoras. Cada uma das duas subunidades reguladoras tem um domínio auto-inibidor, ou seja, uma região que ocupa o local de ligação para o substrato de cada subunidade catalítica. A ligação de duas moléculas de cAMP a dois sítios em cada subunidade reguladora leva a uma mudança conformacional que causa a sua dissociação do tetrâmero, libertando as duas subunidades catalíticas como enzimas activas. A forma activa do PKA catalisa a fosforilação de algumas proteínas, activando ou inibindo-as, tais como:
li> lipase sensível ao hormônio (EC 3.1.1.79), ativada;li>fosfofrutoquinase 2/frutose-2,6-bisfosfatase (EC 2.7.1.105 e EC 3.1.3.46 respectivamente), activada;li>inibidor-1 e a subunidade de ligação ao glicogénio (G)-subunidade de proteína fosfatase 1, activada;li> phosphorylase kinase, activada.
p>cAMP tem uma meia-vida muito curta: é hidrolisada a AMP, que não tem actividade de segundo mensageiro, na reacção catalisada pela nucleotide fosfodiesterase cíclica (EC 3.1.4.53). A cafeína e a teofilina, duas metilxantinas contidas no café e no chá, respectivamente, inibem a fosfodiesterase, aumentando assim a meia-vida da cAMP, e melhorando os seus efeitos.
Phosphorylase kinase
A próxima etapa da cascata é catalisada pela fosforilase kinase.
A proteína é composta por quatro subunidades diferentes, cada uma presente com quatro cópias para formar um complexo referido como (αβγδ)4. As subunidades γ têm actividade catalítica, enquanto que α, β e δ são subunidades reguladoras. α e β subunidades são fosforiladas quando a enzima muda do estado inactivo para o estado activo. A subunidade δ, também chamada calmodulin, é uma proteína reguladora que liga os iões de cálcio. Esta proteína também está presente num grande número de outras enzimas. Actua como um sensor de cálcio, ou seja, responde a alterações na concentração intracelular de cálcio, influenciando a actividade das proteínas com as quais interage (ver abaixo). A fosforilase quinase existe em duas isoformas, uma expressa no fígado e outra no músculo esquelético e cardíaco; diferem em relação às subunidades α e γ, que são codificadas por diferentes genes.
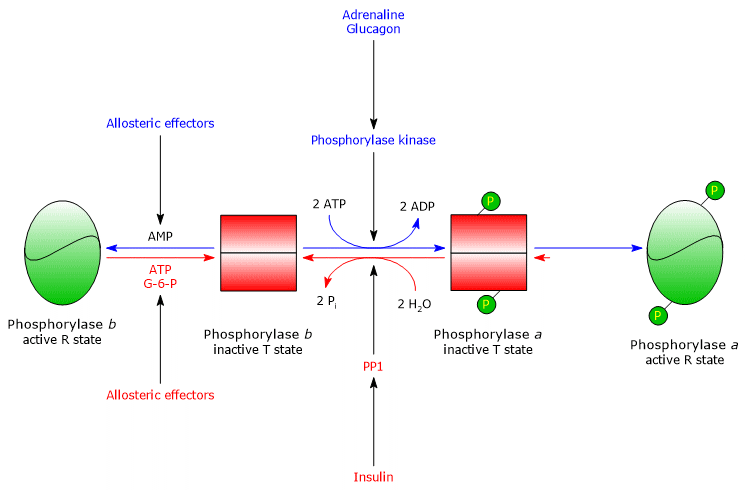
Uma das proteínas alvo da fosforilase quinase é a glicogénese fosforilase. Esta enzima existe como isoenzimas em diferentes tecidos, e em dois estados conformacionais em equilíbrio dinâmico, referidos como:
li>R, para relaxado, que é mais activo, e capaz de se ligar ao glicogénio, também no estado fosforilado (ver abaixo).
O cinase fosforilatos um único resíduo sereno (Ser-14) em cada uma das duas subunidades de glicogénio fosforilase, que está quase inteiramente no estado T, convertendo-o para a forma activa, que, pelo contrário, está quase inteiramente no estado R, e portanto desencadeando a decomposição do glicogénio.
A enzima fosforilase fosforilase é a forma mais activa da enzima e é referida como glicogénio fosforilase a; a enzima não fosforilase é a forma menos activa da enzima, e é referida como glicogénio fosforilase b. As duas formas enzimáticas podem ser inibidas ou activadas alostericamente (ver abaixo).
No músculo, a glicogenólise liberta glicose 1-fosfato que, como se viu anteriormente, é metabolizada no próprio músculo para produzir energia para contracção muscular, e portanto para a resposta de luta-ou-voo desencadeada pela adrenalina.
No fígado, o glucagon desencadeia a libertação de glicose na circulação para contrariar a hipoglicemia.
Após o fim da situação stressante, a fosforilase a fosfatase, também chamada fosfoproteína fosfatase 1 ou PP1 (EC 3.1.3.17), catalisa a remoção dos grupos fosfatos da fosforilase quinase e da glicogénio fosforilase a, convertendo-os assim em formas inactivas (a enzima remove também os grupos fosfatos da glicogénio sintetase). PP1 é constituída por uma subunidade catalítica, que tem baixa eficiência catalítica e baixa afinidade para o glicogénio, e a referida subunidade G, que pertence a uma família de proteínas que ligam outras proteínas ao glicogénio, conhecidas como proteínas alvo do glicogénio (também a quinase da fosforilase, a fosforilase do glicogénio, e a glicogénio-sintase estão ligadas a partículas de glicogénio por proteínas desta família).
PP1 é também inibida por outra proteína chamada inibidor 1 de PP1.
como anteriormente visto, os fosforilatos de PKA:
Por conseguinte, a ligação da hormona ao seu receptor desencadeia uma reacção em cascata que, entre outras coisas, leva à inibição da actividade do PP1. Isto mantém fosforilase glicogénio fosforilase e glicogénio sintetase fosforilase fosforilase: a primeira enzima é activada enquanto que a segunda é inibida. Desta forma, o metabolismo dos hidratos de carbono é optimizado.
Regulação alostérica da glicogénese no músculo e fígado
A glicogénese também é regulada por ambos os efectores alostéricos positivos e negativos. Actuam sobre três enzimas: fosforilase muscular quinase, hepática e músculo glicogénio fosforilase, e PP1.
Músculo fosforilase quinase
A actividade enzimática é regulada por dois efectores alostéricos positivos, ião de cálcio e AMP, e um efector alostérico negativo, ATP.
Um aumento da concentração intracelular de ião de cálcio é o sinal de contracção muscular e, uma vez libertado do retículo sarcoplasmático, o cálcio liga-se à subunidade δ (calmodulin) da enzima, activando-a.
AMP acumula-se no músculo durante a contracção intensa, devido ao consumo de ATP, e liga-se à enzima e activa-a. Pelo contrário, quando a concentração de ATP é elevada, ou seja, o músculo não se contrai, liga-se ao local alostérico para inactivar a cinase.
Fosforilase kinase hepática
algumas hormonas podem actuar tanto por desencadear modificações covalentes das proteínas alvo como por provocar a libertação de iões de cálcio do retículo endoplasmático.
No fígado, a fosforilase kinase é regulada por hormonas que provocam a libertação de iões de cálcio. Exemplos são a vasopressina, mas também a adrenalina quando esta se liga aos receptores α1. Em relação à adrenalina, a sua ligação aos receptores α1 activa uma proteína G que estimula a fosfolipase C-β, que por sua vez converte o fosfatidilinositol-4,5-bisfosfato em inositol 1,4,5-trifosfato (IP3) e diacilglicerol. O inositol 1,4,5-trifosfato provoca a libertação de iões de cálcio a partir do retículo endoplasmático. Os iões de cálcio, ligados à subunidade δ de fosforilase quinase, levam à sua activação.
Músculo glicogénio fosforilase
Músculo glicogénio fosforilase b é activado na presença de altas concentrações de AMP, que, ligando-se a um local específico de ligação de nucleótidos, altera a estrutura quaternária da enzima, deslocando o equilíbrio alostárico para o estado activo R da forma b. Pelo contrário, o ATP e o glucose-6-fosfato, que competem com o AMP para o mesmo sítio de ligação de nucleótidos, actuam como agentes de efeito alostárico negativos, deslocando o equilíbrio alostárico para o estado T inactivo da forma b.
Músculo glicogénio fosforilase a é activo, independentemente dos níveis de AMP, ATP, e glucose-6-fosfato.
No músculo em repouso, quase toda a glicogénio fosforilase está na forma b inactiva.
De facto, a regulação covalente e alostérica da enzima assegura que os níveis de glicose intracelular são finamente regulados.
Regulação alostérica da PP1
PP1 é activada alostericamente pelo glucose-6-fosfato, portanto quando a carga de energia celular é baixa.
Hepatic glycogen phosphorylase
No fígado, a regulação alostérica da enzima ocorre através de diferentes mecanismos.
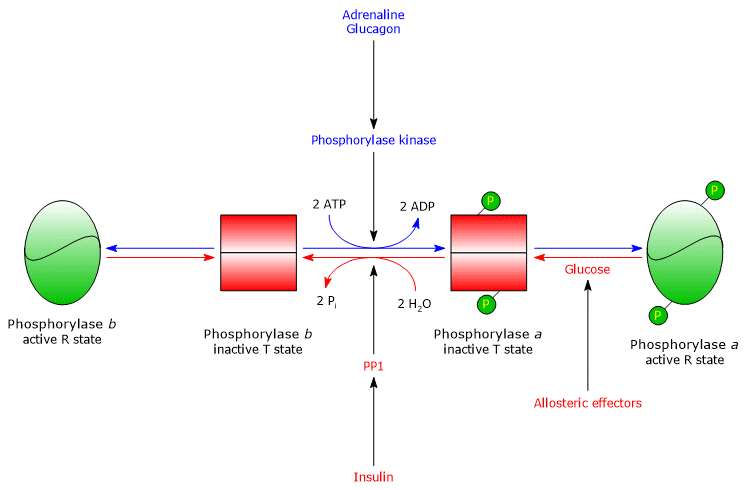
no fígado, o objectivo da glicogenólise é fornecer glicose a outros tecidos quando o nível de glicose no sangue é baixo. Quando o nível de glicose no sangue volta ao normal, a sua concentração em hepatócitos aumenta e liga-se à glicogénese fosforilase a, induzindo uma alteração conformacional que expõe os resíduos serínicos fosforilados à actividade PP1, que inactiva a enzima através da desfosforilação. Portanto, o local alostérico para a glicose da glicogénio fosforilase hepática permite que a enzima actue como um sensor de glucose no sangue, respondendo adequadamente às alterações do nível de glucose no sangue. Em última análise, a isoenzima hepática responde apenas à glucose, não à AMP, ou seja, à carga de energia celular, e isto é notável porque os ácidos gordos, e não a glucose, são a fonte primária de energia para o fígado.
Berg J.M., Tymoczko J.L., e Stryer L. Biochemistry. 5ª edição. W. H. Freeman and Company, 2002
Nelson D.L., M. M. Cox M.M. Lehninger. Princípios da bioquímica. 4ª edição. W. H. Freeman and Company, 2004
Rawn J.D. Biochimica. Mc Graw-Hill, Neil Patterson Publishers, 1990
Roach P.J., Depaoli-Roach A.A., Hurley T.D., Tagliabracci V.S. Glycogen e o seu metabolismo: alguns novos desenvolvimentos e velhos temas. Biochem J 2012:441;763-87. doi:10.1042/BJ20111416
Rosenthal M.D., Glew R.H. Medical Biochemistry – Human Metabolism in Health and Disease. John Wiley J. & Sons, Inc., Publication, 2009