Todos os sais e iões que se dissolvem na água do mar contribuem para a sua salinidade global. A salinidade da água do mar é geralmente expressa em gramas de sal por quilograma (1000 g) de água do mar. Em média, cerca de 35 g de sal estão presentes em cada 1 kg de água do mar, por isso dizemos que a salinidade média do oceano é de 35 partes por mil (ppt). Note-se que 35 ppt é equivalente a 3,5% (partes por cem). Algumas fontes utilizam agora unidades práticas de salinidade (PSU) para expressar valores de salinidade, onde 1 PSU = 1 ppt. As unidades não estão incluídas, pelo que podemos referir-nos simplesmente a uma salinidade de 35,
Muitas substâncias diferentes são dissolvidas no oceano, mas seis iões compreendem cerca de 99,4% de todos os iões dissolvidos na água do mar. Estes seis iões principais são (Tabela 5.3.1):
Tabela 5.3.1 Os seis iões principais em água do mar
| g/kg em seawater | ||
|---|---|---|
| Chloride Cl- | 19.35 | 55,07% |
| Na+ de sódio | 10,76 | 30,6% |
| 2,71 | 7.72% | |
| 1,29 | 3,68% | |
| Cálcio Ca2+ | 0,41 | 1,17% |
| Potássio K+ | 0,39 | 1.1% |
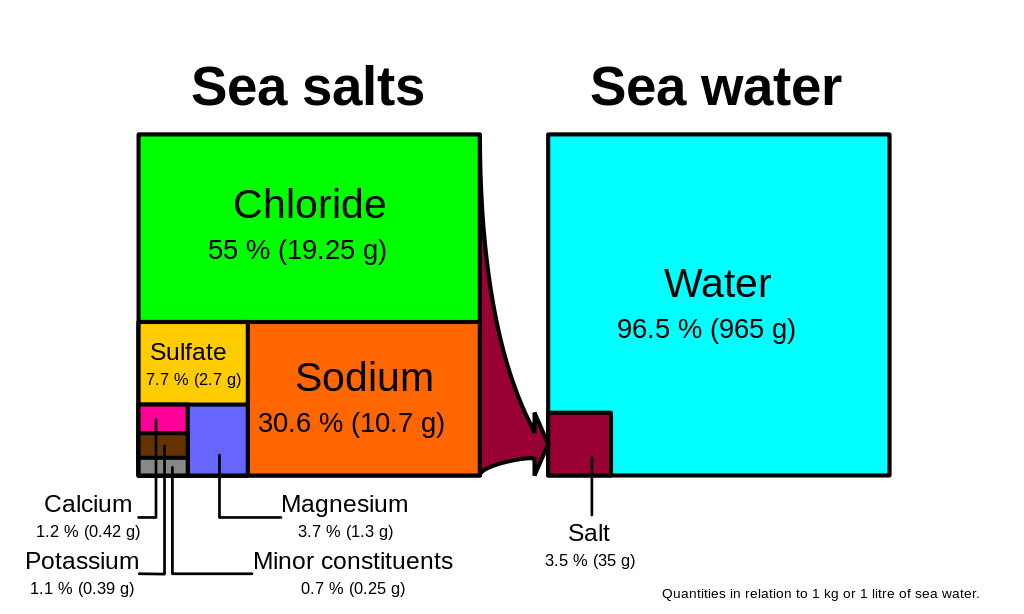
cloreto e sódio, os componentes do sal de mesa (cloreto de sódio NaCl), constituem mais de 85% dos iões no oceano, razão pela qual a água do mar sabe a sal (Figura 5.3.1). Além dos constituintes principais, existem numerosos constituintes menores; radionucleótidos, compostos orgânicos, metais, etc. Estes constituintes menores encontram-se em concentrações de ppm (partes por milhão) ou ppb (partes por bilião), ao contrário dos iões maiores que são muito mais abundantes (ppt) (Tabela 5.3.2). Para pôr isto em perspectiva, 1 ppm = 1 mg/kg, ou o equivalente a 1 colher de chá de açúcar dissolvido em 14.000 latas de soda. 1 ppb = 1 μg/kg, ou o equivalente a 1 colher de chá de uma substância dissolvida em cinco piscinas de dimensão olímpica! Estes constituintes menores representam numerosas substâncias, mas juntos constituem menos de 1% dos iões na água do mar. Alguns destes podem ser importantes como minerais e oligoelementos vitais para os organismos vivos, mas não têm muito impacto na salinidade global. Mas dado o vasto tamanho dos oceanos, mesmo os materiais encontrados na abundância de vestígios podem representar reservatórios bastante grandes. Por exemplo, o ouro é um oligoelemento na água do mar, encontrado em concentrações de partes por trilhão, no entanto, se se pudesse extrair todo o ouro em apenas um km3 de água do mar, valeria cerca de 20 milhões de dólares!
Tabela 5.3.2 Concentrações de alguns elementos menores em água do mar
| g/kg em seawater | g/kg em água do mar | ||
|---|---|---|---|
| Carbon | 0.028 | Iron | 2 x 10-6 |
| Nitrogénio | 0.0115 | Manganês | 2 x 10-7 |
| Oxigénio | 0.006 | Cobre | 1 x 10-7 |
| Silicone | 0.002 | Mercúrio | 3 x 10-8 |
| Fósforo | 6 x 10-5 | Douro | 4 x 10-9 |
| Urânio | 3.2 x 10-6 | Lead | 5 x 10-10 |
| Alumínio | 2 x 10-6 | Radon | 6 x 10-19 |
Porque os seis iões principais em água do mar compreendem mais de 99% da salinidade total, alterações na abundância dos constituintes menores têm pouco efeito na salinidade global. Além disso, a regra das proporções constantes afirma que embora a salinidade absoluta da água do oceano possa diferir em locais diferentes, as proporções relativas dos seis iões maiores dentro dessa água são sempre constantes. Por exemplo, não importa a salinidade total de uma amostra de água do mar, 55% da salinidade total será devido ao cloreto, 30% devido ao sódio, e assim por diante. Uma vez que a proporção destes iões maiores não se altera, chamamos a estes iões conservadores.
Dadas estas proporções constantes, para calcular a salinidade total pode simplesmente medir a concentração de apenas um dos iões maiores e utilizar esse valor para calcular o resto. Tradicionalmente, o cloreto tem sido o íon medido porque é o mais abundante, e portanto o mais simples de medir com precisão. Multiplicando a concentração de cloreto por 1,8, obtém-se a salinidade total. Por exemplo, olhando para a Figura 5.3.1, 19,25 g/kg (ppt) de cloreto x 1,8 = 35 ppt. Actualmente, para medições rápidas da salinidade, a condutividade eléctrica é frequentemente utilizada em vez de determinar as concentrações de cloreto (ver caixa abaixo).
Existem vários métodos disponíveis para medir a salinidade da água. As medições mais precisas utilizam a análise química directa da água do mar num ambiente de laboratório, mas existem várias formas de obter medições imediatas da salinidade no campo. Para uma estimativa rápida da salinidade, pode ser utilizado um refractómetro portátil (direita).

Este instrumento mede o grau de flexão, ou refracção, dos raios de luz à medida que passam por um fluido. Quanto maior for a quantidade de sais dissolvidos na amostra, maior será o grau de refracção da luz. O observador prende uma gota de água no ecrã azul, e olha através da ocular. A linha divisória entre as secções azul e branca da escala (inset) pode ser usada para ler a salinidade.
Para medições mais precisas, a maioria dos oceanógrafos usa um instrumento que mede a condutividade eléctrica. Uma corrente eléctrica é passada entre dois eléctrodos imersos em água, e quanto maior for a salinidade, mais rapidamente a corrente será conduzida (os iões na água do mar conduzem correntes eléctricas). As sondas de condutividade são frequentemente agrupadas num instrumento chamado CTD, que significa Condutividade, Temperatura, e Profundidade, que são os parâmetros mais frequentemente medidos. Os CTD modernos podem ser equipados com um conjunto de sondas que medem parâmetros como luz, turbidez (claridade da água), gases dissolvidos, etc. Os CTD podem ser instrumentos grandes (abaixo), mas pequenas sondas de salinidade portáteis também estão amplamente disponíveis.

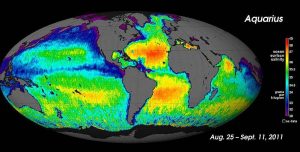
Para medições de salinidade em grande escala, os oceanógrafos podem utilizar satélites, tais como o satélite Aquarius, que foi capaz de medir diferenças de salinidade de superfície tão pequenas como 0,2 PSU, uma vez que mapeava a superfície do oceano a cada sete dias (abaixo).
É importante estar ciente de que embora a regra das proporções constantes se aplique à maior parte do oceano, pode haver certas zonas costeiras onde muitas descargas fluviais podem alterar ligeiramente estas proporções. Além disso, é importante lembrar que a regra das proporções constantes só se aplica aos iões principais. As proporções dos iões menores podem flutuar, mas lembrem-se que contribuem muito pouco para a salinidade global. Como as concentrações dos iões menores não são constantes, estes são referidos como iões não conservadores.
Porquê os iões maiores encontrados em proporções constantes? Há uma entrada constante de iões do escoamento de rios e outros processos, geralmente em proporções muito diferentes do que se encontra no oceano. Então porque é que as proporções nos oceanos não mudam? A maioria dos iões descarregados pelos rios têm tempos de residência bastante baixos (ver secção 5.2) em comparação com os iões na água do mar, geralmente porque são utilizados em processos biológicos. Estes tempos de residência baixos não permitem que os iões se acumulem e alterem a salinidade. Além disso, o tempo de mistura do oceano mundial é de cerca de 1000 anos, o que é muito curto em comparação com os tempos de residência dos iões maiores, que podem ter dezenas de milhões de anos de duração. Assim, durante o tempo de residência de um único íon, o oceano misturou inúmeras vezes, e os iões maiores tornaram-se uniformemente distribuídos pelo oceano.
Variações em Salinidade
Salinidade total no oceano aberto é em média de 33-37 ppt, mas pode variar significativamente em diferentes locais. Mas como as maiores proporções de iões são constantes, as diferenças regionais de salinidade devem-se mais à entrada e remoção de água do que à adição ou remoção de iões. A entrada de água doce passa por processos como a precipitação, o escoamento da terra e o degelo fundente. A remoção de água doce provém principalmente da evaporação e congelação (quando a água do mar congela, o gelo resultante é principalmente água doce e os sais são excluídos, tornando a água restante ainda mais salgada). Assim, as diferenças nas taxas de precipitação, evaporação, descarga fluvial e formação de gelo desempenham um papel significativo nas variações regionais de salinidade. Por exemplo, o Mar Báltico tem uma salinidade superficial muito baixa de cerca de 10 ppt, porque é uma massa de água maioritariamente fechada com muita entrada no rio. Pelo contrário, o Mar Vermelho é muito salgado (cerca de 40 ppt), devido à falta de precipitação e ao ambiente quente que leva a elevados níveis de evaporação.
Um dos grandes corpos de água mais salgados da Terra é o Mar Morto, entre Israel e a Jordânia. A salinidade no Mar Morto é de cerca de 330 ppt, o que é quase dez vezes mais salgada do que o oceano. Esta salinidade extremamente elevada é o resultado das condições quentes e áridas do Médio Oriente, que levam a altas taxas de evaporação. Além disso, nos anos 50, o caudal do rio Jordão foi desviado do Mar Morto, pelo que já não há uma entrada significativa de água doce. Sem entrada e com elevada evaporação, o nível da água no Mar Morto está a baixar a uma taxa de cerca de 1 m por ano. A elevada salinidade torna a água muito densa, o que cria forças flutuantes que permitem que as pessoas flutuem facilmente à superfície. Mas a elevada salinidade também significa que a água é demasiado salgada para a maioria dos organismos vivos, pelo que apenas os micróbios são capazes de lhe chamar casa; daí o nome Mar Morto. Mas por muito salgado que seja o Mar Morto, não é o corpo de água mais salgado da Terra. Esta distinção pertence actualmente à Gaet’ale Pond na Etiópia, com uma salinidade de 433 ppt!
Variações de latitude
p>Embora as condições locais sejam importantes para determinar padrões de salinidade em qualquer local, existem alguns padrões globais que suportam uma investigação mais aprofundada. A temperatura é mais elevada no equador, e mais baixa perto dos pólos, pelo que seria de esperar maiores taxas de evaporação, e portanto maior salinidade, nas regiões equatoriais (Figura 5.3.2). Este é geralmente o caso, mas na figura abaixo da salinidade ao longo do equador parece ser um pouco mais baixa do que em latitudes ligeiramente mais elevadas. Isto porque as regiões equatoriais também recebem um volume elevado de chuva numa base regular, o que dilui a água superficial ao longo do equador. Assim, as salinidades mais elevadas encontram-se em latitudes subtropicais, quentes, com alta evaporação e menos precipitação. Nos pólos há pouca evaporação, o que, juntamente com o derretimento do gelo e da neve, produz uma salinidade superficial relativamente baixa. A imagem abaixo mostra uma elevada salinidade no Mar Mediterrâneo; esta situa-se numa região quente com elevada evaporação, e o mar está largamente isolado da mistura com o resto da água do Atlântico Norte, levando a uma elevada salinidade. Salinidades mais baixas, tais como as do sudeste asiático, são o resultado de precipitação e altos volumes de entrada do rio.
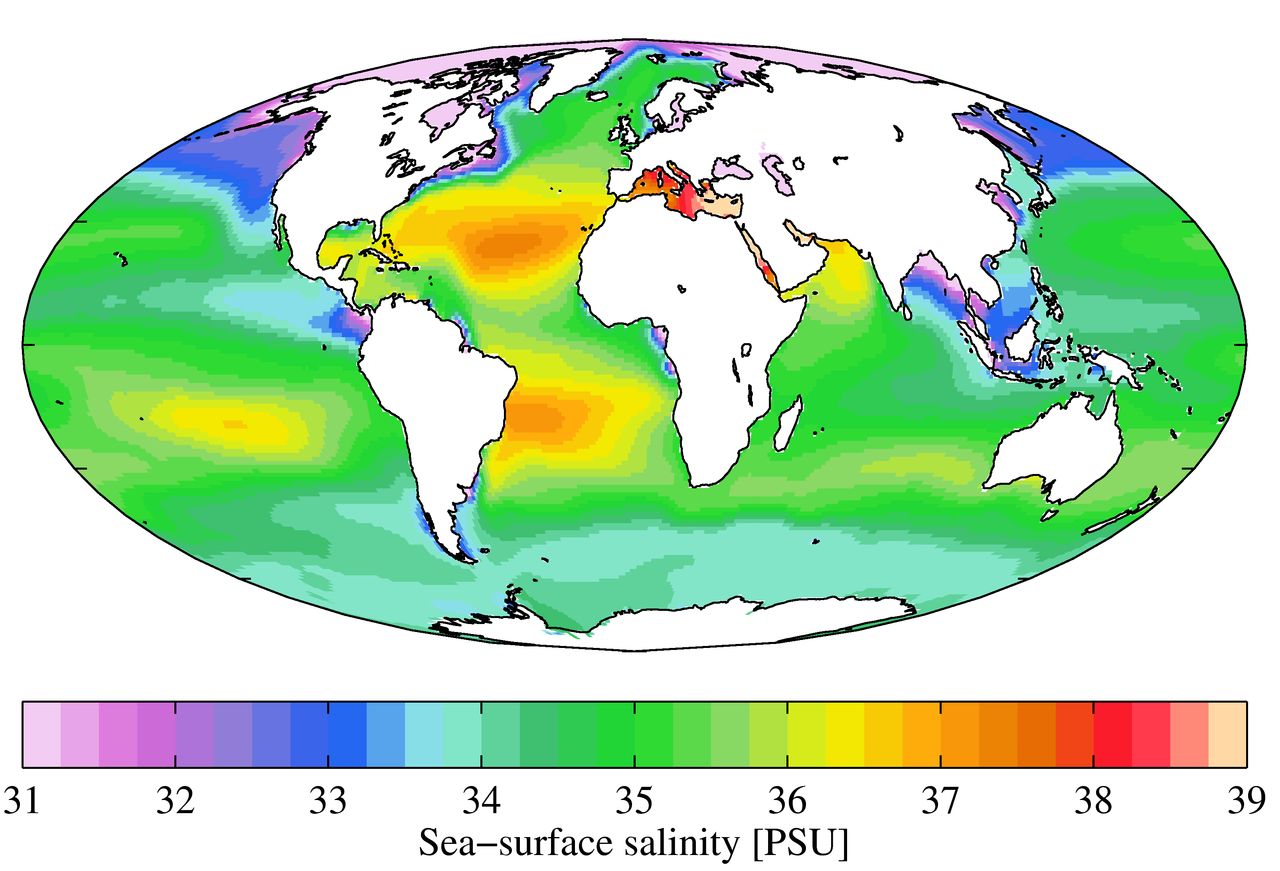
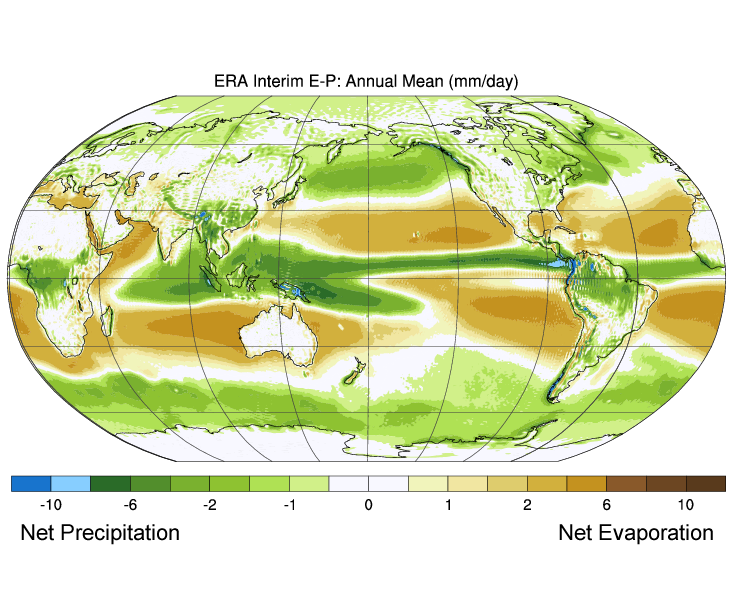
Figure 5.3.3 mostra as diferenças médias globais entre evaporação e precipitação (evaporação – precipitação). As cores verdes representam áreas onde a precipitação excede a evaporação, enquanto que as regiões castanhas são onde a evaporação é maior do que as precipitações. Note-se a correlação entre precipitação, evaporação, e salinidade superficial como se vê na Figura 5.3.2.
p> Variação Vertical
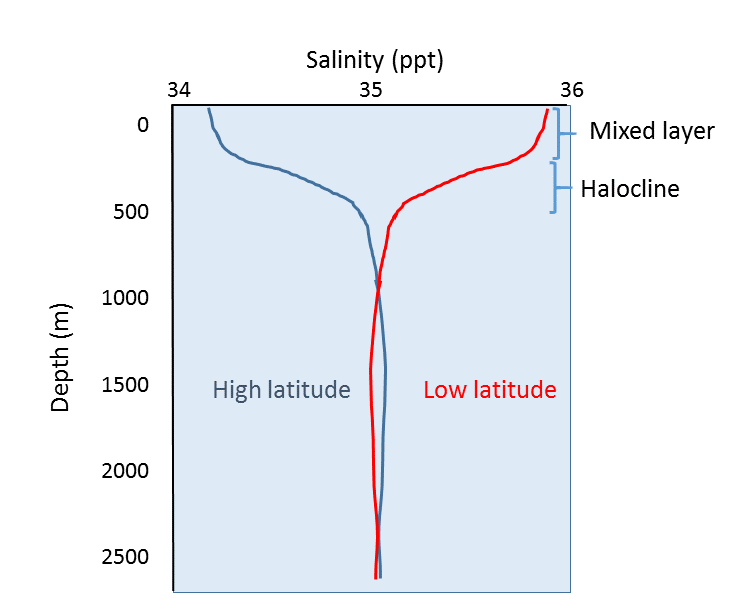
Além da variação geográfica da salinidade, há também mudanças na salinidade com profundidade. Como vimos, a maioria das diferenças na salinidade deve-se a variações na evaporação, precipitação, escorrimento e cobertura de gelo. Todos estes processos ocorrem à superfície do oceano, não em profundidade, pelo que as diferenças mais pronunciadas de salinidade devem ser encontradas nas águas superficiais. A salinidade em águas mais profundas permanece relativamente uniforme, uma vez que não é afectada por estes processos à superfície. Alguns perfis representativos de salinidade são mostrados na Figura 5.3.4. À superfície, os cerca de 200 m de topo mostram uma salinidade relativamente uniforme no que se chama a camada mista. Ventos, ondas e correntes superficiais agitam a água superficial, causando uma grande quantidade de mistura nesta camada e condições de salinidade bastante uniformes. Abaixo da camada mista há uma área de rápida mudança de salinidade sobre uma pequena mudança de profundidade. Esta zona de mudança rápida é chamada de haloclina, e representa uma transição entre a camada mista e o oceano profundo. Abaixo da haloclina, a salinidade pode mostrar pouca variação até ao fundo do mar, uma vez que esta região está muito afastada dos processos de superfície que têm impacto na salinidade. Na figura abaixo, note-se a baixa salinidade superficial em latitudes elevadas, e a salinidade superficial superior em latitudes baixas, como discutido acima. No entanto, apesar das diferenças de superfície, a salinidade em profundidade em ambos os locais pode ser muito semelhante.
um átomo ou molécula que ganhou ou perdeu electrões e que assim se tornou carregada (5.1)
a concentração de iões dissolvidos na água (5.3)
uma medida de salinidade sem unidade igual a partes por mil (5.3)
os seis iões que compõem mais de 99% dos iões no oceano (cloreto, sódio, sulfato, magnésio, cálcio, potássio) (5.3)
os iões principais na água do mar são sempre encontrados nas mesmas proporções, independentemente da salinidade global (5.3)
partes por mil
a distância norte ou sul do equador, medida como um ângulo a partir do equador (2.1)
onde há uma mudança dramática na salinidade sobre uma pequena mudança de profundidade (5.3)